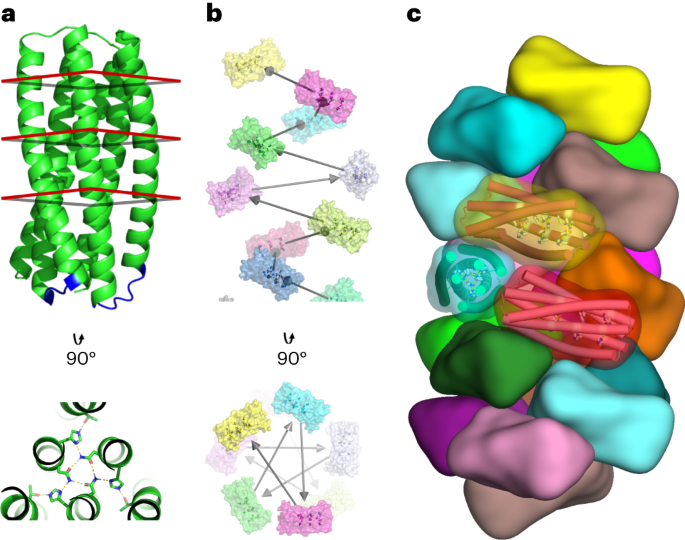
Computationele ontwerpstrategie
Korte lussen om pRO-2.3-helices tot een enkele keten te verbinden werden ontworpen met behulp van een uitgebreide database van ruggengraatmonsters samengesteld uit fragmenten die twee spiraalvormige gebieden omspannen, zoals geïdentificeerd door DSSP in kristallografische structuren met hoge resolutie (zoals eerder beschreven14). In deze database werden lussen geïdentificeerd via een rigide uitlijning van de terminale residuen van het fragment en het doelwit met behulp van een geoptimaliseerd superpositie-algoritme15. Kandidaten die voldeden aan een uitlijningstolerantie van 0.35 Å RMSD werden uitgelijnd op de doelruggengraat via torsie-ruimtecoördinaten en zachte coördinaatbeperkingen op de uitgelijnde kandidaat-hoofdketen van zware atoomcoördinaten. Kandidaat-lussequenties werden vervolgens ontworpen onder beperkingen van het sequentieprofiel die werden gegenereerd via uitlijning van de lus-backbone met de bronstructuurdatabase. Voor het uiteindelijke lusontwerp werden de kandidaten met de laagste scores geselecteerd.
Spiraalvormige docking- en ontwerpmethoden7 werden toegepast op de gekoppelde pRO-2.3 om spiraalvormige filamentontwerpmodellen te genereren. De volgende criteria filterden individuele ontwerptrajecten: een discrepantie van meer dan -15.0 Rosetta-energie-eenheden tussen de gebonden (polymere) en ongebonden (monomere) toestanden, een grensvlakoppervlak van meer dan 700 Å2, een Rosetta-vormcomplementariteit van meer dan 0.62 en een ontevreden polaire residuen tellen onder de 5. Ontwerpen die aan deze criteria voldeden, ondergingen handmatige verfijning, waarbij op één punt werd teruggedraaid naar mutaties die niet werden geacht bij te dragen aan het stabiliseren van de gebonden toestand van het grensvlak. Het best scorende ontwerp voor elke gekoppelde configuratie werd vervolgens geïntegreerd in een definitieve eiwitset voor experimentele validatie.
Eiwitexpressie en zuivering
De synthetische genen voor in totaal 18 ontwerpen werden geoptimaliseerd voor expressie in Escherichia coli en verkregen van IDT, vervolgens ingevoegd in de meervoudige kloneringsplaats van de pET29b+-vector tussen NdeI- en XhoI-restrictieplaatsen. Deze constructen werden geïntroduceerd in BL21* (DE3) E. coli competente cellen. Transformanten werden gekweekt in 50 ml Terrific Broth-medium aangevuld met 200 mg l-1 kanamycine. Expressie, onder controle van een T7-promoter, vond 24 uur plaats bij 37 ° C met behulp van Studier-auto-inductie16 totdat de culturen werden geoogst door centrifugatie. Celpellets werden opnieuw gesuspendeerd in Tris-gebufferde zoutoplossing (TBS) en gelyseerd met Bugbuster-detergens. De oplosbare fractie, geklaard door centrifugatie, onderging zuivering via Ni2+ geïmmobiliseerde metaalaffiniteitschromatografie met behulp van Ni-NTA Superflow-hars. De hars met gebonden cellysaat werd gewassen met tien kolomvolumes van 40 mM imidazool en 500 mM NaCl, gevolgd door elutie met 400 mM imidazool en 75 mM NaCl. De oplosbare en onoplosbare fracties werden onderworpen aan SDS-polyacrylamidegelelektroforese-analyse. Monsters die eiwitbanden met het juiste molecuulgewicht vertoonden, werden gekozen voor screening met elektronenmicroscopie. Geselecteerde ontwerpen werden opgeschaald naar 0.5 l voor verdere karakterisering, waarbij de expressie opnieuw 24 uur bij 37 ° C plaatsvond met behulp van Studier-auto-inductie16 alvorens te oogsten door centrifugeren. Celpellets werden opnieuw gesuspendeerd in TBS en gelyseerd door microfluïdisatie, gevolgd door zuivering zoals hierboven beschreven.
Negatieve vlek EM
Oplosbare fracties werden geconcentreerd in TBS (25 mM Tris-buffer, 75 mM NaCl, pH 8) voor screening met elektronenmicroscopie. Een druppeltje van 6 µl (1 µl monster onmiddellijk verdund met 5 µl buffer) werd aangebracht op negatief gloeiend ontladen, met koolstof beklede koperen roosters van 200 mesh, gewassen met Milli-Q-water en gekleurd met behulp van 0.75% uranylformiaat (pH 4.0). ) of Nano-W (pH 6.8) gekocht bij Nanoprobes, Inc. zoals eerder beschreven17. Screening werd uitgevoerd met behulp van een 100 kV Morgagni M268 transmissie-elektronenmicroscoop (FEI) of een 120 kV Talos L120C transmissie-elektronenmicroscoop (ThermoFisher). Beelden zijn vastgelegd met behulp van een Teitz CMOS 4k-camerasysteem aan de onderkant en verwerkt voor verbeterd contrast met behulp van Fiji-software (versie: 2.14.0/1.54f)18 voor alle duidelijkheid.
Vezellengtes werden gekwantificeerd met behulp van het vezeltraceringsalgoritme in cryoSPARC8. Deze methode identificeert vezels door kruiscorrelatie met een sjabloonklasse en het traceren van aangrenzende vezels van de geïdentificeerde deeltjes. Voor alle gemeten vezels werd een sjabloonklasse gebruikt, gegenereerd op basis van DpHF19. Vezels werden gefilterd volgens de gemiddelde kromming (<0.0005 Å-1) en de gemiddelde genormaliseerde kruiscorrelatie (>0.5) over elke vezel. Voor DpHF18 hebben we 5, 2, 3, 20, 28 en 21 afbeeldingen gebruikt voor respectievelijk pH 3, 3.5, 4.2, 5, 8 en 3 tot 8. Voor DpHF19 hebben we respectievelijk 7, 8, 8, 28, 4 en 5 afbeeldingen gebruikt voor pH 3, 3.5, 4.2, 5, 8 en 3 tot 8. Voor DpHF19_9his hebben we 6, 6, 8, 14, 15, 8 en 4 afbeeldingen gebruikt voor respectievelijk pH 3, 3.5, 4.2, 5, 6, 8 en 3 tot 8.
Cryo-EM
Cryo-EM-monsters werden bereid door eiwit aan te brengen op CFLAT-koolstofroosters, vloeistof weg te deppen en de roosters in vloeibaar ethaan te dompelen met behulp van een Vitrobot (ThermoFisher). Voor DpHF19 werden video's opgenomen op een Glacios-microscoop (ThermoFisher) uitgerust met een K-2 Summit Direct Detect-camera (Gatan Inc.) die in telmodus werkte, met een pixelgrootte van 1.16 Å per pixel, 50 frames en een totale elektronendosis van 65Å-2. Voor DpHF18 en DpHF7 zijn video's opgenomen op een Titan Krios (ThermoFisher) uitgerust met een K-2 Summit Direct Detect-camera (Gatan Inc.) die werkt in superresolutiemodus, met een pixelgrootte van 0.525 Å per pixel, 50 frames en een totale elektronendosis van 90 Å-2. Geautomatiseerde gegevensverzameling werd uitgevoerd met behulp van Leginon19 versie 3.4. Gegevensverwerking werd uitgevoerd met behulp van cryoSPARC8en workflows zijn samengevat in aanvullende figuren. 10-12. De video's werden uitgelijnd door patch-bewegingscorrectie, waarbij video's met superresolutie werden weggegooid tot een pixelgrootte van 1.05 Å. Contrastoverdrachtsfunctie (CTF)-parameters werden geschat met behulp van patch-CTF. Sjabloonvrije filamenttracering werd uitgevoerd op een subset van afbeeldingen en de resulterende deeltjes werden onderworpen aan 2D-classificatie. Geselecteerde 2D-klassen werden vervolgens gebruikt als sjablonen voor op sjablonen gebaseerde filamenttracering op volledige datasets. Na meerdere rondes van 2D-classificatie werden geselecteerde deeltjes onderworpen aan 3D-verfijning met opgelegde spiraalsymmetrie en niet-uniforme verfijning ingeschakeld. Voor DpHF19 hebben we spiraalsymmetrie met één start opgelegd die individuele, niet-contacterende subeenheden met elkaar in verband brengt, in plaats van de parameters voor spiraalsymmetrie met twee startpunten. Voor DpHF7 en DpHF19 werden ook de defocus per deeltje, de bundelkanteling en sferische aberratie verfijnd. Dichtheidsmodificatie werd uitgevoerd met behulp van ResolveCryoEM in Phenix20,21 versie phenix-1.20.1. Atoommodellen voor DpHF18 en DpHF19 werden verfijnd tot cryo-EM-kaarten met behulp van ISOLDE22, gevolgd door verfijning van de echte ruimte in Phenix, waarbij rotamer- en Ramachandran-beperkingen zijn uitgeschakeld en met referentiebeperkingen opgelegd door het invoerstartmodel. Bij de opheldering van het model voor DpHF7 werd gebruik gemaakt van het de novo modelbouwprotocol op de gesegmenteerde cryo-EM asymmetrische eenheidsdichtheid23. Daaropvolgende residu-opname en verfijning werden bereikt met behulp van RosettaCM24 versie 2019.31, waarbij gebruik wordt gemaakt van symmetrie over de niet-gesegmenteerde cryo-EM-kaart voor optimale fit-to-density- en intra-filament-interfaces. Een laatste ronde van verfijning in de echte ruimte werd uitgevoerd in Phenix, zoals hierboven beschreven voor DpHF18 en DpHF19. Cryo-EM-gegevensverzameling, verfijning en validatiestatistieken zijn samengevat in de aanvullende tabel 1.
TIRFM
Vezel assemblage
Om de kiemvorming van pH-responsieve vezels in beeld te brengen, werden DpHF18-vezels gelabeld met twee verschillende maleïmide-geconjugeerde fluoroforen, Oregon488 en sulfo-Cy5. Vezels werden gelabeld met een 10 x molaire overmaat, in PBS + 1 mM TCEP gedurende 4 uur bij kamertemperatuur, vóór bufferuitwisseling in TBS (25 mM Tris, 100 mM NaCl, pH 8.0) op een Zeba-spinkolom en concentratie tot 30 μM . Groene vezels van 30 μM werden gedemonteerd door de toevoeging van 1 M citraat (0.6 μl citraat aan 20 μl vezels) om de pH tot 3.0 te verlagen. De oplossing werd 5 minuten geïncubeerd vóór de toevoeging van Tris (3.6 μl 1 M voorraad) om de pH weer op 8.0 te brengen; 1 μl geassembleerde DpHF18-Cy5-vezels bij 30 μM werd aan de oplossing toegevoegd. De oplossing werd vervolgens bij kamertemperatuur geïncubeerd vóór centrifugatie bij 13,000°C g gedurende 2 minuten in een tafelcentrifuge. Vezels werden opnieuw gesuspendeerd in TBS en afgebeeld met TIRFM.
Demontage van vezels
Snelle TIRFM-beeldvorming van vezels die bij lage pH demonteren, werd uitgevoerd op een op maat gebouwd TIRF-systeem gebaseerd op een Nikon Ti-standaard uitgerust met een perfect focussysteem naast een snel Z piëzo-trap (ASI), een azimutale TIRF-verlichting (iLas2, Roper France) met een aangepast vergroot gezichtsveld (Cairn) en een PLAN Apo 1.45 NA ×100 objectief. Beelden werden verkregen met een Photometrics Prime 95B-sCMOS-camera met achtergrondverlichting, uitgevoerd in pseudo-globale sluitermodus, gesynchroniseerd met de azimutale verlichting. Het systeem werd beheerd door Metamorph 7.10.1.161. Sulfo-Cy5-maleïmide-gelabelde vezels werden afgebeeld met een 630 nm laser (150 mW Coherent OBIS gemonteerd in een Cairn-laserlancering) en afgebeeld met behulp van een Chroma ET655lp-filter gemonteerd in een Cairn Optospin-wiel met een framesnelheid van 1 frame per 16 ms.
Vezels werden afgebeeld in beeldvormingsbuffer (25 mM Tris pH 8.0, 100 mM NaCl) in een Ibidi-stroomcel gemonteerd op dekglaasjes van cleanroomkwaliteit (aangepast, 25 x 75 mm2Nexterion), en gepassiveerd met PLL-PEG (0.1 mg ml-1 in 20 mM Hepes, pH 7.6; 5 minuten). Men liet de vezels gedurende 5 minuten op het dekglaasje afzetten voordat ongebonden vezels werden verwijderd met de beeldbuffer. Tijdens snelle acquisitie werd de pH verlaagd door er buffer met lage pH in te laten stromen (25 mM Tris, 100 mM NaCl, pH 3.0).
Om de demontage van de vezels in bulkoplossingen te meten, werden voorgevormde vezels in Eppendorf-buisjes van 1.5 ml uitgewisseld in citraatbuffers bij een lagere pH om de demontage te stimuleren. Een deel van elke pH-reactie werd op verschillende tijdstippen verwijderd en gedurende 96 minuten aan een plaat met 10 putjes toegevoegd om de vezels te laten bezinken en aan het glassubstraat te hechten. Voor elke toestand en elk tijdstip werden negen gezichtsvelden verkregen op een IN Cell Analyzer 2500HS-microscoop (Molecular Devices) met behulp van een Nikon ×60 PLAN Apo 0.95 NA luchtobjectief en een 631 nm LED-excitatiebron, 150 ms belichtingstijd met verzamelde emissie door een banddoorlaatfilter van 684 ± 24 nm. Afbeeldingen werden gekwantificeerd met behulp van een aangepast CellProfiler-script om vezels te segmenteren met het Otsu-drempelalgoritme25. De boven- en ondergrenzen van de drempelwaarde, evenals het adaptieve venster voor object-ID, werden aangepast totdat de vezels correct werden geïdentificeerd ten opzichte van het achtergrondsignaal. De hoofdaslengte van objecten geïdentificeerd met behulp van de CellProfiler-pijplijn werd voor elke pH-omstandigheid uitgezet tegen de incubatietijd.
Vloeistoffase AFM
Monster voorbereiding
We incubeerden 10 µl van een 0.01 gew.% polylysine-oplossing op een vers gekliefd muscoviet-mica-oppervlak (12 mm, Ted Pella Inc.) gedurende 2 minuten. De overtollige oplossing werd verwijderd en het oppervlak werd gespoeld met water en gedroogd met N2 gas7. Vervolgens werd 30 µl 10 µM eiwitoplossing in de beeldbuffer (25 mM Tris-HCl, 400 mM NaCl bij pH 8) gedurende 30 minuten op het met polylysine beklede mica geïncubeerd en gewassen met de beeldbuffer om overtollig eiwit te verwijderen. De pH van de demontagebuffer (25 mM Tris-HCl, 400 mM NaCl, pH 4.1, 4.4, 4, 5 of 4.7) werd vóór gebruik aangepast met 10 M NaOH of 1 M citroenzuur en gefilterd met een PVDF-filter met een poriegrootte van 0.1 µm. . Voor fotozuurexperimenten werd 10 µM eiwitoplossing in 25 mM Tris-HCl pH 8 gedurende 30 minuten op kale mica geïncubeerd en gewassen met 25 mM Tris-HCl pH 5.5; een extra afzettings- en spoelstap werd uitgevoerd als de aantaldichtheid van vezels op het oppervlak laag was. We hebben ook 1 mM 2-nitrobenzaldehyde (Sigma-Aldrich) vers bereid in 25 mM Tris-HCl pH 5.5 en onmiddellijk gebruikt zonder blootstelling aan licht in welk stadium dan ook26. Spectroscopische en pH-metingen gaven aan dat 2-nitrobenzaldehyde activeerbaar is tussen golflengten van 200 en 405 nm en de pH verlaagt van 5.5 naar 2.7, en dat een hogere laserintensiteit leidt tot sneller verbruik en verzuring.
Imaging
Voor het kinetische onderzoek bij constante samenstelling werden de met eiwit gecoate polylysine mica-substraten onder de AFM-vloeistofcel geplaatst (Bruker Multimode8). Beelden werden vastgelegd in de beeldbuffer met behulp van een schone siliciumnitride cantilever (Bruker, SNL-10, veerconstante: 0.12 N·m-1, UV-geozoniseerd gedurende 5 minuten) in tapmodus bij kamertemperatuur (25 °C). Voordat de demontagebuffer werd laten stromen, werden de vezels gedurende 10 minuten continu in beeld gebracht om de parameters te optimaliseren (256 scanlijnen, 1.5 Hz scansnelheid, hoge integrale versterking (3-4) en 50-100 mV vrije amplitude). Nadat was bevestigd dat er geen door cantilever veroorzaakte schade optrad, werd de demontagebuffer continu geïnjecteerd met een snelheid van 25 µl min.-1. De doorstroomopstelling werd geoptimaliseerd om een verwaarloosbare verblijftijd en snelle pH-omschakeling te garanderen10.
Voor het fotozuuronderzoek werd met eiwit gecoate mica met 25 mM Tris-HCl pH 5.5 onder de vloeistofcel van een Cypher VRS AFM (Asylum Research) geplaatst, uitgerust met BlueDrive-laser (×0.3 intensiteitsfilter, 405 nm golflengte) met de ontluchtingsklep geopend en bediend in tapmodus. Nadat de hoge oppervlaktebedekking van de vezels was bevestigd, werd de beeldvormingsbuffer vervangen door 1 mM 2-nitrobenzaldehyde in 25 mM Tris-HCl pH 5.5, bedreven zonder blootstelling aan zichtbaar achtergrondlicht en opnieuw afgebeeld. De cantilever werd vervolgens ingetrokken en BlueDrive werd ingeschakeld en herhaaldelijk over vooraf geselecteerde gebieden gerasterd met behulp van de gemotoriseerde optische microscoop van de AFM. De totale UV-blootstellingstijd tijdens raster/dwell voor vlek- en lijnpatronen was niet meer dan 10 minuten, waarna de cantilever terug naar de blootgestelde gebieden werd verplaatst en in beeld werd gebracht. Voor globale pH-veranderingen werd het kwartsvenster van de AFM-vloeistofcel in contact met de fotozuuroplossing gedurende 364 minuten blootgesteld aan een draagbare UV-lamp (7 nm golflengte) en vervolgens in beeld gebracht.
Afbeeldingen werden verwerkt met Gwyddion SPM v2.62 data-analysesoftware en geanalyseerd met Fiji-software v1.53s18. Voor de kinetiek werd de totale vezellengte gemeten en alle fragmenten die als reeds gedemonteerd werden beschouwd, werden uitgesloten van de lengtemeting. Om de demontagesnelheid aan elk uiteinde van individuele vezels te meten (aanvullende afb. 8), werd het midden van de vezel (de helft van de initiële lengte) toegewezen als het tweede uiteinde voor het meten van de lengte, terwijl voor vezelfragmenten het midden van het fragment werd gemeten als het tweede uiteinde.
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- Bron: https://www.nature.com/articles/s41565-024-01641-1



