De laatste wolharige mammoet zwierf 4,000 jaar geleden rond op de uitgestrekte arctische toendra. Hun genen leven nog steeds voort in een majestueus dier: de Aziatische olifant.
Met een gelijkenis van 99.6 procent in hun genetische samenstelling zijn Aziatische olifanten het perfecte startpunt voor een gedurfd plan om de mammoet – of iets wat daar dicht bij staat – voor uitsterven te behoeden. Het project, gelanceerd door een biotechnologiebedrijf Kolossaal in 2021 trok de wenkbrauwen op vanwege zijn moonshot-doelpunt.
Het algemene draaiboek klinkt eenvoudig.
De eerste stap is het sequencen en vergelijken van de genomen van mammoeten en olifanten. Vervolgens zullen wetenschappers de genen identificeren achter de fysieke eigenschappen – lang haar, vetophopingen – waardoor mammoeten konden gedijen bij temperaturen onder het vriespunt, en deze vervolgens met behulp van genbewerking in olifantencellen inbrengen. Ten slotte zal het team de kern – waarin DNA zit – van de bewerkte cellen overbrengen naar een olifantenei en het embryo in een surrogaat implanteren.
Het probleem? Aziatische olifanten worden bedreigd en hun cellen, vooral de eieren, zijn moeilijk te verkrijgen.
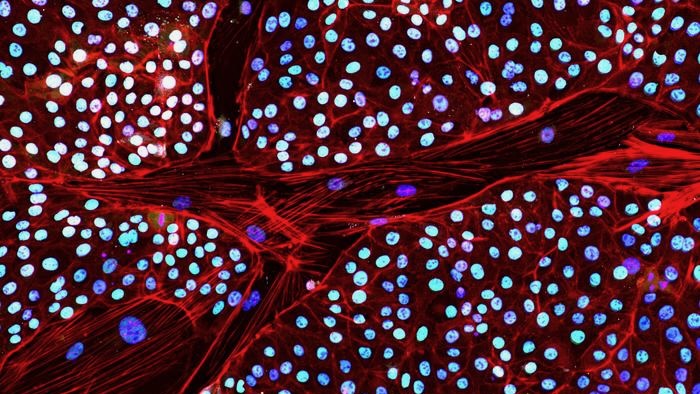
Vorige week, het bedrijf meldde een belangrijke oplossing. Voor het eerst transformeerden ze olifantenhuidcellen in stamcellen, die elk het potentieel hebben om elke cel of elk weefsel in het lichaam te worden.
De vooruitgang maakt het gemakkelijker om de resultaten van genbewerking in het laboratorium te valideren voordat een mogelijke zwangerschap wordt gepleegd, die bij olifanten tot 22 maanden kan duren. Wetenschappers zouden bijvoorbeeld de kunstmatige stamcellen van olifanten kunnen overhalen om haarcellen te worden en te testen op genbewerkingen die de mammoet zijn iconische dikke, warme vacht geven.
Deze geïnduceerde pluripotente stamcellen, of iPSC's, zijn bijzonder moeilijk te maken uit olifantencellen. De dieren “zijn een heel bijzondere soort en we zijn nog maar net begonnen met het verkennen van hun fundamentele biologie.” zei Dr. Eriona Hysolli, hoofd biowetenschappen bij Colossal, in a persbericht.
Omdat bij deze aanpak alleen een huidmonster van een Aziatische olifant nodig is, komt de bescherming van de bedreigde diersoort al een heel eind. De technologie zou ook het behoud van levende olifanten kunnen ondersteunen door fokprogramma's aan te bieden met kunstmatige eieren gemaakt van huidcellen.
“Olifanten krijgen misschien wel de prijs ‘moeilijkst te herprogrammeren’,” zei Dr. George Church, een geneticus van Harvard en medeoprichter van Colossal, “maar leren hoe je het toch moet doen, zal veel andere onderzoeken helpen, vooral naar bedreigde diersoorten.”
Zet de klok terug
Bijna twintig jaar geleden zorgde de Japanse bioloog Dr. Shinya Yamanaka voor een revolutie in de biologie door volwassen cellen te herstellen tot een stamcelachtige staat.
Voor de Nobelprijswinnende techniek, die voor het eerst werd gedemonstreerd bij muizen, zijn slechts vier eiwitten nodig, samen de Yamanaka-factoren genoemd. De geherprogrammeerde cellen, vaak afgeleid van huidcellen, kunnen zich onder verdere chemische begeleiding ontwikkelen tot een reeks weefsels.
Geïnduceerde pluripotente stamcellen (iPSC's), zoals ze worden genoemd, hebben de biologie getransformeerd. Ze zijn cruciaal voor het proces van het bouwen van hersenorganoïden – miniatuurbolletjes van neuronen die vonken van activiteit – en kunnen worden overgehaald tot eicellen of modellen van vroege menselijke embryo's.
De technologie is goed ingeburgerd voor muizen en mensen. Dat geldt niet voor olifanten. “In het verleden zijn een groot aantal pogingen om olifanten-iPSC’s te genereren niet vruchtbaar geweest”, zegt Hysolli.
De meeste olifantencellen stierven bij behandeling met het standaardrecept. Anderen veranderden in verouderde zombiecellen – levend maar niet in staat hun gebruikelijke biologische functies uit te voeren – of vertoonden weinig verandering ten opzichte van hun oorspronkelijke identiteit.
Verder speurwerk vond de boosdoener: een eiwit genaamd TP53. Het eiwit staat bekend om zijn vermogen om kanker te bestrijden en wordt vaak de genetische poortwachter genoemd. Wanneer het gen voor TP53 wordt ingeschakeld, spoort het eiwit pre-kankercellen aan zichzelf te vernietigen zonder hun buren schade toe te brengen.
Helaas belemmert TP53 ook de herprogrammering van iPSC. Sommige Yamanaka-factoren bootsen de eerste stadia van de kankergroei na, waardoor bewerkte cellen zichzelf kunnen vernietigen. Olifanten hebben maar liefst 29 kopieën van het ‘protector’-gen. Samen zouden ze gemakkelijk cellen met gemuteerd DNA kunnen vernietigen, inclusief de cellen waarvan de genen zijn bewerkt.
“We wisten dat p53 een groot probleem zou worden”, zei Church vertelde de New York Times.
Om de poortwachter te omzeilen, bedacht het team een chemische cocktail om de productie van TP53 te remmen. Met een daaropvolgende dosis herprogrammeringsfactoren konden ze de eerste iPSC's van olifanten uit huidcellen maken.
Een reeks tests toonde aan dat de getransformeerde cellen er uitzagen en zich gedroegen zoals verwacht. Ze hadden genen en eiwitmarkers die vaak in stamcellen voorkomen. Toen ze zich verder konden ontwikkelen tot een cluster van cellen, vormden ze een drielaagse structuur die cruciaal was voor de vroege embryo-ontwikkeling.
'We hebben echt wanhopig op deze dingen gewacht,' Church vertelde NATUUR. Het team publiceerde hun resultaten, die nog niet door vakgenoten zijn beoordeeld, op de preprint-server bioRxiv.
Lange weg vooruit
Het huidige draaiboek van het bedrijf voor het terugbrengen van de mammoet is gebaseerd op kloontechnologieën, niet op iPSC's.
Maar de cellen zijn waardevol als proxy's voor eicellen van olifanten of zelfs embryo's, waardoor de wetenschappers hun werk kunnen voortzetten zonder bedreigde dieren te schaden.
Ze kunnen de nieuwe stamcellen bijvoorbeeld omzetten in eicellen of spermacellen – een prestatie tot nu toe alleen bereikt bij muizen—voor verdere genetische bewerking. Een ander idee is om ze direct te transformeren in embryo-achtige structuren uitgerust met mammoetgenen.
Het bedrijf onderzoekt ook de ontwikkeling ervan kunstmatige baarmoeders om bewerkte embryo’s te helpen verzorgen en mogelijk tot voldragen te brengen. In 2017 bracht een kunstbaarmoeder een gezond lam ter wereld, en dat gebeurt nu ook op weg naar menselijke beproevingen. Deze systemen zouden de behoefte aan olifantensurrogaten verminderen en voorkomen dat hun natuurlijke voortplantingscycli in gevaar komen.
Omdat het onderzoek een preprint is, zijn de resultaten nog niet door andere experts in het veld gecontroleerd. Er blijven veel vragen over. Behouden de geherprogrammeerde cellen bijvoorbeeld hun stamcelstatus? Kunnen ze op verzoek worden omgezet in meerdere weefseltypen?
Het tot leven wekken van de mammoet is het uiteindelijke doel van Colossal. Maar Dr. Vincent Lynch van de Universiteit van Buffalo, die al lang probeert iPSC’s van olifanten te maken, denkt dat de resultaten een breder bereik.
Olifanten zijn opmerkelijk resistent tegen kanker. Niemand weet waarom. Omdat de iPSC's van de studie ontdaan zijn van TP53, een kankerbeschermend gen, zouden ze wetenschappers kunnen helpen de genetische code te identificeren waarmee olifanten tumoren kunnen bestrijden en mogelijk ook voor ons nieuwe behandelingen kunnen inspireren.
Vervolgens hoopt het team de eigenschappen van mammoeten – zoals lang haar en vetophopingen – na te bootsen in cel- en diermodellen gemaakt van genetisch gemodificeerde olifantencellen. Als alles goed gaat, zullen ze een techniek gebruiken zoals die waarmee Dolly het schaap werd gekloond om de eerste kalveren te krijgen.
Of deze dieren mammoeten kunnen worden genoemd, staat nog ter discussie. Hun genoom zal niet precies overeenkomen met de uitgestorven soort. Verder zijn de biologie en het gedrag van dieren sterk afhankelijk van interacties met de omgeving. Ons klimaat is dramatisch veranderd sinds de mammoeten 4,000 jaar geleden uitstierven. De Arctische toendra – hun oude thuis – smelt snel. Kunnen de herrezen dieren zich aanpassen aan een omgeving waarvoor ze niet geschikt waren?
Dieren leren ook van elkaar. Zonder een levende mammoet die een kalf laat zien hoe het een mammoet moet zijn in zijn natuurlijke habitat, kan het een heel ander gedrag vertonen.
Colossal heeft een algemeen plan om deze moeilijke vragen aan te pakken. In de tussentijd zullen de werkzaamheden ervoor zorgen dat het project vooruitgang boekt zonder olifanten in gevaar te brengen. volgens Kerk.
‘Dit is een belangrijke stap’ zei Ben Lamm, medeoprichter en CEO van Colossal. “Elke stap brengt ons dichter bij onze langetermijndoelstellingen: het terugbrengen van deze iconische soort.”
Krediet van het beeld: Kolossale Biowetenschappen
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- Bron: https://singularityhub.com/2024/03/12/colossal-creates-elephant-stem-cells-for-the-first-time-in-quest-to-revive-the-woolly-mammoth/



