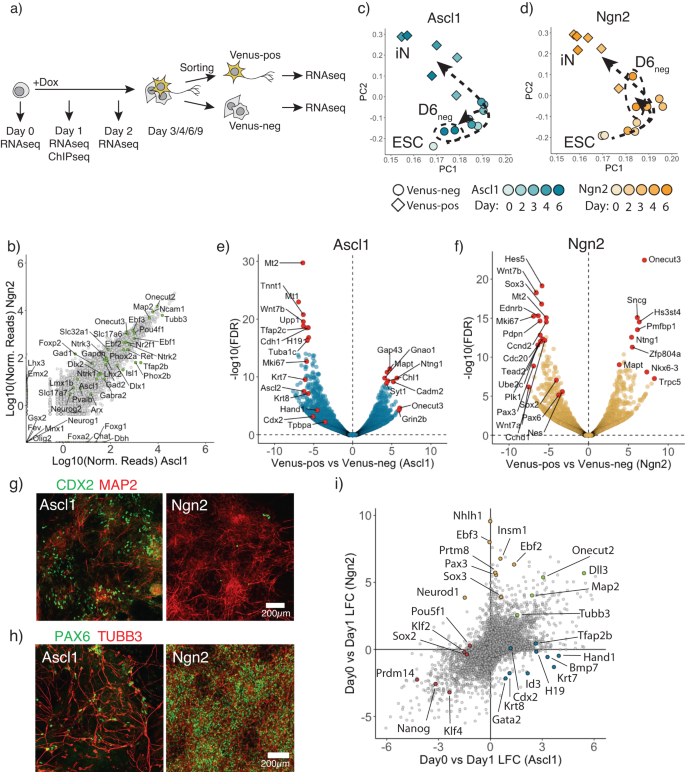
Ascl1 en Ngn2 converteren ESC naar iN maar genereren verschillende nevenlijnen
Ectopische expressie van Ascl1 of Ngn2 in embryonale stamcellen van muizen (ESC's) is voldoende om terminale differentiatie in neuronen te induceren28. Toch zijn de verschillen in het transitiemechanisme naar neuronen en mogelijke zijpopulaties niet goed gekarakteriseerd6,31. Om deze celtypeconversie in detail te onderzoeken, hebben we klonale ESC-cellijnen gegenereerd die rtTA en TetO-Ascl1 of TetO-Ngn2 tot expressie brengen27,28 (Aanvullende afb. 1a). Na toevoeging van doxycycline (Dox) worden ESC's snel omgezet in geïnduceerde neuronen: Ascl1 en Ngn2 produceren cellen die de neuronale marker TUBB3 tot expressie brengen en neuronale morfologie vertonen vanaf respectievelijk dag 3 en dag 2 (aanvullende figuur XNUMX). 1a). Om het neuronale lot in deze cellijnen te rapporteren, hebben we het pan-neuronale markergen Mapt op zijn C-terminus endogeen gelabeld met het fluorescerende eiwit Venus27 (Aanvullende afb. 1b) en voerde tijdsopgeloste bulk-RNAseq uit na Dox-inductie. Cellen werden gesorteerd in Venus-positieve neuronen en Venus-negatieve celpopulaties (Fig. 1a) vanaf dag 3. Zoals eerder gemeld28,30, geven zowel Ascl1 als Ngn2 aanleiding tot vergelijkbare iN-celidentiteiten (Fig. 1b; Aanvullende afb. 1c-e). De initiële ESC- en terminale iN-toestanden zijn dus zeer vergelijkbaar tussen door Ascl1 en Ngn2 geïnduceerde conversies (aanvullende figuur XNUMX). 1b onderkant). Dit komt overeen met eerdere waarnemingen dat transcriptomen convergeren om iN-vorming aan te sturen, ondanks verschillen in de initiële transcriptionele respons6 en volg een algemeen vergelijkbaar traject tussen ESC en iN in de PCA-analyse (Fig. 1c, d; Aanvullende afb. 1g).
a Schematisch overzicht van het experimentele ontwerp. b Scatterplot waarin genexpressie op dag 6 wordt vergeleken tussen Ascl1 en Ngn2 Venus-positieve cellen met verschillende neuronale subtype-specifieke markers aangegeven in groen. c, d Hoofdcomponentenanalyse van tijdsopgeloste bulk-RNAseq na Ascl1 (c) of Ngn2 (d). Elk gegevenspunt komt overeen met de replicatie van het enkele tijdpunt. De kleurintensiteit toont de dag na inductie. Vorm komt overeen met de upregulering van de Mapt-Venus-reporter. Pijlen tonen het traject dat cellen afleggen na de Ascl1 (c) of Ngn2-inductie (d). e, f Vulcano-plot waarin genexpressie wordt vergeleken tussen Venus-positieve en negatieve populaties op dag 6 na inductie van Ascl1 (e) of Ngn2 (f). Rode cirkels geven de belangrijkste significant opgereguleerde of gedownreguleerde genen aan, evenals voorbeeldgenen die markeren in trofoblast (e) of NSC-lijnen (f). g Representatieve immunogekleurde cellen voor een trofoblastmarker CDX2 en een neuronale marker Map2 op dag 6 na inductie van Ascl1 of Ngn2. Trofoblastmarkers werden alleen tot expressie gebracht na Ascl1-inductie, maar niet Ngn2. h Representatieve immuungekleurde cellen voor een NSC-marker PAX6 en een neuronale marker TUBB3 op dag 6 na inductie van Ascl1 of Ngn2. NSC-markers werden alleen tot expressie gebracht na Ngn2-expressie, maar niet Ascl1. i Scatterplot waarin genexpressieveranderingen tussen Ascl1 en Ngn2 op dag 1 na inductie worden vergeleken. Gemarkeerde cirkels zijn voorbeeldgenen die neuronale markers zijn die tot expressie worden gebracht in zowel (groen), trofoblast Ascl1-specifieke markers (blauw), NSC Ngn2-specifieke markers (geel), pluripotentie-gerelateerde genen (rood). Brongegevens worden geleverd als een brongegevensbestand.
Om cellen die iN niet in meer detail maken te onderzoeken, hebben we ons geconcentreerd op de Mapt-Venus-negatieve cellen, die onvolledige of alternatieve differentiatieresultaten zouden kunnen vertegenwoordigen. Mapt-Venus-negatieve cellen gegenereerd door Ascl1 clusteren dichter bij de initiële ESC-populaties in PCA-plots dan door Ngn2 geïnduceerde Mapt-negatieve cellen (Fig. 1c). Dit is echter niet te wijten aan het behouden van een populatie van ongedifferentieerde ESC, aangezien slechts een marginaal aantal cellen ESC-marker NANOG tot expressie brengt in de terminale populatie (aanvullende figuur XNUMX). 1g), en NANOG en OCT4 worden niet uitgedrukt in de Mapt-Venus-populatie (aanvullende figuur XNUMX). 1h). Om het alternatieve type cellen gegenereerd door Ascl1 te identificeren, hebben we PanglaoDB gebruikt32 met behulp van genen die op dag 6 verschillend tot expressie worden gebracht tussen Venus-negatieve en positieve populaties (Fig. 1e, f; Aanvullende afb. 2a). Interessant genoeg produceert Ascl1 cellen die trofoblastmarkers tot expressie brengen, zoals hand1, Cdx2, Tpbpa, Krt8 (Fig. 1e, g; Aanvullende afb. 2b – g) met mesenchymale morfologie, die niet aanwezig was in door Ngn2 geïnduceerde culturen (Fig. 1gAanvullende Fig. 2b,c,f). We noemden deze cellen geïnduceerde trofoblastachtige cellen (iT). Interessant is dat veel van de Krt8, Cdx2 positieve iTs leken tweekernig, wat een resultaat zou kunnen zijn van multinucleatie vergelijkbaar met de ontwikkeling van de trofoblastlijn in vivo (aanvullende figuur XNUMX). 2e)33. De inductie van iT zou te wijten kunnen zijn aan het feit dat Ascl1 de bHLH-transcriptiefactor Ascl2 nabootst, een drijvende kracht achter de trofoblastlijn. Zowel Ascl1 als Ascl2 zijn evolutionair dichtbij en delen vrijwel identieke DNA-bindende domeinen en binden vergelijkbare E-box-motieven (aanvullende figuur XNUMX). 2u – k)33,34,35,36,37. Ten slotte herhaalden we, om klonale effecten van de gebruikte cellijn uit te sluiten, deze experimenten op de achtergrond van een alternatieve ESC-muislijn, E14. We introduceerden rtTA via een piggybac-transposonvector en brachten Ascl1 tot expressie vanuit een Dox-induceerbare virale vector27 en genereerde 24 van een enkele cel afgeleide klonen. Alle klonen vertoonden de vorming van zowel iN als iT, wat suggereert dat de vorming van iTs een reproduceerbaar bijproduct is van ectopische Ascl1-expressie in ESC's van muizen (aanvullende figuur XNUMX). 3).
In tegenstelling tot Ascl1-inductie induceert Ngn2 Mapt-negatieve cellen die NSC-markers tot expressie brengen, zoals Sox2, Pax 3, Pax 6, Nes (Fig. 1f, h; Aanvullende afb. 2a, 4a, b), zoals eerder beschreven21,38. Bovendien zou de herprogrammering van Ngn2 kunnen worden vergrendeld in de NSC-achtige toestand (iNSC) in de aanwezigheid van FGF2 en EGF en is afhankelijk van de Notch-route39,40 (Aanvullende afb. 4c, d). Daarentegen hebben we geen NSC-markers waargenomen die tijdens Ascl1-geïnduceerde differentiatie werden opgereguleerd (Fig. 1hAanvullende Fig. 4b, c). Om te zien of Ngn2 de iNSC-status als proliferatief tussenproduct kan gebruiken, hebben we vanaf dag 4 na inductie cellen gedifferentieerd in de aanwezigheid of afwezigheid van cytosine β-D-arabinofuranoside (AraC) om delende cellen te inactiveren (aanvullende figuur XNUMX). 4e). De toevoeging van AraC vermindert inderdaad de door Ngn2 geproduceerde iN's drastisch, terwijl Ascl1 ongevoelig was voor AraC-behandeling, wat suggereert dat er geen continu proliferatief tussenproduct aanwezig is tijdens door Ascl1 geïnduceerde iN-herprogrammering (aanvullende figuur XNUMX). 4e). Samenvattend produceren Ascl1 en Ngn2, ondanks dat Ascl1 en Ngn2 mESC naar vergelijkbare iN-subtypen converteren, verschillende aanvullende alternatieve cellijnen, wat suggereert dat ondanks identieke initiële en terminale populaties er verschillen bestaan die we verder probeerden te begrijpen (aanvullende figuur XNUMX). 1b onderkant).
Ascl1 en Ngn2 initiëren paden met verschillende transcriptieprogramma's
Om een beter begrip te krijgen van de verschillende transcriptionele reacties opgeroepen door Ascl1 en Ngn2, voerden we op dag 1 bulk-RNAseq en ChiPseq uit (Fig. 1a). Zowel Ascl1 als Ngn2 induceren algemene neuronale markers zoals Tubb3, Map2 en Eén snede 2 en het downreguleren van algemene pluripotentiemarkeringen zoals Nanog, Klf4 (Fig. 1i). Bovendien induceert Ascl1 sterk stroomafwaartse doelen Tfap2b, Lmx1b, terwijl Ngn2 sterk opreguleert Neurod1, Nhlh1 (Fig. 1i). Bovendien reguleert Ascl1 Trofoblast-afstammingsmarkers, bijv. Krt7/8, hand1, terwijl Ngn2 de expressie van NSC-gerelateerde genen opreguleert, zoals Pax 3 en Sox3 (Fig. 1i). Interessant genoeg hebben we waargenomen dat cellen in het begin van het herprogrammeren positief zijn voor zowel neuronale als trofoblastmarkers (aanvullende figuur XNUMX). 5a, b). Daarnaast hebben we de beschikbare scRNAseq-gegevens opnieuw geanalyseerd6 voor Dag 2 van ESC naar iN-conversie door Ascl1 en Ngn2 en kon ook cellen waarnemen die positief waren voor zowel neuronale als trofoblastmarkers (aanvullende figuur XNUMX). 5c, d). Dit suggereert dat Ascl1 beide lijnen tegelijkertijd kan induceren, die later worden opgelost in iN- of iT-cellen (aanvullende figuur XNUMX). 5b).
Zoals gerapporteerd door Aydin en collega's6Ascl1 en Ngn2 vertonen verschillende voorkeuren voor E-box-motieven, die op hun beurt resulteren in de activering van verschillende subsets van genen. We hebben inderdaad de differentiële binding van Ascl1 en Ngn2 in ESC bevestigd (aanvullende figuur XNUMX). 6a). Verder zien we dat Ascl1- en Ngn2-doelgenen op verschillende manieren tot expressie komen, evenals genen die betrokken zijn bij de verschillende alternatieve lijnen, bijvoorbeeld hand1, Cdx2, Krt8 or Neurod1, Pax 3respectievelijk (aanvullende afb. 6b). Interessant is dat Ascl1 trofoblast-gerelateerde genen ook in MEF bindt, hoewel zonder iT-inductie (aanvullende figuur XNUMX). 7a, b). Naast iN-inductie leidt Ascl1-overexpressie in MEF echter tot Ascl1-binding aan de skeletspiergenen en de inductie van myocyten7,16. In ESC bindt Ascl1 inderdaad ook sterk aan genen die verband houden met de skeletspierlijn, bijvoorbeeld Myod1, Myog, Mijnf3, Tnnt2 (Aanvullende afb. 7c). We hebben echter geen opregulatie van deze genen waargenomen (aanvullende figuur XNUMX). 7d). Het is dus verleidelijk om te speculeren dat de cellulaire context, zoals celtype-specifieke histon-modificaties of transcriptiefactoren, de keuze van de geïnduceerde alternatieve afstammingslijn beïnvloedt. Naast de inductie van het neuronale transcriptieprogramma worden dus extra genen gebonden en getranscribeerd, wat leidt tot de vorming van alternatieve afstammingslijnen. Dit “off target” transcriptieprogramma is afhankelijk van overexpressie van transgenen, bijvoorbeeld Ascl1 of Ngn2, evenals van de cellulaire context, bijvoorbeeld ESC of MEF.
Om de algemene principes van de vroege transcriptionele respons dieper te onderzoeken, hebben we de STRING-database gebruikt om het genregulerende netwerk (GRN) van door Ascl1 en Ngn2 opgereguleerde differentieel tot expressie gebrachte genen (DEG's) één dag na inductie te onderzoeken (aanvullende figuur XNUMX). 8a, b). Zowel Ascl1 als Ngn2 DEGs vormen netwerken die drie verschillende gengroepen bevatten. Interessant is dat Ascl1 en Ngn2 GRN's groepen delen die genen bevatten die betrokken zijn bij het RNA- en sterolmetabolisme, wat kan worden toegeschreven aan de metabolische verschuiving tijdens conversie41,42. Bovendien vormt Ngn2 een meer onderling verbonden netwerk dan Ascl1, wat suggereert dat Ngn2 een meer coherente transcriptionele respons oproept dan Ascl1 (aanvullende figuur XNUMX). 8c).
Om de verschillen gedetailleerder te analyseren, hebben we gekeken naar de centraal meest verbonden knooppunten van beide GRN's (aanvullende figuur XNUMX). 8d, e). In tegenstelling tot Ascl1 induceert Ngn2 genen die neuronale differentiatie aansturen Neurog2, Neurod1, Neurog1, Lhx2/3, Otx2, evenals genen die betrokken zijn bij neurale stamceldifferentiatie: Notch1, Hij is 5, Pax 3, waarbij GRN eromheen wordt gecentreerd (aanvullende figuur XNUMX). 8e-g). Interessant is dat bekend is dat Ngn2, Neurod1 en Ngn2 ESC naar iN kunnen omzetten43. Zo'n positieve feedbacklus, samen met de inductie van sterke lineage-drivers en sterk onderling verbonden GRN, kan dus een robuustere iN-conversie en snellere onafhankelijkheid van de initiële inductie van de cassette mogelijk maken. Om deze hypothese te testen, hebben we cellen gedurende 2, 4 of 6 dagen geïnduceerd (aanvullende figuur XNUMX). 8h). We zien inderdaad dat efficiënte iN-conversie met Ascl1 afhankelijk is van de aanhoudende expressie van Ascl1, terwijl Ngn2 al na 2 dagen inductie efficiënt conversie induceert (aanvullende figuur XNUMX). 8h).
Samenvattend binden Ascl1 en Ngn2 verschillende transcriptionele profielen en daaropvolgende mechanistische verschillen van de ESC naar iN-conversie. Waar Ascl1-inductie afhankelijk is van de aanhoudende expressie van Ascl1, induceert Ngn2 een algeheel coherenter netwerk dat efficiënte en snelle herprogrammering mogelijk maakt, evenals inductie van een proliferatief tussenproduct.
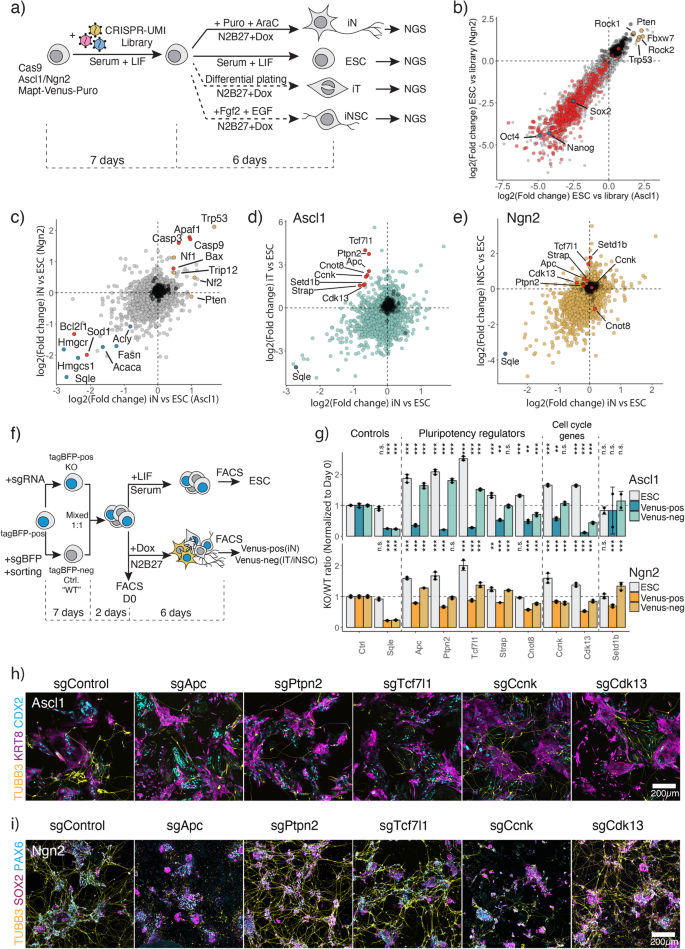
CRISPR/Cas9-scherm met functieverlies om genetische afhankelijkheden voor ESC naar iN-conversie te identificeren
Om een mechanistisch inzicht te krijgen in de onderliggende verschillen tussen Ascl1- en Ngn2-geïnduceerde ESC-herprogrammering, hebben we een CRISPR/Cas9-verlies-van-functie-scherm uitgevoerd. We wilden twee aspecten van deze conversie onderzoeken: ten eerste de genetische afhankelijkheden van door Ascl1 en Ngn2 geïnduceerde neuronale conversie, en ten tweede om de genen op te helderen die betrokken zijn bij de vorming van alternatieve toestanden (Fig. 2a). Hiervoor werd ESC geïnfecteerd met een retrovirale CRISPR-UMI sgRNA-bibliotheek met ~27,000 gidsen gericht op 6630 genen (4 gidsen per gen) en 108 niet-gerichte gidsen44. Vervolgens hebben we ESC gedurende 6 dagen gedifferentieerd en verrijkt voor iN met behulp van AraC en puromycinebehandeling (Fig. 2aAanvullende Fig. 1b, 9a). Daarnaast hebben we de afhankelijkheden voor iT- en iNSC-differentiatie beoordeeld (Fig. 2a, zie “Methoden”). Voor een eerste beoordeling van de screeningresultaten hebben we de uitputting van bekende essentiële zaken in ESC vergeleken met de bibliotheek (Fig. 2b). We hebben inderdaad een sterke uitputting waargenomen van gemeenschappelijke essentiële genen, zoals gedefinieerd door Hart et al.45. Bovendien zijn genen in het kernpluripotentienetwerk (Nanog, Sox2, Pou5f1) behoren tot de meest essentiële genen, terwijl tumoronderdrukkers dat ook zijn Trp53, Fbxw7, Rock1 zijn sterk verrijkend in ESC (Fig. 2b), wat aantoont dat onze bibliotheek effectief is in het targeten van genen en het onthullen van gen-knock-out fenotypes.
a Experimenteel overzicht van CRISPR-Cas9-scherm. b Vergelijkende analyse van de gen-knock-outeffecten tussen Ascl1- en Ngn2-transgenen die ESC dragen. Het verschil in gids-abundantie werd berekend tussen niet-geïnduceerde ESC op dag 13 na bibliotheekinfectie (a) versus bibliotheekplasmidepool. Stippen vertegenwoordigen genen; as toont de uitputting van LFC in elke cellijn. Rood vertegenwoordigt essentiële kerngenen zoals gedefinieerd door Hart et al.45, blauwe kernpluripotentiegenen, gele tumoronderdrukkers. c Vergelijkende analyse van gen-knock-outeffecten van Ascl1 of Ngn2-geïnduceerde iN versus ESC. Rode stippen vertegenwoordigen apoptose-gerelateerde genen, gele tumorsuppressorgenen en blauwe cholesterolbiosynthesegenen. d Vergelijkende analyse van gen-knock-out-effecten van Ascl1-geïnduceerde iN of iT versus ESC. Rode stippen vertegenwoordigen genen die zijn gekozen voor validatie. Sqle is een positieve controle voor een sterke uitputting. e Vergelijkende analyse van gen-knock-outeffecten van Ngn2-geïnduceerde iN of iNSC versus ESC. Rode stippen vertegenwoordigen genen die zijn gekozen voor validatie in (d). Sqle is een positieve controle voor een sterke uitputting. f Experimenteel overzicht van treffervalidatie van (d). g FACS-gebaseerde validatie van de hits. Bar vertegenwoordigt de genormaliseerde verhouding tot de initiële mengverhouding op dag 0. N = 3 onafhankelijke biologische replicaten. Staafdiagram toont gemiddelde ± SD. p-waarden, hierboven aangegeven, werden bepaald door eenweg-ANOVA gevolgd door de meervoudige vergelijkingstest van Dunnett (tweezijdig) met gebruikmaking van de Ctrl-ratio als controle. “ns” niet significant, “*” p < 0.05, “**” p < 0.01, “***” p <0.001. h, i Immunokleuring van de knock-outcellen voor neuronale marker Tubb3 en alternatieve afstammingsmarkers KRT8/CDX2 voor door Ascl1 geïnduceerde iT (h), en SOX2/PAX6 voor door Ngn2 geïnduceerde iNSC (i). Brongegevens worden geleverd als een brongegevensbestand.
Om gemeenschappelijke genetische afhankelijkheden van iN-vorming te identificeren, vergeleken we de overvloed aan gidsen in de ESC versus iN op D6 (Fig. 2c). Gidsen die de sterkste uitputting laten zien, richten zich bijvoorbeeld op het vetzuurmetabolisme en de biosynthese van sterolen, zoals Fasn, Hmgcr, Hmgcs1, Vierkant, een essentieel onderdeel voor het neuronale metabolisme (Fig. 2c)41,42. Bovendien ondergaan cellen tijdens iN-differentiatie hoge niveaus van stress als gevolg van lipidenperoxidatie en kunnen ze celdood plegen via apoptose of ferroptose.46,47. Daarom vinden we proapoptotische genen, Casp3/9 en Bax verrijkend, terwijl antiapoptotische genen zoals Bcl2l1 en Zode1 de bevolking afneemt (fig. 2c; Aanvullende afb. 9b). Bovendien kan knock-out van tumoronderdrukkers, bijv. Trp53, Nf1, Nf2, zorgt voor een hogere iN-conversie. Dit scherm levert dus genetische afhankelijkheden op in ESC naar iN-conversie met hoge resolutie.
Om differentiële genetische afhankelijkheden tussen iN en alternatieve staten bloot te leggen, werd de relatieve overvloed aan sgRNA gecorreleerd met een bijzondere focus op genen die uitgeput waren in iN en verrijkt waren in de alternatieve staten. We concentreerden ons op verschillende afhankelijkheden tussen de door Ascl1 geïnduceerde iN en iT (Fig. 2d). We hebben genen gekozen voor validatie op basis van de volgende criteria: (1) genen die weinig effecten vertonen in ESC (−2 <LFC <2); (2) genen die verrijking in iT vertonen (LFC> 1.5); (3) genen uitgeput in iN (LFC < −0.5). We hebben gemerkt dat genen belangrijk zijn bij de regulering van het pluripotentienetwerk en de differentiatie van ESC: Tcf7l1, Ptpn2, Apc, Riem, Knot848,49,50,51,52,53,54, evenals celcyclusgenen Ccnk en Cdk1355,56 zijn vereist voor door Ascl1 geïnduceerde iN-conversie terwijl de iT-vorming wordt geremd. Daarentegen had de knock-out van deze treffers weinig tot geen invloed op de door Ngn2 aangestuurde conversie naar neuronen (Fig. 2d, e).
Om de bevindingen te valideren, hebben we een competitietest uitgevoerd. Om een interne controle te implementeren, hebben we een constitutieve tagBFP-vector in onze cellijn geïntroduceerd en een kloon afgeleid met een stabiele tagBFP-expressie. De cellen werden vervolgens geïnfecteerd met het sgRNA dat de sterkste uitputting op het scherm vertoonde. Afzonderlijk hebben we een isogene controlepopulatie gegenereerd door tagBFP te targeten met een controlegids tegen tagBFP en te sorteren op tagBFPneg cellen. Vervolgens werden knock-out- en controlecellen gemengd in een verhouding van 1:1 en gedurende een extra passage gehandhaafd om ze aan dezelfde omstandigheden aan te passen, voordat de cellen werden uitgeplaat voor inductie (Fig. 2f). Na 6 dagen inductie beoordeelden we de iN Mapt-Venus-positieve populatie, evenals de Venus-negatieve populatie, overeenkomend met de vorming van iT/iNSC-populaties (Fig. 2f, gr). Daarnaast hebben we de geschiktheid van de knock-outs in de ESC-cellen beoordeeld terwijl we ESC nog eens 6 dagen lieten groeien (Fig. 2f). Als verwacht, Vierkant was essentieel in iN-, iT- of iNSC-populaties, maar niet in ESC-cellen, wat de schermresultaten weerspiegelt (Fig. 2c – e, g). Op dezelfde manier wordt de pluripotentie-gerelateerde genen uitgeschakeld Apc, Tcf7l1 en Ptpn2 schafte de vorming van iNs af na inductie met Ascl1, terwijl de vorming van iT-cellen mogelijk werd gemaakt (Fig. 2g). We bevestigden het fenotype verder via immunokleuring op dag 6 na inductie (Fig. 2 uur, ik). Het uitschakelen van de treffers resulteerde in het onvermogen om TUBB3-positieve neuronen te genereren door Ascl1, terwijl er nog steeds CDX2+- en KRT8+-cellen werden gegenereerd. Interessant is dat sommige cellen die neuronspecifieke TUBB3 tot expressie brengen een neuronale morfologie missen, wat duidt op activering van neuronale genen, maar het onvermogen om een definitieve iN-toestand te vestigen (aanvullende figuur XNUMX). 9c). Hetzelfde geldt voor het richten op Ccnk or Cdk13 verminderde het aantal iN's na Ascl1-inductie sterk. In tegenstelling tot Ascl1 wordt de Ngn2 iN-conversie niet aangetast bij verlies van Tcf7l1, Ptpn2 en Cdk13 en Ngn2 kan nog steeds zowel neuronen als neurale stamcellen genereren, gemarkeerd door SOX2 en PAX6 (Fig. 2g–ik). Echter, Apc en Ccnk knock-outs hadden wel invloed op de vorming van iN en iNSC geïnduceerd door Ngn2. Uiteraard hebben we bovendien meerdere andere genen gevalideerd die verschillende afhankelijkheden vertonen tussen Ascl1- en Ngn2-inductie (aanvullende Afb. 9d – h). Alles bij elkaar onthulden onze parallelle CRISPR/Cas9-verlies-van-functie-schermen meerdere gemeenschappelijke en differentiële afhankelijkheden tussen Ascl1- en Ngn2-geïnduceerde gerichte differentiatie naar iNs.
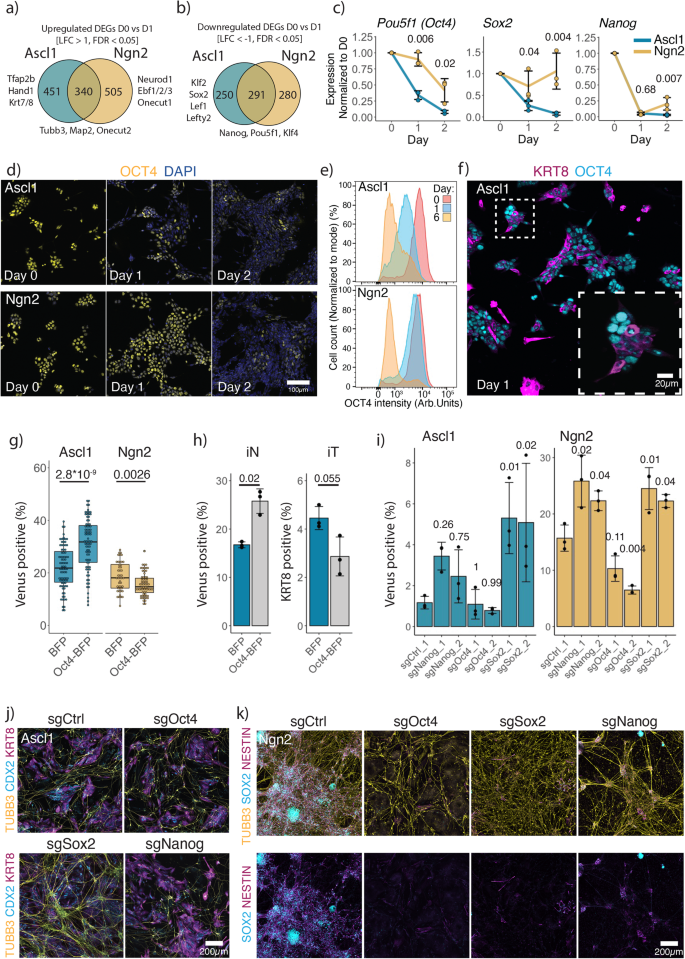
Snelle downregulatie van het pluripotentienetwerk na Ascl1-inductie
Omdat het scherm genen identificeerde die betrokken zijn bij het in stand houden van het pluripotentienetwerk als essentieel voor de Ascl1-geïnduceerde iN-vorming, onderzochten we hoe Ascl1 en Ngn2 het pluripotentienetwerk dieper uit elkaar halen. Hiervoor hebben we vindingrijkheidsrouteanalyse gebruikt met behulp van alle differentieel tot expressie gebrachte genen één dag na Ascl1- of Ngn2-inductie (aanvullende figuur XNUMX). 10a-d, Fig. 1i). Net als voorheen toonde vindingrijke canonieke routeverrijkingsanalyse aan dat zowel Ascl1 als Ngn2 routes induceren die verband houden met de biosynthese van cholesterol (aanvullende figuur XNUMX). 10b, d). Interessant is dat de Ascl1-transcriptiereactie gecentreerd is rond de downregulatie van het ESC-pluripotentienetwerk en zelfvernieuwing (aanvullende figuur XNUMX). 10a, b).
Vervolgens hebben we DEG's verdeeld in Ascl1- of Ngn2-specifieke, of gemeenschappelijke en uitgevoerde KEGG-pathway-verrijkingsanalyse (Fig. 3a, b; Aanvullende afb. 10e). Interessant genoeg reguleert Ascl1 genen die betrokken zijn bij cellulaire veroudering en het verlaten van de celcyclus, zoals Cdkn1a, Cebpa, Cebpb (Aanvullende afb. 8d, gr)57,58, en reguleert ook meer genen die betrokken zijn bij pluripotentie, bijvoorbeeld Pou5f1 (codeert voor eiwit OCT4), Klf2, Sox2, Lef1, Linkshandig2, vergeleken met Ngn2 (Fig. 3b, Fig. 1iAanvullende Fig. 10e). Daarom hebben we vervolgens gekeken naar de dynamiek van het afsluiten van het pluripotentienetwerk (PPN) na Ascl1- en Ngn2-inductie. Hiervoor hebben we ons geconcentreerd op de drie belangrijkste pluripotentiegenen: Pou5f1 (4 okt), Sox2, Nanog (Fig. 3c, Fig. 1i). Nanog wordt gedownreguleerd met vergelijkbare kinetiek tussen Ascl1 en Ngn2 (Fig. 3c, Fig. 1iAanvullende Fig. 11a, b). In tegenstelling tot, Sox2 expressie blijft behouden na Ngn2-inductie terwijl een NSC-genregulatienetwerk tot stand wordt gebracht, terwijl door Ascl1 geïnduceerde cellen de expressie van Sox2 (Fig. 3c, Fig. 1iAanvullende Fig. 11a, b). Op dezelfde manier leidt Ascl1-inductie tot een snel verlies van Oct4-expressie, terwijl Ngn2-inductie leidt tot geleidelijke downregulatie van Oct4 (Fig. 3c-e, Fig. 1i). Bovendien komt het verlies van Oct4 overeen met de opregulatie van trofoblastmarker KRT8 (Fig. 3f).
a, b Aantal Ascl1, Ngn2 specifieke of gemeenschappelijke opgereguleerde (a) en gedownreguleerd (b) genen uit Fig. 1i. c qPCR-gegevens van de expressie van de belangrijkste pluripotentiegenen (genormaliseerd naar de expressie van actine en dag 0). Er worden lijnen getrokken door het gemiddelde van n = 3 biologisch onafhankelijke monsters; foutbalken geven ± SD aan. Boven, p-waarden van de tweezijdige Welch two-sample t-test waarbij PPN-genen worden vergeleken die tot expressie worden gebracht tussen Ascl1 en Ngn2 op het gegeven tijdstip. d Representatieve immunokleuringen voor de OCT4-dynamiek na Ascl1- of Ngn2-inductie. e Kwantificering van OCT4-expressie met behulp van intracellulaire immunokleuring gevolgd door FACS. f Representatieve immunokleuring voor de pluripotentiemarker OCT4 en trofoblastmarker KRT8 op dag 1 na Ascl1- of Ngn2-inductie. g Efficiëntie van iN-vorming in aanwezigheid van OCT4-overexpressie. Elke stip vertegenwoordigt een individuele ESC-kloon die een overexpressieconstruct bevat. De efficiëntie wordt gemeten aan de hand van het percentage van de Mapt-Venus-bevolking. Boxplots geven het 25e en 75e percentiel aan als grenzen van de box met de mediaan middellijn; snorharen geven minima/maxima aan van een 1.5x afstand van de IQR tot het 25e en 75e percentiel. p-waarde van de hierboven aangegeven tweezijdige Welch-t-test met twee steekproeven. h Efficiëntie van iN-vorming, gemeten aan de hand van het percentage cellen die Mapt-Venus tot expressie brengen, en iT-vorming, het percentage cellen dat immunologisch is gekleurd voor KRT8 van polyklonale populatie die Oct4-BFP tot overexpressie brengt. Staafdiagram toont het gemiddelde van n = 3 onafhankelijke biologische replicaten met ± SD; de p-waarden werden berekend met behulp van de tweezijdige Welch two-sample t-test. i Efficiëntie van iN-vorming bij acute knock-out van kernpluripotentie. De efficiëntie wordt gemeten aan de hand van het percentage van de Mapt-Venus-bevolking. Het staafdiagram toont het gemiddelde van n = 3 biologisch onafhankelijke monsters met ± SD. p-waarden, hierboven aangegeven, werden berekend met behulp van eenweg-ANOVA gevolgd door de meervoudige vergelijkingstest van Dunnett (tweezijdig) met behulp van sgCtrl als controle. j Representatieve immuunkleuringen van (i) voor iN en iT geïnduceerd door Ascl1. j Representatieve immuunkleuringen van (i) voor iN en iNSC geïnduceerd door Ngn2. Brongegevens worden geleverd als een brongegevensbestand.
Om de functionele relevantie van het verlies van Oct4 te testen, hebben we Oct4 constitutief tot overexpressie gebracht en meerdere klonale mESC-cellijnen gegenereerd (Fig. 3g, h). Terwijl overexpressie van Oct4 samen met Ngn2 leidt tot een vermindering van de iN-populatie, verhoogt co-expressie van Oct4 en Ascl1 de efficiëntie van iN-vorming (Fig. 3g, h). Op zijn beurt wordt iT-vorming belemmerd in de aanwezigheid van Oct4 (Fig. 3h). Tijdens de ontwikkeling remt Oct4 de differentiatie van de trofectoderm-lijn, en snel verlies van Oct4 wordt geassocieerd met de opregulatie van de trofectoderm-markers.59,60. Het snelle verlies van Oct4 genereert dus permissieve omstandigheden voor iT-lijnvorming, die concurreren met de vorming van iN.
Gegeven de kinetische verschillen in de downregulatie van PPN na Ascl1- of Ngn2-inductie, hebben we getest of een gedwongen verstoring van de PPN samen met differentiatie de ESC naar iN-conversie zou beïnvloeden. Als Pou5f1 (4 okt), Sox2 en Nanog zijn essentieel voor ESC (Fig. 2b), wij geïnfecteerde cellen waarop de gidsen zich richten Pou5f1 (4 okt), Sox2 en Nanog 2 dagen vóór de inductie van Ascl1 of Ngn2 (Fig. 3i-k). Interessant is dat Ascl1-inductie leidt tot de vorming van zowel iN als iT bij het uitschakelen van alle pluripotentiefactoren (Fig. 3j). We zien weinig tot geen effect na het targeten van Oct4, omdat Oct4 snel verloren gaat bij Ascl1-inductie (Fig. 3i). Echter, knock-out van Nanog of Sox2 is voorstander van iN-vorming, wat suggereert dat extra verstoring van de PPN de installatie van de iN-staat ondersteunt (Fig. 3i, j). Op zijn beurt, knock-out van Sox2 heeft de vorming van iNSC door Ngn2 afgeschaft, wat dat aantoont Sox2 wordt herbestemd van de PPN naar het NSC-genregulatienetwerk (Fig. 3i, k). Evenzo verstoring van beide Nanog or Pou5f1 (4 oktober) resulteerde ook in verlies van iNSC (Fig. 3k). In plaats daarvan observeerden we de vorming van primitief endoderm en trofoblast bij verlies van Nanog or Pou5f1 (4 oktober), respectievelijk (Fig. 3kAanvullende Fig. 11c, d), in lijn met de uitkomst van het verlies van deze factoren tijdens de ontwikkeling59,60,61.
Deze gegevens, samen met de differentiële afhankelijkheden die in het CRISPR-scherm zijn geïdentificeerd, laten zien dat Ascl1- en Ngn2-inductie leidt tot uitgesproken functionele verschillen bij het verlaten van de pluripotentietoestand van ESC. Ascl1-inductie leidt tot een efficiënte afsluiting van PPN en later tot inductie van het iN- of iT-gennetwerk, terwijl Ngn2 de PPN niet volledig downreguleert en in plaats daarvan over beide netwerken heen ligt, waardoor genen opnieuw worden ingezet voor de inductie van NSC's.
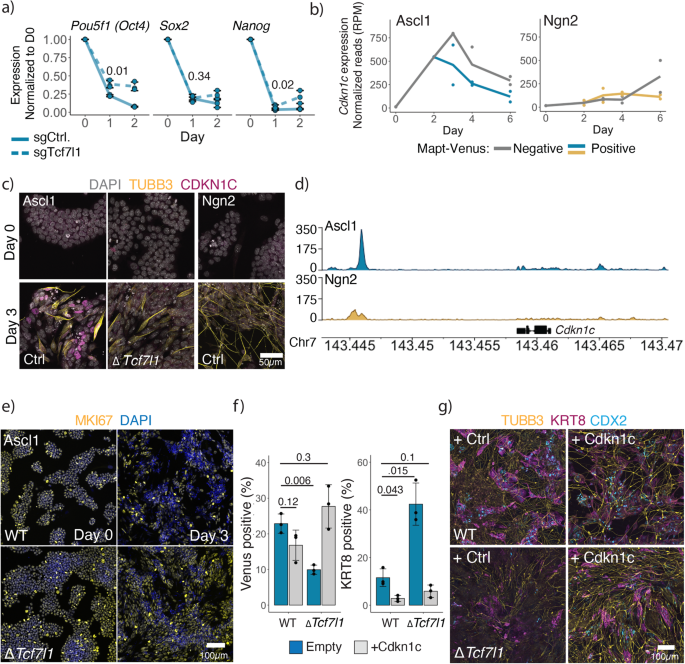
Tcf7l1 is vereist voor het verlaten van de celcyclus om Ascl1 iNs te genereren
Vervolgens concentreerden we ons op de door Ascl1 geïnduceerde PPN-uitschakeling. Bij Ascl1-aangedreven MEF naar iN-transdifferentiatie vergemakkelijkt Myt1l iN-vorming door zowel initiële fibroblast GRN als alternatieve myoblast-afstamming te onderdrukken16,62. Gezien de snelle downregulatie van PPN hebben we getest of Myt1l op dezelfde manier vereist is voor de conversie van ESC naar iN. Ons scherm liet dat echter niet zien Mijn1l, of zijn paralogen Mijn1 en St18, zijn vereist voor ESC naar iN-conversie (aanvullende afbeelding XNUMX). 12) evenals validatie-experimenten met behulp van aanvullende sgRNA's (aanvullende figuur XNUMX). 12b). In het CRISPR-scherm identificeerden we Tcf7l1 (T-celfactor/lymfoïdeversterkerfactor, ook bekend als Tcf3), een repressor van PPN, essentieel voor iN-vorming door Ascl1. Wij bevestigden de Tcf7l1 knock-out fenotype in een afzonderlijke E14-achtergrond en sloot uit dat het verlies van Tcf7l1 de expressie van het Ascl1-transgen beïnvloedde (aanvullende figuur XNUMX). 12c-e). Tcf7l1 is klaar voor de meerdere promoters van PPN-gerelateerde genen en onderdrukt snel hun expressie na ESC-differentiatie48,63,64, en de afwezigheid van Tcf7l1 stabiliseert de ESC-status64. We wilden dus testen of Tcf7l1 vereist is voor of na het begin van de celtypeconversie, en secundaire effecten als gevolg van de stabilisatie van de PPN vóór de conversie uitsluiten. Hiervoor hebben we Tcf7l1 N-terminaal getagd met een door Auxine induceerbare degron, geïnfecteerde cellen met lentivirale vector die osTIR1 draagt (F-box E3-ubiquitine ligase, afgeleid van Oryza sativa) en genereerde van één cel afgeleide klonen (aanvullende figuur XNUMX). 12f)65. Vervolgens hebben we Tcf7l1 vóór of bij het begin van de conversie uitgeput door de toevoeging van Auxine (aanvullende figuur XNUMX). 12g). Terwijl de uitputting van Tcf7l1 vóór inductie slechts een mild effect had op de vorming van iN, verminderde de afbraak van Tcf7l1 bij het begin van Ascl1-inductie het aantal neuronen geproduceerd door Ascl1 ernstig (aanvullende figuur XNUMX). 12g). Dit geeft aan dat Tcf7l1 na de inductie werkt in plaats van de PPN te stabiliseren.
Om de rol van Tcf7l1 in de Ascl1-geïnduceerde ESC naar iN-gerichte differentiatie te begrijpen, hebben we uit één cel afkomstige klonen gegenereerd met een homozygote Tcf7l1 knock-out en uitgevoerde bulk-RNAseq op dag 1 na inductie (aanvullende figuur XNUMX). 13). Omdat Tcf7l1 fungeert als een repressor van het pluripotentienetwerk tijdens ESC-differentiatie, hebben we eerst gekeken naar de pluripotentie-uitschakeling in de Tcf7l1 knock-out cellen. Verrassend genoeg werd de PPN nog steeds gedownreguleerd na Ascl1-inductie in afwezigheid van Tcf7l1 (Fig. 4a; Aanvullende afb. 13). We hebben echter een groep genen waargenomen die niet tot expressie konden worden gebracht ΔTcf7l1 klonen (aanvullende figuur. 13). Interessant, Cdkn1c is sterk opgereguleerd na Ascl1-inductie in vergelijking met ΔTcf7l1 (Aanvullende afb. 13), en de expressie ervan is specifiek voor Ascl1-inductie en piekt op dag 3 van ESC naar iN-conversie (Fig. 4b, c; Aanvullende afb. 13b). Bovendien vertoont Ascl1 een sterke binding dichtbij Cdkn1c locus in vergelijking met Ngn2 (Fig. 4d).
a qPCR van kernpluripotentiegenexpressie na inductie in WT en Tcf7l1 KO-cellen. Expressie genormaliseerd op Actine en dag 0. Er worden lijnen getrokken door het gemiddelde van n = 3 biologisch onafhankelijke monsters; foutbalken geven ± SD aan. p-waarden van de tweezijdige Welch-t-test met twee steekproeven, waarbij sgTcf1l1 wordt vergeleken met sgControl op dag 1, zoals hierboven aangegeven. b Cdkn1c expressie tijdens ESC naar iN-conversie (Fig. 1a). c Immunokleuring van CDKN1C op dag 0 en dag 3 van de ESC naar iN-conversie door Ascl1 WT of Tcf7l1 KO- of Ngn2 tot expressie brengende cellen. d Binding van Flag-Ascl1 of Flag-Ngn2 in de Cdkn1c locus op dag 1 na inductie. Gegevens die gecombineerde metingen van vier replicaties tonen. e Immunokleuringen van proliferatiemarker MKI67 na inductie van Ascl1 in WT of Tcf7l1 KO ESC-cellen. f FACS-gegevens van overexpressie van Cdkn1c met Ascl1 in WT of Tcf7l1 KO ESC's. De efficiëntie van iN-vorming wordt gemeten aan de hand van het percentage van de Mapt-Venus-populatie, de efficiëntie van iT-vorming wordt gemeten aan de hand van het percentage cellen dat immunologisch is gekleurd voor KRT8. Het staafdiagram toont het gemiddelde van n = 3 onafhankelijke biologische replicaten met ± SD. p-waarde van de hierboven aangegeven tweezijdige Welch-t-test met twee steekproeven. g Representatieve beelden van immuungekleurde cellen voor neuronale TUBB3- en trofoblast CDX2/KRT8-markers op dag 6 na inductie van WT of Tcf7l1 KO ESC's met Ascl1 en Cdkn1c. Brongegevens worden geleverd als een brongegevensbestand.
Ascl1-gerichte differentiatie is afhankelijk van de celcyclus
Cdkn1c is een cycline-afhankelijke kinaseremmer van de cip/kip-familie die het stoppen van de celcyclus in G1 reguleert66. Cdkn1c is essentieel voor de embryonale ontwikkeling, en muizen zonder Cdkn1c sterven perinataal met meerdere ontwikkelingsstoornissen. Bovendien is Cdkn1c belangrijk voor de ontwikkeling van vroege placenta om de endoreplicatie van trofoblasten te initiëren66. Onlangs was Cdkn1c ook betrokken bij de onderdrukking van pluripotentie in ESC van muizen67. We zien verder dat door Ascl1 geïnduceerde centrale GRN-knooppunten meerdere genen bevatten die betrokken zijn bij de regulering van de celcyclus, bijvoorbeeld Cdkn1a, Cdkn1b, Cebpa, Cebpb (Aanvullende afb. 8d, gr). Daarom veronderstelden we dat in ΔTcf7l1 cellen, Ascl1 is niet in staat de celcyclus te stoppen. We observeren inderdaad langdurige expressie van MKI67, evenals een hoger percentage delende cellen na inductie van Ascl1 in de ΔTcf7l1 cellen (afb. 4eAanvullende Fig. 13c). Om te testen of de expressie van Cdkn1c voldoende is om iN-vorming te induceren in afwezigheid van Tcf7l1, hebben we Cdkn1c samen met Ascl1 tot co-expressie gebracht. We zien inderdaad een gedeeltelijke redding van iN-vorming en een afname van de iT-generatie (Fig. 4f, gr). Verder zien we dat de expressie van Cdkn1c ook in WT-populaties op dag 6 een volwassener neuronaal en trofoblastfenotype genereert (Fig. 4g). Merk op dat Cdkn1c niet essentieel is voor de vorming van door Ascl1 geïnduceerde iNs, wat suggereert dat een groep celcyclusregulatoren, in plaats van Cdkn1c alleen, verantwoordelijk is voor het stoppen van de celcyclus (aanvullende figuur XNUMX). 13d).
Alles bij elkaar laten onze gegevens zien dat bij Ascl1-geïnduceerde ESC naar iN-conversie het stoppen van de celcyclus een wegversperring is na het verlaten van de pluripotentietoestand en dat Cdkn1c voldoende is om deze wegversperring te overwinnen. Deze afhankelijkheid wordt daarentegen niet waargenomen voor Ngn2-afhankelijke iN-vorming, waarbij de celcyclus behouden blijft en sommige ESC's overgaan naar NSC's.
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. Automotive / EV's, carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- ChartPrime. Verhoog uw handelsspel met ChartPrime. Toegang hier.
- BlockOffsets. Eigendom voor milieucompensatie moderniseren. Toegang hier.
- Bron: https://www.nature.com/articles/s41467-023-40803-y