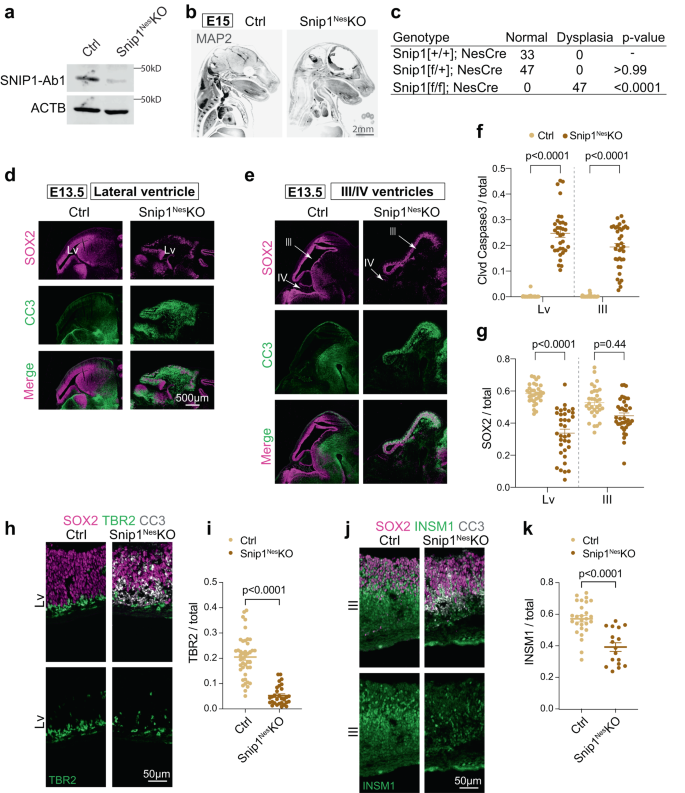
SNIP1은 뮤린 배아 뇌에서 NPC의 생존에 필요합니다.
의 표현을 먼저 살펴보았습니다. 싹둑1 RNAscope에 의한 쥐의 배아 뇌에서40. 배아일 E11.5 및 E13.5에서, 싹둑1 전 사체는 거의 모든 세포에서 발현되었으며 NPC가 상주하는 심실을 감싸는 신경 표피에서 강력하게 발현되었습니다 (보충 그림 XNUMX). 1b, c). 뮤린 배아 뇌에서 SNIP1을 연구하기 위해 우리는 네스틴 (네스) ::Cre NPC에서 조건부로 SNIP1을 고갈시키기 위해(이하 싹둑1네스-KO. 네스::Cre는 플록스 부위를 재조합하고 엑손 2를 제거하기 위해 NPC에서 발현된다. 싹둑1 (무화과. 1a보충 그림. 1일~금보충 그림. 2a~d). E15까지, 싹둑1네스-KO 배아는 뇌 조직이 심하게 얇아지고 100% 침투하는 이형성증을 나타냈습니다(그림. 1b, c, p < 0.0001(Fisher의 정확 테스트). 뇌 이형성증의 세포 기반을 이해하기 위해 싹둑1네스-KO, 우리는 NPC의 세포 증식과 세포 사멸을 조사했습니다. NPC는 신경 줄기 세포 마커 SRY-box 2(SOX2)의 발현으로 확인되었습니다. 생체 내에서 증식하는 세포를 확인하기 위해 BrdU를 임신한 어미에 주입하거나 증식 마커 Ki67을 검출했습니다. 신경 표피에서 이들 마커의 정량화는 형제 대조군 및 싹둑1네스-KO 배아(보충 그림. 2e-h).
a 제어의 WB 및 싹둑1네스-E13.5에서 NPC KO. 최소 5번의 제어 복제 및 싹둑1네스-KO NPC도 비슷한 결과를 보였다. SNIP1-Ab1; ProteinTech의 항-SNIP1 항체. b 제어 중인 MAP2의 IF 및 싹둑1네스-E15에서 KO 배아. 배아는 iDISCO 방법으로 제거하고 광 시트 현미경으로 이미지화했습니다. IF의 두 복제는 유사한 결과를 보여주었습니다. 막대, 2mm. c E13.5 배아에서 뇌 이형성증의 침투. 뇌 이형성증은 뇌 조직의 얇아짐에 의해 결정되었습니다. 통계적 유의성은 Fisher's exact test로 계산하였다. d~e E2 뇌의 시상 동결 절편에서 SOX3 및 절단된 카스파제 3(CC13.5)의 IF. 측뇌실(Lv, forebrain), 제500뇌실(중뇌) 및 제XNUMX(후뇌) 뇌실 주변의 배아대를 검사했습니다. 바, XNUMXμm. f, g 제어 심실의 신경 상피 내벽에서 CC3 양성 및 SOX2 양성 세포의 정량화 및 싹둑1네스-E13.5에서 KO 배아. DAPI 염색을 사용하여 총 세포 수를 세었습니다. 각 데이터 포인트는 하나의 이미지를 나타냅니다. 7개의 대조군 배아와 XNUMX개의 배아 싹둑1네스-KO 배아를 분석하였다. 안에 (f), 측면 심실의 경우, n = 38개 이미지(대조군) 및 n = 34 (싹둑1네스-KO); 세 번째 뇌실의 경우, n = 38(대조군) 및 n = 36 (싹둑1네스-코). 안에 (g), 측면 심실의 경우, n = 33(대조군) 및 n = 35 (싹둑1네스-KO); 세 번째 뇌실의 경우, n = 32(대조군) 및 n = 37 (싹둑1네스-코). 데이터는 평균 ± SEM으로 표시하고 양방향 ANOVA를 통계 분석에 사용했습니다. h–j E2 뇌의 신경 계보 마커 TBR3 및 INSM2과 오버레이된 SOX1 및 CC13.5의 IF. 막대, 50μm. i, k 측면 또는 제2뇌실의 신경상피 내층에서 TBR1 양성 또는 INSM8 양성 세포의 정량화. 각 데이터 포인트는 하나의 이미지를 나타냅니다. 3~7개의 대조군 배아와 XNUMX~XNUMX개의 배아 싹둑1네스-KO 배아를 분석하였다. 안에 (i), n = 43개 이미지(대조군) 및 n = 30 (싹둑1네스-KO); 안에 (k), n = 27(대조군) 및 n = 17 (싹둑1네스-코). 데이터는 평균 ± SEM으로 표시하고 양방향 ANOVA를 통계 분석에 사용했습니다. 소스 데이터는 소스 데이터 파일(a, f, g, i, k).
다음으로 절단된 (cl)-카스파제 3의 IF에 의한 세포사멸을 조사했습니다. E13.5에서 모든 뇌실은 싹둑1네스-KO는 신경 표피의 뇌실하 영역에서 cl-카스파제 3의 강력한 유도를 나타냈다(도 XNUMXb). 1일~금). cl-caspase 3 신호는 SOX2 양성 NPC와 TBR2 양성 중간 전구체를 중첩했습니다(보충 그림 XNUMX). 2i–XNUMX)에서 현저하게 감소하였다. 싹둑1네스-KO 신경상피(Fig. 1d–i). INSM1 양성 중간 전구체는 싹둑1네스-KO 중뇌(Fig. 1j,k). 이러한 데이터는 SNIP1이 발달 중인 뇌의 NPC 및 중간 전구체에서 세포사멸을 억제함을 시사합니다.
이전 이벤트를 캡처하려면 싹둑1네스-KO 뇌, 우리는 E3 배아 뇌에서 cl-caspase 11.5를 검사했습니다. E11.5에 의해 cl-카스파제 3 신호가 싹둑1네스-KO 뇌(보충 그림. 3a~d). 같이 네스::Cre는 E10.5에 의해 켜집니다.41, SNIP1 고갈은 24시간 이내에 세포사멸을 유도할 가능성이 높습니다. 측면, 세 번째 및 네 번째 뇌실에서 SOX2 양성 세포의 정량화는 네 번째 뇌실의 NPC만이 E11.5에 의해 고갈되었음을 보여주었습니다(보충 그림 XNUMX). 3e). 이후 우리는 SNIP1에 의한 세포 사멸 조절을 연구하기 위해 측면 및 제 XNUMX 뇌실 분석에 중점을 두었습니다.
SNIP1 고갈이 지속적으로 관찰된 세포 사멸을 유발하는지 확인하기 위해 우리는 Ex1:: 등쪽 종뇌의 NPC에서 조건부로 SNIP1을 고갈시키는 Cre42. 그만큼 싹둑1Ex1-KO 배아는 또한 세포사멸의 강력한 유도, TBR2-양성 중간 전구세포의 소실, 전뇌의 이형성증을 보였다(보충 그림 XNUMX). 3f–k). 이러한 발견은 발달중인 쥐의 뇌에서 세포 사멸 유도 및 이형성증이 SNIP1 고갈에 특이적이라는 것을 뒷받침합니다. 이 데이터는 SNIP1이 NPC 및 중간 전구체에서 세포 사멸 방지 및 생존 메커니즘에 필요하다는 결론을 뒷받침합니다.
SNIP1은 본질적인 세포 사멸 프로그램을 억제합니다
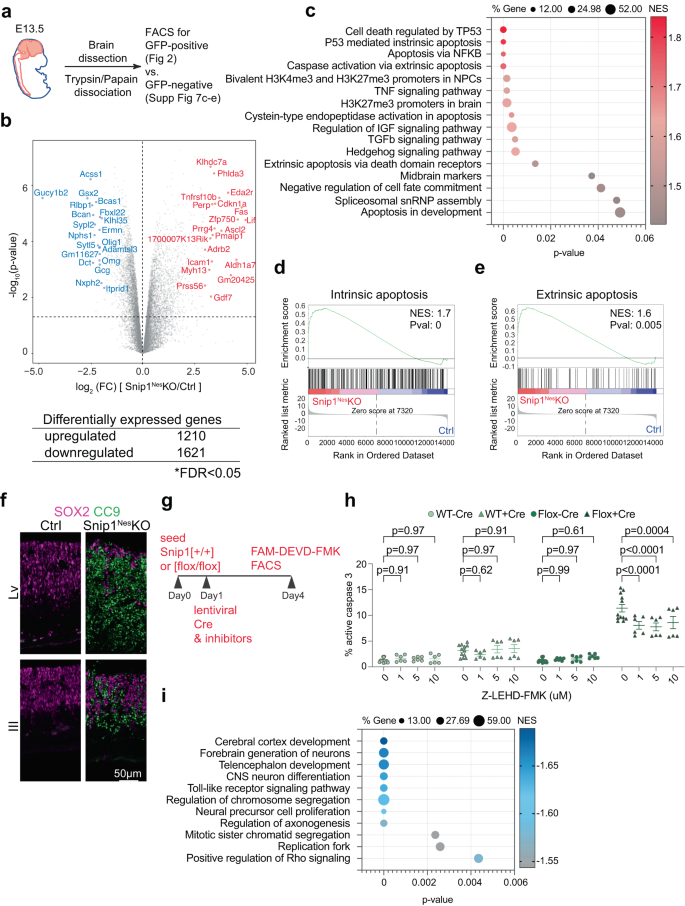
결함의 분자 기반을 밝히기 위해 싹둑1네스-KO NPC, E2에서 분류된 SOX13.5 양성 NPC의 RNA 시퀀싱(RNA-seq)을 수행했습니다. 싹둑1네스-KO 및 형제 컨트롤(그림. 2a보충 그림. 4a). 백만분의 일(CPM) 값 > 1인 유전자를 대조군 또는 싹둑1네스-KO NPC. FDR(False Discovery Rate) < 0.05 기준을 사용하여 대조군 및 싹둑1네스- KO NPC, 우리는 1210개의 상향 조절된 유전자와 1621개의 하향 조절된 유전자를 확인했습니다. 싹둑1네스-KO(그림. 2b보충 그림. 4b~d).
a 두뇌 NPC 컬렉션의 개략도. b Volcano plot 및 대조군과 대조군 사이에 차별적으로 발현된 유전자의 수 싹둑1네스-KO NPC. 표는 FDR < 0.05의 컷오프를 통과한 유전자의 수를 보여줍니다. FDR은 Benjamini & Hochberg 방법으로 계산되었습니다. P 값은 양면 Voom-limma에 의해 계산되었습니다. t 테스트. c, i 에서 상향 조절된 유전자 및 하향 조절된 유전자의 풍부한 유전자 세트의 버블 플롯 싹둑1네스-KO 대 컨트롤 NPC. 차등적으로 발현된 유전자는 배수 변화에 따라 첫 번째로 순위가 매겨졌습니다. p-값, Gene Set Enrichment Analysis(GSEA)를 수행하기 전의 발현 수준. P- 값은 FDR 조정과 함께 오른쪽 순열 테스트로 계산되었습니다. d, e 상향 조절된 유전자의 대표적인 GSEA 싹둑1네스-KO 대 컨트롤 NPC. 상향 조절된 유전자는 내인성 및 외인성 세포사멸과 관련된 유전자 세트가 풍부했습니다. 차등적으로 발현된 유전자는 접힘 변화에 의해 먼저 순위가 매겨졌고 p-GSEA를 수행하기 전의 값. f E9 뇌의 시상 동결 절편에서 SOX9로 오버레이된 절단된 카스파제 2(CC13.5)의 IF. 막대, 50μm. g mCherry-Cre 렌티바이러스를 사용한 형질도입 및 억제제를 이용한 치료 싹둑1[+/+] 및 싹둑1[플록스/플록스] NPC. h FACS에 의해 정량화된 활성 카스파제 3을 가진 세포의 백분율. 카스파제 9 억제제(Z-LEHD-FMK)를 mCherry-Cre 렌티바이러스와 함께 다양한 농도로 첨가했습니다. FAM-FLICA(활성 카스파제 3)-양성 인구(전체 인구 중)의 백분율이 표시됩니다. N = DMSO 제어의 경우 12 및 n 나머지 샘플의 경우 = 6입니다. 데이터는 평균 ± SEM으로 표시하고 양방향 ANOVA를 통계 분석에 사용했습니다. 게이팅 전략과 대표적인 FACS 플롯은 보충 정보(보충 그림 XNUMX)에 나와 있습니다. 4e, 보충 그림 14a). 소스 데이터는 소스 데이터 파일(c, h, i).
유전자 세트 농축 분석(GSEA)은 싹둑1네스-KO NPC는 p53 매개 아폽토시스, H3K27me3 또는 NPC와 뇌의 XNUMX가 프로모터, 중뇌 마커, spliceosomal 작은 핵 리보핵단백질 입자, TNF, IGF, TGFβ 및 Hedgehog를 포함하는 신호 경로와 관련된 기능이 풍부했습니다(그림 XNUMX). 2c). 내인성 및 외인성 세포 사멸 시그니처가 상향 조절 된 유전자에서 풍부 해짐에 따라 싹둑1네스-KO NPC(그림. 2d, e), 이 두 경로의 활성화를 조사했습니다. IF는 외인성 세포 사멸 경로의 이펙터 인 cl-caspase 8의 신호를 거의 나타내지 않았습니다.43,44 (보충 그림. 5a) 그러나 내인성 아폽토시스 경로의 이펙터인 cl-카스파제 9의 강력한 신호45,46,47, 심실의 신경 표피 전체(그림. 2f). 또한, FAM-DEVD-FMK 염색의 FACS에 의한 cl-카스파제 3의 정량화48,49 카스파제 8의 억제가 세포자멸사를 완만하게 변화시킨 반면, 카스파제 9의 억제는 싹둑1네스-KO NPC(그림. 2g, h보충 그림. 4e보충 그림. 5b). 카스파제 9 억제제인 Z-LEHD-FMK는 9μM에서 카스파제 1를 효과적으로 억제했으며 20 및 40μM에서 세포독성을 일으켰습니다(그림 XNUMX). 2h보충 그림. 4f). 증가된 세포사멸의 원인을 규명하기 위해, 우리는 DNA 손상의 증가를 감지하지 못했습니다(보충 그림 XNUMX). 5c~f) 그러나 SOX53 양성 NPC에서 p2 신호의 강한 증가를 감지했습니다(보충 그림 XNUMX). 5g–i). 이 데이터는 싹둑1네스-KO 배아는 NPC에서 p53 매개 내인성 세포 사멸의 조절 장애를 보였다. 우리는 SNIP1이 신경발달 프로그램의 일부로 내인성 세포사멸을 주로 억제한다고 제안합니다.
하향 조절된 유전자 싹둑1네스-KO NPC는 전뇌 및 피질 발달, CNS 뉴런 분화, 염색체 분리, NPC 증식, 축삭 형성, 복제 포크 및 TLR 및 Rho를 포함하는 신호 경로와 관련된 기능이 풍부했습니다(그림 XNUMX). 2i). 비록 싹둑1네스-KO 전뇌 조직은 아폽토시스의 결과로 심한 얇아짐을 나타냈고, 전뇌 마커 FOXG1 및 중뇌/후뇌 마커 OTX2는 대조군과 후뇌 마커 사이에서 유사하게 검출되었습니다. 싹둑1네스-KO 두뇌(보충 그림. 5j). 이 데이터는 SNIP1 고갈이 forebrain 사양을 변경하지 않았음을 시사합니다.
다른 하향 조절 유전자 싹둑1네스-KO NPC는 자가 갱신 제어에 관여했습니다(그림 XNUMX). 2i). 특성화 싹둑1네스-시험관 내 KO NPC는 대조 NPC와 비교하여 배양된 것으로 나타났습니다. 싹둑1네스-KO NPC는 SOX2 발현을 감소시켰습니다. 6a, b). NPC가 정지 및 연속 통과를 통해 신경구를 형성할 수 있도록 함으로써 신경구 수와 단면적이 싹둑1네스-대조군과 비교한 KO(보충 그림. 6c~e). 인간 SNIP1의 과발현(마우스 SNIP85과 1% 동일성)은 배양 세포에서 자기 재생을 구출하기에 충분했습니다. 싹둑1네스-KO NPC(보충 그림. 6f,g), 인간과 생쥐 사이의 SNIP1의 기능적 보존을 제안합니다. 전반적으로 우리는 SNIP1이 NPC 자기 재생을 유지하기 위해 세포 생존을 촉진한다는 결론을 내립니다.
SNIP1은 NPC의 분화를 억제합니다
E13.5에서 배아 뇌는 신경 발생을 겪기 때문에 미성숙 뉴런 마커 TUJ1을 검사했습니다. TUJ1 양성 영역의 상대적인 두께는 싹둑1네스-E13.5에서 KO 및 제어(보충 그림. 7a, b). 고려해 보면 싹둑1네스-KO NPC는 점진적으로 고갈되었고, 이러한 차이의 부족은 놀라운 일이었습니다. 따라서 우리는 NPC 표지자 SOX1의 발현을 상실한 분화 신경 세포에서 SNIP2의 분자 효과를 조사했습니다. 우리는 E2에서 분류된 SOX13.5:GFP 음성 세포의 RNA-seq를 수행했습니다. 싹둑1네스-KO 및 형제 제어 두뇌(그림. 2a보충 그림. 4a). 배수 변화 >2의 기준을 사용하고 p < 0.05는 대조군과 싹둑1네스- KO, 우리는 658개의 상향 조절된 유전자와 150개의 하향 조절된 유전자를 확인했습니다. 싹둑1네스-KO(보충 그림. 7c). GSEA는 상향 조절된 유전자가 싹둑1네스-KO 세포는 NPC에서 3가 마크(H27K3me3 및 H4K3meXNUMX)에 의해 점유되는 아폽토시스 클리어런스, 뉴런 사양 및 분화, 중뇌 마커 및 공지된 고-CpG 밀도 프로모터와 관련된 기능이 풍부하였다.50 (보충 그림. 7d). 하향 조절된 유전자 싹둑1네스-KO 세포는 spliceosome, translation 및 ribosome, nucleosome 조직 및 p21을 통한 세포 사멸과 관련된 기능이 풍부했지만 p53은 그렇지 않았습니다 (보충 그림 XNUMX). 7e). 이러한 결과는 SNIP1이 세포사멸, 신경세포의 특이화 및 분화, 중뇌 유전자 프로그램 및 H3K27me3-점유 유전자를 억제함을 시사한다. E13.5에서 상향 조절된 세포사멸은 감소하지만 싹둑1네스-KO NPC 및 중간 전구체, 나머지는 신경 사양 및 분화를 상향 조절한 세포를 생성합니다. 이것들을 조합하면 TUJ1 양성 피질 두께에 명백한 차이가 없을 가능성이 높습니다. 싹둑1네스-KO 및 제어.
다음으로 NPC의 체외 분화를 통해 SNIP1을 분석했습니다. 우리는 변환을 통해 1일차 또는 1일차에 SNIP5을 고갈시켰습니다. 싹둑1[flox/flox] 14일차에 렌티바이러스 제어 또는 Cre 및 프로파일링된 유전자 발현이 있는 NPC(보충 그림 XNUMX) 7f). 정량적 qPCR은 대조군 세포와 비교하여 SNIP1이 고갈된 세포가 뉴런 및 신경아교 마커를 상향 조절하지만 NPC 마커는 상향 조절하지 않음을 보여주었습니다(보충 그림 XNUMX). 7g, h). SNIP1 고갈의 시기(1일 대 5일)는 이 유전자 발현 패턴에 영향을 미치지 않았다(보충 그림 XNUMX). 7g, h). 이러한 결과는 SNIP1이 NPC에서 신경 발생을 억제한다는 것을 추가로 뒷받침합니다. 제브라피시 배아에서 Snip1의 글로벌 녹아웃(KO)이 GABAergic 및 glutamatergic 뉴런의 감소를 유발함에 따라35, 우리는 SNIP1 고갈이 생쥐의 하위 신경 계통 사양을 변경하는지 여부를 물었습니다. 급격한 뇌 조직 손실로 인해 싹둑1네스-KO, 우리는 E13.5 이상으로 뇌 발달을 강력하게 분석할 수 없었습니다. E13.5에서 GABAergic 신경 마커의 전사 수준 가드1 과 Slc6a1 에서 더 낮았다 싹둑1네스-KO 및 glutamatergic 신경 마커는 사이에 차이가 없었습니다. 싹둑1네스-KO 및 제어(보충 그림. 7i, j). 면역형광의 정량화는 GABA-(GABAergic 신경 마커) 양성 세포가 싹둑1네스-KO(보충 그림. 7k, 리터), subneuronal 혈통을 지정하는 데 SNIP1이 관여하는 것이 고차 종에서 보존될 수 있음을 시사합니다.
SNIP1은 H3K27 변형으로 유전자를 직접 조절합니다
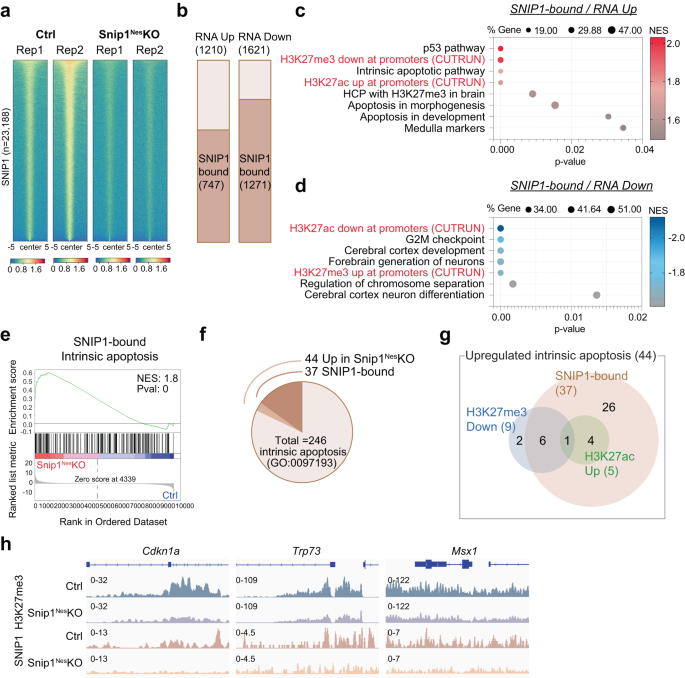
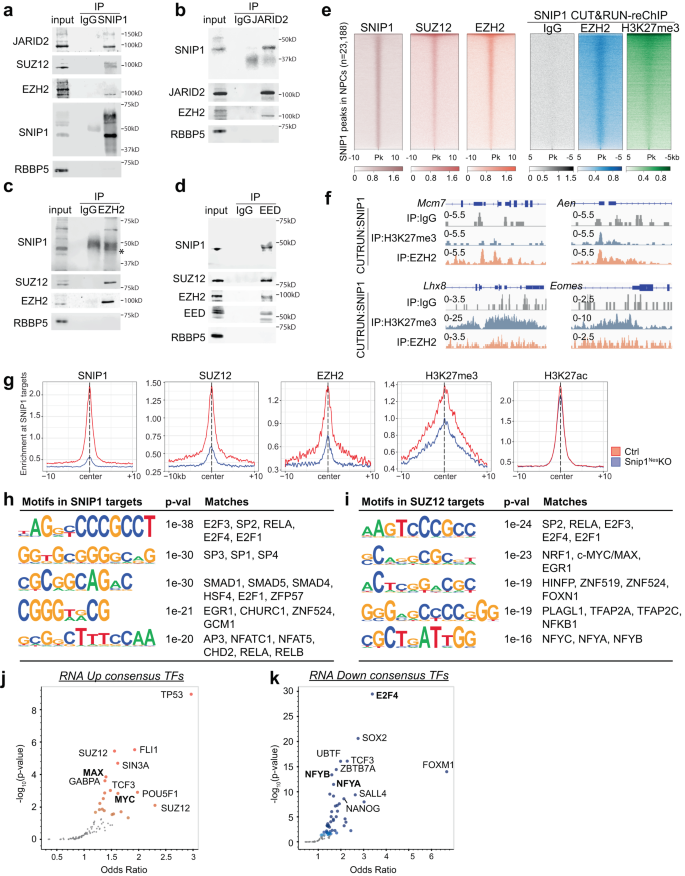
SNIP1 단백질이 유전자좌에 직접 결합하여 발현을 조절하는지 여부를 확인하기 위해 CUT&RUN을 통해 SNIP1의 게놈 전체 분포를 프로파일링했습니다.51 in 싹둑1네스-KO 및 제어 NPC. SICER 사용52 및 MACS253 FDR < 0.05로 대조군과 싹둑1네스-KO, 제어 NPC에서 23,188개의 SNIP1 결합 영역을 식별하고 싹둑1네스-KO NPC(보충 그림. 8a-c). 4187개 영역은 대조군의 18%이며 나머지 SNIP1 단백질의 결과입니다. 싹둑1네스-KO NPC(그림. 1a). 히트맵은 SNIP1 CUT&RUN 신호의 급격한 감소를 보여주었습니다. 싹둑1네스-KO, NPC에서 SNIP1 CUT&RUN의 높은 특이성을 제안합니다(그림. 3a). SNIP50 결합 피크의 약 1%는 프로모터 내에(전사 시작 사이트의 2kb 이내), 7.4%는 엑손에, 23.3%는 인트론에, 0.7%는 전사 종결 사이트에, 9.7%는 5' 원위(2-50 kb) 영역, 3.4' 말단(유전자로부터 3-2kb) 영역에서 50%, 유전자간(유전자로부터 5.5kb 초과) 영역에서 50%(보충 그림 XNUMX) 8d). SNIP18.6 결합 피크의 1%만이 유전자의 말단에 위치했습니다. 8d).
a 대조군에서 SNIP2 CUT&RUN의 생물학적 복제 1개의 결합 강도를 나타내는 히트맵 및 싹둑1네스-KO NPC. 모든 5개의 SNIP23,188 CUT&RUN 피크의 양쪽에 있는 1kb에 대한 결합 강도가 표시됩니다. 파란색은 낮은 강도를 나타내고 빨간색은 높은 강도를 나타냅니다. b 상향 조절 및 하향 조절된 유전자의 수를 표시하는 막대 차트(싹둑1네스-KO 대 대조군, FDR < 0.05) 유전자 본체에서 SNIP1에 의해 결합됩니다. c, d 에서 상향 조절된 유전자 및 하향 조절된 유전자가 된 SNIP1 결합 유전자에서 풍부한 유전자 세트의 버블 플롯 싹둑1네스-KO 대 컨트롤 NPC. H3K27me3/ac CUT&RUN 데이터를 GSEA 유전자 세트에 추가할 때 H3K27me3 및 H3K27ac 수준은 각각 유전자 발현과 반상관 및 상관관계를 나타냈습니다. 소스 데이터는 소스 데이터 파일로 제공됩니다. e 상향 조절된 유전자의 대표적인 GSEA 싹둑1네스-KO NPC 대 제어 NPC에서 SNIP1에 의해 바인딩된 제어 NPC. 내인성 세포 사멸 유전자는 대부분 SNIP1에 결합되어 있으며 싹둑1네스-KO NPC. 차등적으로 발현된 유전자는 접힘 변화에 의해 먼저 순위가 매겨졌고 p-GSEA를 수행하기 전의 값. f 에서 상향 조절되는 내인성 세포 사멸 유전자의 비율을 보여주는 원형 차트 싹둑1네스-KO NPC 및/또는 SNIP1에 구속됨. g 3가지 카테고리에서 상향 조절된 내인성 세포사멸 유전자의 수를 표시하는 벤 다이어그램. SNIP1, H3K27me3 및 H3K27ac CUT&RUN 데이터를 사용하여 44개의 유전자를 1) 제어 NPC에서 SNIP1 결합, 2) H3K27me3 수준 감소 싹둑1네스-KO 대 제어 NPC(p < 0.05) 및/또는 3) H3K27ac 수준 증가 싹둑1네스-KO 대 제어 NPC(p <0.05). h H3K27me3 및 SNIP1 CUT&RUN 트랙은 상향 조절된 내인성 세포사멸 유전자에서 IGV(Integrative Genomics Viewer)로 시각화됩니다. Cdkn1a, Chr17: 29,090,888 - 29,095,850. trp73, Chr4: 154,132,565 - 154,143,373. MSX1, Chr5: 37,818,429 - 37,828,924.
다음으로 SNIP1 점유가 유전자 발현과 관련이 있는지 조사했습니다. 1210개의 상향 조절된 유전자와 1621개의 하향 조절된 유전자 중 싹둑1네스-KO, 747(62%) 및 1,271(78%)은 대조군 NPC에서 각각 SNIP1 표적이었다(도 XNUMXb). 3b). 이러한 중복은 중요합니다. p = 5.55e-25 및 2.24e-155, 초기하학적 테스트(총 21,636개의 발현된 유전자가 주어진 경우)에 의해 각각, SNIP1이 이들 유전자를 점유하여 그들의 발현을 조절함을 시사합니다. GSEA는 상향조절된 SNIP1 표적이 싹둑1네스-KO는 p53 경로, 수질/중뇌 및 세포사멸이 풍부했습니다(그림 XNUMX). 3c), SNIP1 표적은 싹둑1네스-KO는 G2/M 체크포인트, 피질 발달 및 염색체 분리가 풍부했습니다(그림 XNUMX). 3d). 1,621개의 하향 조절된 유전자 중 싹둑1네스-KO, 1,093은 SNIP1 결합(PRC2 결합이 아님)이었고 G2-M 체크포인트, 유사분열 스핀들, 신경 발달 및 세포 사멸을 위한 주요 신호 경로에서 유전 프로그램이 풍부했습니다(보충 그림 XNUMX). 8e), SNIP1이 그들의 발현을 촉진한다는 것을 암시합니다. 내인성 세포 사멸 유전자는 에서 상향 조절 된 SNIP1 표적이 풍부했습니다. 싹둑1네스-KO(그림. 3e, 에프보충 그림. 8f,g). intrinsic apoptosis 유전자 세트에 있는 44개의 유전자 중 37개의 프로모터가 대조군 NPC에서 SNIP1에 의해 결합되었습니다.p = 4.62e-5; 무화과. 3g), SNIP1이 이러한 유전자를 직접적으로 억제한다는 것을 시사합니다. 이러한 데이터는 SNIP1이 세포 사멸 및 세포 주기에 중요한 유전 프로그램을 직접 조절한다는 것을 시사합니다.
상향 조절된 유전자 싹둑1네스-KO는 배아 생쥐의 뇌에서 1) H3K27me3이 차지하는 고밀도 CpG 프로모터의 유전자가 풍부합니다.50 또는 2) 마우스 NPC에서 XNUMX가54 (보충 그림. 9a, b). 이로 인해 SNIP1이 H3K27 변형을 통해 유전자 프로그램을 제어하는지 여부를 면밀히 조사하게 되었습니다. CUT&RUN에서 H3K27me3 및 H3K27ac를 프로파일링했습니다. 싹둑1네스-KO 및 컨트롤 SOX2 양성 NPC(보조 그림 9c–g). 우리는 상향 조절된 유전자, 더 낮은 H3K27me3 점유율 및 더 높은 H3K27ac 점유율 사이에 강한 상관관계를 관찰한 반면, 하향 조절된 유전자는 더 높은 H3K27me3 점유율 및 더 낮은 H3K27ac 점유율을 싹둑1네스-KO(그림. 3c, d보충 그림. 9시, 나). 44개의 상향 조절된 내인성 세포 사멸 유전자 중 9개 유전자는 H3K27me3 점유율이 감소했고 5개 유전자는 H3K27ac 점유율이 증가했습니다.p < 0.05, 그림 3g, h보충 그림. 9j,k). 이러한 데이터는 염색질의 SNIP1이 H3K27 변형 및 유전자 발현을 제어함을 시사합니다.
TGFβ 및 NFκB 신호 전달 경로는 염색질에 대한 SNIP1 국소화를 제어합니다.
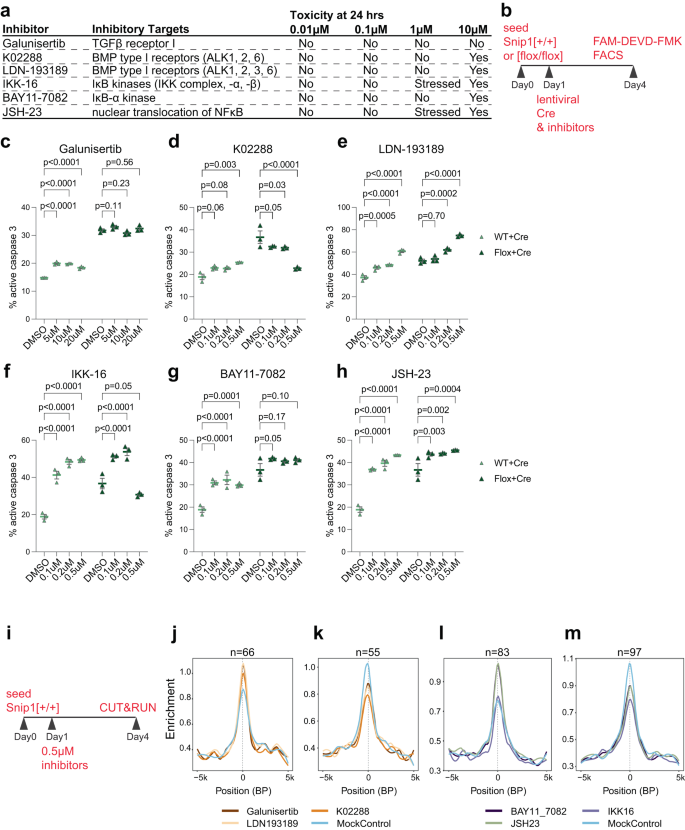
SNIP1이 TGFβ에 참여함에 따라22,23,24,25 및 NFκB26,27,28,29,30 신호 경로, 우리는 그들의 억제가 SNIP1 고갈 NPC에서 세포 사멸에 영향을 미치는지 테스트하는 것을 목표로했습니다. 우리는 NPC에 대한 독성에 대해 TGFβ 또는 NFκB 신호 전달에 대한 3가지 억제제를 테스트했습니다(그림 XNUMX). 4a, b). 0.1–0.5 μM 농도에서 TGFβ를 표적으로 하는 K02288(Galunisertib 또는 LDN-193189는 제외)은 SNIP1이 고갈된 NPC에서 지속적으로 세포사멸을 감소시켰습니다(그림 XNUMX). 4c~e). 대조적으로, TGFβ 신호에 대한 2개의 억제제 및 NFκB 신호에 대한 3개의 억제제는 NPC에서 세포자멸사를 증가시켰다(도 XNUMXb). 4시~시). 따라서 우리는 6가지 억제제 중 어떤 것이 염색질에 결합하는 SNIP1을 변경시키는지 여부를 테스트하기로 결정했습니다. 우리는 0.5일 동안 3 μM에서 DMSO 또는 억제제로 NPC를 처리하고 CUT&RUN을 수행하여 염색질에서 SNIP1 위치를 분석했습니다(그림 XNUMX). 4i). 처리 조건별로 2개의 복제 SNIP1 CUT&RUN 데이터를 분석하여 p < 0.05는 억제제와 대조군 치료 사이의 SNIP1 CUT&RUN 신호의 유의하고 일관된 차이를 식별합니다. K1 처리에 의해 유도된 SNIP02288 CUT&RUN 변화를 확인했습니다(보충 데이터 1). 우리는 또한 SNIP1 결합 유전자에서 SNIP1 CUT&RUN의 중요한 변화가 2가지 억제제 치료에서 중첩되는 것을 확인했습니다(보충 데이터 1). 다른 억제제로 처리된 NPC의 SNIP1 결합 프로모터에서 SNIP1 CUT&RUN 신호의 평균 프로파일링은 TGFβ에 대한 억제를 확인했습니다(그림 XNUMX). 4j,k) 및 NFκB(그림. 4리터, 엠) 시그널링은 프로모터에 대한 SNIP1 결합을 크게 변경했습니다. 이러한 데이터는 TGFβ 및 NFκB 신호 전달 경로가 NPC의 특정 유전자좌에 대한 SNIP1 결합을 제어함을 시사합니다.
a TGFβ 및 NFκB 신호 전달 경로의 구성 요소를 표적으로 하는 억제제 및 다양한 농도에서의 세포 독성. b 억제제 분석의 개략도. 1일차에 WT 또는 싹둑1[flox/flox] NPC를 억제제 또는 DMSO로 처리하고 SNIP1 고갈을 위해 렌티바이러스 Cre로 형질도입했습니다. FAM-DEVD-FMK는 3일째에 FACS에 의해 c4-카스파제 XNUMX를 분석하는 데 사용되었습니다. 시~시 FACS에 의해 정량화된 활성 카스파제 3을 가진 세포의 백분율. 억제제는 mCherry-Cre 렌티바이러스와 함께 다양한 농도로 첨가되었습니다. FAM-FLICA(활성 카스파제 3)-/ mCherry-양성 집단(mCherry-양성 집단 중)의 백분율이 표시됩니다. N = 각 치료에 대해 3. 데이터는 평균 ± SEM으로 표시하고 양방향 ANOVA를 통계 분석에 사용했습니다. 대표적인 FACS 플롯은 보충 그림 XNUMX에 나와 있습니다. 14c, d. 소스 데이터는 소스 데이터 파일로 제공됩니다. i 억제제 처리를 사용한 SNIP1 CUT&RUN의 개략도. 1일째에 NPC를 DMSO 대조군 또는 다른 억제제로 처리하였다. Replicate SNIP1 CUT&RUN은 7일째에 4가지 처리 각각에 대해 수행되었습니다. j~m 저해제에서 상당히 높거나 낮은 SNIP1 결합을 갖는 SNIP1 결합 표적에서 NPC에서 SNIP1의 중간 결합 강도를 DMSO 대조군 처리와 비교하는 프로파일 플롯. n 지역 번호를 나타냅니다. SNIP1 수준이 감소했을 때 지역은 진정한 SNIP1 대상으로 간주되었습니다. 싹둑1네스-KO vs 컨트롤 NPC p <0.05.
PRC2는 염색질에 대한 국소화 및 H1K3me27 증착을 위해 SNIP3이 필요합니다.
우리는 SNIP1, H3K27 methyltransferase PRC2, histone acetyltransferases p300과 CBP 사이의 상호 작용을 조사했습니다. 공지된 PRC1 서브유닛 Jumonji 및 2(JARID2), Suppressor of zeste 2(SUZ12) 및 EZH12를 포함하는 AT-풍부 상호작용 도메인과 공면역침전된 항-SNIP2 항체. 5a). 항-SNIP1 항체는 SNIP2이 고갈된 NPC에서 PRC1 서브유닛과 공동 면역침강하지 않았다(보충 그림 XNUMX). 10a), 항체의 특이성을 뒷받침합니다. 항-JARID2, EZH2 또는 EED 항체는 NPC 핵 추출물에서 SNIP1 및 기타 PRC2 서브유닛을 공동 면역침전시켰지만 음성 대조군 RBBP5는 그렇지 않았습니다(도 XNUMXb). 5b~d). Anti-p300 또는 CBP 항체는 SNIP1을 공동 면역 침전시키지 못하여 NPC에서 물리적 상호 작용을 감지할 수 없음을 시사합니다. 10b, c). PRC2-SNIP1 결합은 PRC2가 SNIP1을 공동 면역 침전시키는 것으로 나타난 다른 프로테오믹스 연구에 의해 뒷받침됩니다.19,20.
기원 후 SNIP1과 PRC2 사이의 상호 작용을 조사하기 위해 WB가 뒤따르는 공동 면역 침전. (a) SNIP1, (b) JARID2, (c) EZH2, 또는 (d) EED는 NPC 핵 추출물에서 면역침전되었다. RBBP5는 음성 대조군이었다. 소스 데이터는 소스 데이터 파일로 제공됩니다. e NPC에서 SNIP1, SUZ12 및 EZH2가 풍부한 염색질 피크를 정렬하는 히트맵. IgG, EZH1 및 H2K3me27을 포함하는 SNIP3 CUT&RUN-reChIP의 피크는 SNIP1 결합 피크에 정렬되었습니다. 5개의 SNIP10 결합 피크의 양쪽에 있는 23,188kb 또는 1kb에 대한 강도가 표시됩니다. 어두운 색은 높은 강도를 나타내고 밝은 색은 낮은 강도를 나타냅니다. f IgG, EZH1 및 H2K3me27이 포함된 SNIP3 CUT&RUN–reChIP의 트랙은 IGV(Integrative Genomics Viewer)로 시각화됩니다. MCM7, Chr5: 138,169,717 - 138,173,621. 앤, Chr7: 78,894,526 - 78,898,271. Lhx8, Chr3: 154,325,066 - 154,334,835. 에옴스, Chr9: 118,474,178 - 118,480,775. g SNIP1, PRC2 및 H3K27me3/ac의 중간 결합 강도를 비교하는 프로파일 플롯 싹둑1네스- SNIP1 대상에서 KO 대 제어 NPC. SNIP1 수준이 감소했을 때 지역은 진정한 SNIP1 대상으로 간주되었습니다. 싹둑1네스-KO vs 컨트롤 NPC p <0.05. h, i 수준이 크게 감소한 SNIP1 및 SUZ12 바인딩 영역의 모티프 싹둑1네스-폴드 체인지가 >2인 KO NPC 및 p < 0.05. HOMER de novo 분석을 수행하였고 가장 낮은 XNUMX개의 모티프가 p-값과 척추동물 모티프가 일치하는 항목이 여기에 나열됩니다. j, k 차별적으로 발현된 유전자(FDR < 0.05)에 대한 결합이 보고된 전사 인자의 Volcano 플롯. Enrichr를 사용하여 ChIP-X 데이터베이스에서 ENCODE 및 ChEA 합의 TF에 대해 유전자를 검색했습니다.56. 어두운 색상은 더 작게 표시됩니다. p-가치 및 큰 포인트 전달 p-값 < 0.05. 굵게 표시된 전사 인자는 그림 5h, i의 CUT&RUN 모티프 분석에서 발견되었습니다.
SNIP1이 PRC2 하위 단위의 표현을 변경하는지 여부를 테스트했습니다. SNIP1 고갈이 낮아졌지만 Ezh2 전사 수준은 PRC2 서브유닛, H3K27me3 또는 H3K27ac의 단백질 수준을 변경하지 않았습니다. 10d–g). 다음으로 CUT&RUN을 수행하여 SUZ12와 EZH2를 프로파일링했습니다. 싹둑1네스-KO 및 제어 NPC(보충 그림. 10h–j). 공동 면역 침전 결과와 일치하게, SUZ12 및 EZH2는 게놈 전체에서 SNIP1 결합 표적 부위를 공동 점유합니다(그림 XNUMX). 5e). 염색질에서 PRC2–SNIP1 상호작용을 분석하기 위해 CUT&RUN-reChIP을 수행했습니다. 이 분석에서 SNIP1 CUT&RUN에 의해 방출된 염색질은 IgG, EZH2 또는 H3K27me3에 의해 면역 침전되었습니다. 대표 유전자좌 MCM7, 앤, Lhx8및 에옴스 EZH1 및 H2K3me27과 함께 SNIP3을 공동 점유했지만 음성 대조군 IgG는 없었습니다(도 XNUMXb). 5f). 게놈 전체에서 CUT&RUN-reChIP은 EZH2 및 H3K27me3이 SNIP1 결합 피크에서 SNIP2 및 PRC1와 높은 중첩을 가짐을 보여주었습니다(그림 XNUMX). 5e).
PRC1 염색질 점유에서 SNIP2의 역할을 조사한 결과 염색질에서 SUZ12, EZH2 및 H3K27me3의 수준이 싹둑1네스-KO(그림. 5g, 보충 그림. 10k, 11a). 대조적으로, H3K27ac 수준은 싹둑1네스-KO NPC(그림. 5g, 보충 그림. 10k, 11a). 다음으로 우리는 PRC1에 대한 SNIP2 고갈의 운동 효과를 분석하기 위해 시험 관내 분석을 사용했습니다. 대조 렌티바이러스와 비교하여, 렌티바이러스의 Cre 형질도입은 싹둑1[flox/flox] NPC는 1일과 70일에 각각 99.9%와 2%까지 SNIPXNUMX 전사를 고갈시켰습니다. 이것은 PRCXNUMX 구성 요소의 전사 수준을 변경하지 않았습니다(보충 그림 XNUMX). 11b). EZH2 및 SUZ12 CUT&RUN을 사용하여 SNIP2 고갈 1일째까지 염색질에서 PRCXNUMX의 강력한 감소를 관찰했습니다(보충 그림 XNUMX). 11c). 함께, 이러한 데이터는 PRC2가 염색질에 결합하기 위해 SNIP1이 필요함을 지원합니다.
SNIP1-PRC2 표적을 특성화하기 위해 HOMER 소프트웨어로 de novo 모티프 발견을 수행했습니다.55. 배수 변화 >2의 기준을 사용하고 p 제어 대 < 0.05 싹둑1네스-KO, SNIP1 표적은 E2F 단백질, SP1/3/4 및 EGR1의 모티프에서 풍부해졌다. 5h). 이전에 보고된 SNIP1 인터랙터, SMAD 단백질 및 RELA의 모티프도 SNIP1 표적 사이에서 발견되었습니다.21,26. 결합이 감소된 SUZ12 결합 피크에서 싹둑1네스-KO, 모티프는 SP2, RELA, E2F 단백질, EGR1, HINFP, PLAGL1 및 NF-Y 서브유닛으로 풍부해졌습니다(그림 XNUMX). 5i). SNIP1 및 SUZ12 결합 모티프의 유사성은 SNIP1 및 PRC2와 이러한 전사 인자 중 일부의 잠재적인 상호 작용을 가리킵니다.
다음으로 SNIP1 또는 SUZ12 결합 모티프가 차별적으로 발현되는 유전자에서 과도하게 표현되는지 여부를 조사했습니다. Enrichr 사용56, 우리는 상향 조절 된 유전자를 싹둑1네스-KO는 TP53, FLI1, SUZ12, MAX 및 MYC의 표적인 반면, 하향 조절된 유전자는 E2F4, SOX2, NFYB 및 NFYA의 표적이었습니다(그림 XNUMX). 5j,k). E2F 단백질은 모티프 및 Enrichr 분석 및 E2F4 표적에 의해 발견되었습니다. MCM7 과 Anp32e 결합이 감소된 SNIP1 및 PRC2 표적이었습니다. 싹둑1네스-KO(그림. 5k보충 그림. 11d). 상향조절된 유전자 중에서 싹둑1네스-KO, MYC 및 MAX 표적은 모티프 및 Enrichr 분석 모두에 의해 확인되었습니다(그림 XNUMX). 5j보충 그림. 11e). 이러한 데이터는 E2F 단백질, MYC 및 MAX가 유전자 조절을 위한 SNIP1-PRC2 활동에 영향을 미칠 수 있음을 시사합니다.
PRC2는 SNIP1이없는 경우 세포 사멸을 촉진합니다
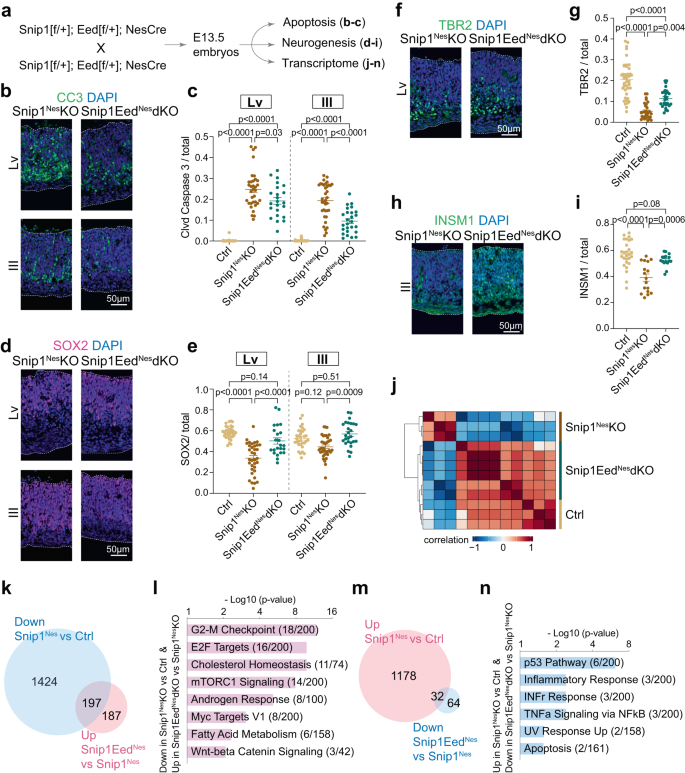
우리는 생체 내 NPC 생존에서 PRC2의 역할을 테스트했습니다. 우리는 사용했었다 네스::Cre에서 엑손 3-6을 제거합니다. 이드 (PRC2 코어 서브유닛) 생성 이드네스-KO와 싹둑1네스-이드네스-dKO(보충 그림. 12a, b). NPC의 EED 고갈은 이드네스-KO E13.5 뇌(보충 그림. 12c–g). 다른 사람들은 대조군에서 EED를 연구했고 이드Ex1-KO 등 종뇌 및 결론57 그것은 우리의 관찰과 달랐습니다. 이드네스-KO E13.5 뇌. 이 차이는 다음과 같은 표현으로 설명할 수 있습니다. Ex1::크레와 네스::다른 발달 단계와 뇌 영역의 Cre. Apoptosis는 다른 뇌 조절 영역에서 관찰되었으며 이드네스-KO 두뇌(보충 그림. 12c, d). EED는 이미 E14.5에서 신경 발생에 영향을 미치지만 E16.5에는 영향을 미치지 않는 것으로 나타났습니다.57, NPC 기능에 대한 EED/PRC2의 정확한 효과는 발달 단계 및 셀 상황에 따라 다릅니다. 우리의 분석은 싹둑1네스-KO, 싹둑1네스-이드네스-dKO는 cl-카스파제 3-양성 세포가 훨씬 더 적었습니다(도 XNUMXb). 6a-c), 더 많은 SOX2 양성 NPC(그림. 6d, e), 그리고 더 많은 TBR2- 또는 INSM1-양성 중간 선조(Fig. 6f–i). TUJ1 양성 미성숙 뉴런은 SNIP1-PRC2 기능적 상호 작용에 의해 현저하게 영향을 받지 않았다(보충 그림 XNUMX). 12시, 나). EED 고갈 싹둑1네스-KO 배아 뇌는 세포 사멸을 감소시키고 NPC와 중간 전구체를 구출했습니다. 따라서 SNIP1은 PRC2에 대응하여 발달 중인 뇌의 세포사멸을 억제합니다.
a 다운스트림 분석을 위한 SNIP1 및 EED를 모두 고갈시키는 유전적 교차의 개략도. b, c E3 뇌의 DAPI로 오버레이된 CC13.5의 IF 분석. 막대, 50μm. 각 데이터 포인트는 하나의 이미지를 나타냅니다. 여덟 제어 배아, 7 싹둑1네스-KO 배아, 및 5 싹둑1네스-이드네스-dKO 배아를 분석하였다. 측뇌실의 경우, n = 38개 이미지(대조군), n = 34 (싹둑1네스-KO), 그리고 n = 23 (싹둑1네스-이드네스-dKO). 제XNUMX뇌실의 경우, n = 38(대조군), n = 36 (싹둑1네스-KO), 그리고 n = 26 (싹둑1네스-이드네스-dKO). d–i NPC 마커 SOX2의 IF, E2 뇌의 DAPI로 오버레이된 중간 선조 마커 TBR1 및 INSM13.5. 막대, 50μm. (의 인구e) SOX2 양성, (g) TBR2-양성, 또는 (i) 측뇌실 및/또는 제1뇌실의 신경상피 내층에 있는 INSMXNUMX-양성 세포를 정량화하였다. 각 데이터 포인트는 하나의 이미지를 나타냅니다. 안에 (g), n = 43개 이미지(대조군), n = 30 (싹둑1네스-KO), 그리고 n = 29 (싹둑1네스-이드네스-dKO). 안에 (i), n = 27(대조군), n = 17 (싹둑1네스-KO), 그리고 n = 16 (싹둑1네스-이드네스-dKO). 패널용 c, e, g및 i, 데이터는 평균 ± SEM으로 표시되고 양방향 ANOVA는 통계 분석에 사용되었습니다. j 컨트롤에서 RNA-seq 데이터의 감독되지 않은 클러스터링(n = 3), 싹둑1네스-KO (n = 3), 싹둑1네스-이드네스-dKO(n = 6) E13.5의 뇌. 전뇌 및 중뇌 영역의 RNA를 시퀀싱하고 다운스트림 분석을 위해 병합했습니다. 파란색은 음의 상관관계를 나타내고 빨간색은 양의 상관관계를 나타냅니다. k, m FDR이 0.05 미만인 차별적으로 발현된 유전자의 수를 표시하는 벤 다이어그램. 하향 조절된 유전자 목록 싹둑1네스-KO 대 대조군 및 상향 조절된 유전자 싹둑1네스-이드네스-dKO 대. 싹둑1네스-KO는 (k). 상향조절된 유전자 목록 싹둑1네스-KO 대 대조군 및 하향 조절된 유전자 싹둑1네스-이드네스-dKO 대. 싹둑1네스-KO는 (m). l, n 그림 XNUMX에 해당하는 구조된 유전자의 유전자 온톨로지. 6천,미터. 유전자는 Enrichr를 사용하여 MSigDB(Molecular Signatures Database) Hallmark 2020에 대해 검색되었습니다.56. 소스 데이터는 소스 데이터 파일(c, e, g, i, l, n).
우리는 제어의 transcriptomes를 프로파일링했습니다. 싹둑1네스-KO, 그리고 싹둑1네스-이드네스-dKO 뇌 조직. 가장 차등적으로 발현된 상위 3,000개 유전자(중앙값 변동 값 기반)를 기반으로 한 감독되지 않은 클러스터링은 대조군과 싹둑1네스-이드네스-dKO와 비교 싹둑1네스-KO(도. 6j). 폴드 체인지 >2 사용 및 p < 0.05에서 데이터 세트 비교 싹둑1네스- KO 과 싹둑1네스-이드네스-dKO, 우리는 184개의 상향 조절된 유전자와 994개의 하향 조절된 유전자를 확인했습니다. 싹둑1네스-이드네스-dKO(보충 그림. 13a).
NPC 및 중간 선조의 구조에 대한 잠재적인 분자 설명을 제공하기 위해 싹둑1네스-이드네스-dKO, 대조군 중에서 차별적으로 발현되는 유전자를 분석하였고, 싹둑1네스-이드네스-dKO 및 싹둑1네스- KO. 우리는 197개의 하향 조절된 유전자를 발견했습니다. 싹둑1네스-KO 부분적으로 표정 회복 싹둑1네스-이드네스-dKO(그림. 6k). 이렇게 구조된 유전자는 G2/M 체크포인트, E2F 표적, 콜레스테롤 항상성, mTORC1 신호 및 안드로겐 반응에 관여합니다(그림 XNUMX). 6l). 대조적으로, 32개의 상향 조절된 유전자는 싹둑1네스- KO 에서 하향 조정되었다 싹둑1네스-이드네스- KO (무화과. 6m) p53 경로, 염증 및 인터페론 감마 반응, NFκB 신호 및 세포 사멸에 관여합니다(그림 XNUMX). 6n). 이 32개의 유전자 중 Cdkn1a H3K27me3 수준이 유의하게 낮은 유일한 내인성 세포 사멸 유전자 싹둑1네스- KO 대조군(FDR < 0.05; 보충 그림 13b), SNIP1이 PRC2 및 H3K27me3을 Cdkn1a 현장. SNIP1-PRC2 게놈 점유에 대한 우리의 프로파일링은 SNIP1이 E3F 표적을 포함하는 유전자좌에서 H27K3me2 침착을 억제함을 시사합니다(보충 그림 XNUMX). 11d) 그러나 세포 사멸 유전자를 포함하는 다른 유전자좌에서 H3K27me3 침착을 촉진합니다. Cdkn1a, Nkx2-9, Etv4, pxdc1및 탭1 (보충 그림. 13b, c). 종합하면, SNIP1은 H3K27me3 침착 및 유전자 발현의 유전자좌 의존적 제어를 발휘하여 발달 중인 뇌에서 NPC 분열, 세포사멸 및 분화의 균형을 이룹니다.
- SEO 기반 콘텐츠 및 PR 배포. 오늘 증폭하십시오.
- PlatoData.Network 수직 생성 Ai. 자신에게 권한을 부여하십시오. 여기에서 액세스하십시오.
- PlatoAiStream. 웹3 인텔리전스. 지식 증폭. 여기에서 액세스하십시오.
- 플라톤ESG. 자동차 / EV, 탄소, 클린테크, 에너지, 환경, 태양광, 폐기물 관리. 여기에서 액세스하십시오.
- BlockOffsets. 환경 오프셋 소유권 현대화. 여기에서 액세스하십시오.
- 출처: https://www.nature.com/articles/s41467-023-40487-4