생물막 특성
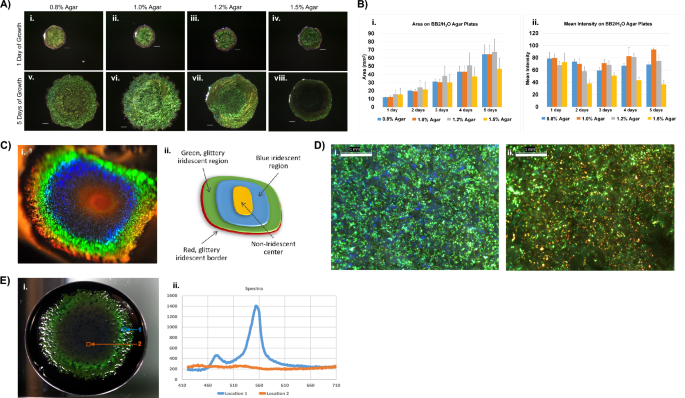
셀룰로파가 라이티카 BB7489/H에서 24시간 동안 성장한 2개의 생물막2다양한 한천 농도를 포함하는 O 배지를 비교하였다(도 XNUMX). 1A, B). 색상 패턴은 5일 후 더 밝은 콜로니를 지원하는 1.0% 한천으로 달라졌습니다. 1.2% 이상의 한천을 포함하는 배양 배지는 성장을 허용했지만, 콜로니의 확산은 1% 이하의 한천을 포함하는 배지에 비해 제한적이었습니다. 1.5% 한천의 생물막은 평균 픽셀 강도가 낮을수록 더 작았습니다. 특별히 언급하지 않는 한, 이 연구의 나머지 데이터는 BB1/H를 포함하는 2% 한천 플레이트의 생물막을 기반으로 합니다.2O. 1% 한천에서 계속 배양하면 동심원의 그라데이션 착색을 갖는 생물막이 생성됩니다(그림 XNUMX). 1씨). 이 영역의 상대적인 크기와 강도는 샘플마다 다르지만 성숙한 생물막의 착색 순서는 변하지 않았습니다. 또한, 생물막 중심은 종종 황금빛 오렌지색으로 변했는데, 아마도 여기에 존재하는 것으로 알려진 색소 제아잔틴 때문일 것입니다. C. 리티카29. 방사형으로 바깥쪽으로 진행하면서 다음 색상 밴드는 파란색이었고 그 다음에는 반짝이는 녹색이 이어졌으며 생물막 주변에는 좁은 빨간색 밴드가 나타났습니다. 배율은 색상이 이러한 밀리미터 영역에서 우세한 색상이 인지된 거시적 색상을 결정하는 모자이크임을 밝혔습니다(그림 XNUMX). 1디). 중요한 것은 모자이크가 다음의 잠재력을 보여준다는 것입니다. C. 리티카 다양한 색상을 반영하는 생물막.
특정 성장 조건을 고려할 때, C. 리티카 7489는 이전에 색상이 없는 것으로 보고되었지만 강렬한 무지개 빛깔의 생물막을 만듭니다. (A) 대표 C. 리티카 7489개의 생물막이 BB27/H에서 2°C로 성장했습니다.2O 0.8%, 1.0%, 1.2% 또는 1.5% 한천을 포함하는 한천 플레이트. 생물막은 5일 동안 매일 이미지화되었습니다. 한천 농도는 DSM 7489의 채도 및 확장에 영향을 미칩니다. C. 리티카 생물막. 축척 막대 = 1mm. (B) A에서 생물막의 면적(i) 및 평균 강도(ii) 측정은 ImageJ를 사용하여 매일 기록되었습니다. 데이터는 표준 편차가 ±오차로 표시된 각 시점에 대한 평균으로 표시됩니다(각 시점에 대해 n = 10). (C) C. 리티카 7489는 비스듬한 시야각(i)과 동심원 색상(ii)을 보여주는 개략도에서 획득한 생물막의 이 사진에 표시된 것처럼 다양한 범위의 강렬한 색상을 생성할 수 있습니다. (D) 거시적으로 녹색(i) 및 적색(ii)으로 나타나는 생물막 영역이 점묘 색상의 모자이크임을 보여주는 광학 이미지. (바 = 1mm) (E) 대표적인 하이퍼스펙트럼 데이터 큐브는 성숙한 생물막에서 신호 강도의 지역별 변화를 나타냅니다. (i) 검정 잉크를 함유한 영양 한천 상의 10cm 페트리 접시에서 생물막을 성장시켰다. 검출기는 생물막 표면에 수직입니다. 그 위치는 생물막에 비해 반사 강도가 감소하는 이유입니다 (C-나). 생물막의 외부 영역은 생물막을 통해 건설적이고 일관된 반사를 제안하는 550nm 부근을 중심으로 하는 특히 날카로운 피크를 생성합니다. (ii, 위치 1) 반대로 중앙 영역의 반사는 기준선 근처에 남아 있습니다. (ii, 위치 2)
Resonon 벤치탑 하이퍼스펙트럼 시스템을 사용하여 생체의 대량 광학 반응을 나타내는 데이터 큐브를 생성했습니다. C. 리티카 생물막(Fig. 1이자형). 가시 범위에 걸쳐 있는 스펙트럼이 수집되었고 550 nm 근처에서 증가된 강도를 보여줍니다. 날카로운 피크는 생물막을 통해 건설적이고 일관된 반사가 발생함을 시사합니다. 대조적으로 생물막의 중심과 관련된 강도는 기준선 수준에 가깝게 유지됩니다. 다른 실험에서는 후방 산란 기하학과 가변 여기 각도를 사용하여 감지 각도에 대한 의존성을 설정했습니다(보충 그림 XNUMX). 1).
내부의 세포 배열, 포장 및 형태 C. 리티카 7489 생물막
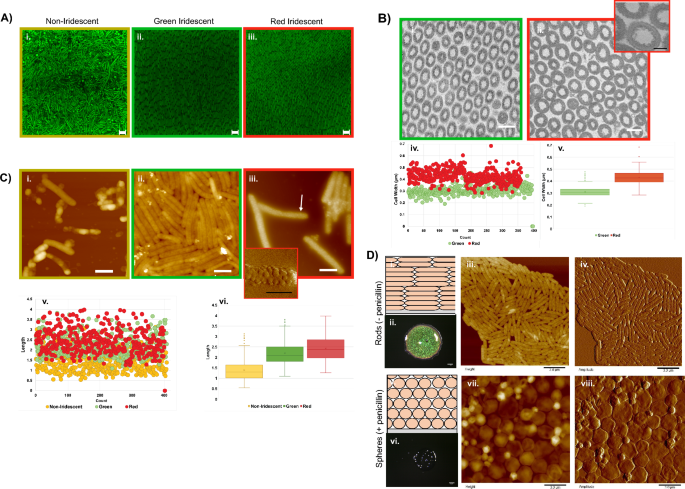
이전 연구 플라 보 박테 리움 생물막은 세포 간격과 형태가 반사 파장에 영향을 미친다는 것을 밝혔습니다.21,30. 색의 차이를 이해하기 위해 C. 리티카 7489 생물막, 보완적인 현미경 기술이 적용되었습니다. 배열 C. 리티카 SYTO9로 염색된 고정된 생물막의 공초점 현미경을 사용하여 생물막 내에서 가시화되었습니다(그림 XNUMX). 2ㅏ). 무지갯빛과 관련되지 않은 생물막 영역에는 정렬된 세포의 작은 클러스터도 관찰되었지만 무작위로 정렬된 세포가 포함되어 있습니다. 이 영역에도 존재하는 구형 구조는 이미징 평면이 기판에 접근함에 따라 수가 증가했습니다(보충 그림 XNUMX). 2ㅏ). 대조적으로, 녹색 무지개 빛깔 영역 이미지의 고속 푸리에 변환(FFT)에서 확인된 바와 같이 무지개 빛깔 영역의 세포는 밀집되어 평면의 다결정질 층으로 정렬되었습니다(보충 그림 XNUMX). 2비). 셀 방향의 변화로 표시되는 결정립계와 함께 수십 미크론에 걸쳐 정렬이 지속되었습니다.
생물막 세포의 현미경. (A) SYTO9로 염색된 생물막의 공초점 이미지는 무지개 빛깔이 아닌(i)과 무지개 빛깔의 영역(ii, iii) 사이에서 세포 조직이 다르다는 것을 보여줍니다(bar = 2.0 μm). (B) 녹색(i) 및 적색 영역(ii)의 투과 전자 현미경(TEM) 단면 이미지. (bar = 0.5 µm) 세포벽을 둘러싼 작은 돌출부를 보여주는 삽입 그림(iii)(bar = 200 nm). 너비 측정값(iv, v)도 지역에 따라 다릅니다. (C) 무지개 빛깔이 아닌(i), 녹색 무지개 빛깔(ii) 및 빨간색 무지개 빛깔(iii) 영역의 AFM(Atomic Force Microscopy) 높이 이미지는 뚜렷한 세포 형태가 각 영역과 연관되어 있음을 보여줍니다(막대 = 1.0 μm). 삽입(iv)은 화살표로 표시된 영역의 AFM 진폭 이미지입니다(bar = 0.5 µm). 지정된 생물막 영역(v, vi)의 길이 측정. (D) BB2/H의 주변 조건에서 성장한 2일 된 생물막2O 한천(광학 눈금 막대 = 1mm, AFM 막대 = 3µm). 무지개 빛깔의 생물막 (i)에서 세포의 전형적인 배열을 보여주는 개략도. 무지개 빛깔 생물막의 광학 이미지. (ii) 전형적인 막대 모양 형태를 보여주는 무지개 빛깔의 생물막에서 세포의 AFM 높이(iii) 및 진폭(iv) 이미지. 치명적인 수준의 페니실린을 첨가했을 때 성장한 생물막에서 예상되는 세포 배열을 보여주는 개략도(v). 치명적이지 않은 페니실린이 구조적 착색을 방해함을 보여주는 생물막의 광학 이미지. (vi) 세포의 AFM 높이(vii) 및 진폭(viii) 이미지는 페니실린 처리로 인한 구체로의 변환을 확인합니다.
진핵생물은 연구 중에 처리 및 조작할 수 있는 조직의 무지개빛에 기여하는 구성 요소를 포함합니다. C. 리티카 그러나 무지갯빛은 과도한 수화로 인한 난류를 포함하여 기계적 교란에 의해 쉽게 분리되는 독립적이고 느슨하게 연결된 세포에서 파생됩니다. 글루타르알데히드로 세포를 가교시키면 무지개빛이 보존되고 투과 전자 현미경(TEM)에 의한 특성화를 위해 한천에서 손상되지 않은 생물막을 제거할 수 있습니다. 고정 단면 전자현미경 사진 C. 리티카 7489개의 생물막은 무지개 빛깔의 영역에서 주기성을 확인했습니다(그림 XNUMX). 2비). 녹색 및 적색 영역의 세포는 각각 310nm 및 428nm의 평균 폭을 가지며, 이는 세포 폭의 변화가 색상 변화에 기여했음을 나타냅니다. 또한 적색 영역의 세포에 대한 더 높은 배율의 TEM 이미지는 세포벽을 둘러싼 작은 돌출부를 나타냅니다(그림 XNUMX). 2나-iii). 주사 전자 현미경(SEM)을 사용하여 획득한 생물막의 측면 이미지는 15~60μm 범위의 생물막의 전체 두께를 통해 정렬이 발생함을 보여줍니다(보충 그림 XNUMX). 2기음).
TEM 데이터에서 관찰된 폭의 차이와 생물막의 특정 영역과의 연관성을 고려하여 원자력 현미경(AFM)을 사용하여 세포의 형태를 비교하고자 했습니다(그림 XNUMX). 2씨). 무지개 빛깔이 아닌 영역의 세포는 불규칙하고 구형 돌출부와 관련이 있으며 종종 수축된 것처럼 보입니다. 대조적으로, 건강한 막대 모양의 박테리아에서 예상되는 바와 같이 적색 및 녹색 무지개 빛깔 영역의 세포는 규칙적인 형태와 크기를 유지했습니다. 응집체를 파괴하려는 반복적인 시도에도 불구하고, 녹색 무지갯빛 영역의 세포는 밀접하게 결합된 상태를 유지했으며, 이는 세포 표면 특성도 영역에 따라 다양함을 나타냅니다(그림 XNUMX). 2다-ii). 대조적으로, 적색 영역의 세포는 종종 막 소포로 덮여 있었다(도 XNUMX 및 도 XNUMX). 2C-iii 및 iv 및 보충 그림. 3). 다음을 포함한 그람 음성 박테리아 C. 리티카 외막 소포를 생성하는 것으로 알려져 있습니다.31,32. 그러나 소포에 의한 완전한 표면 커버리지는 놀라웠습니다. 더 잘 정의된 AFM 이미지는 TEM 단면에서 관찰된 막 돌출부가 소포임을 시사했습니다. 서로 다른 영역의 세포 길이를 비교한 결과 무지개 빛깔이 아닌 세포가 평균 값이 각각 1.39 μm, 2.20 μm 및 2.42 μm인 녹색 또는 빨간색 영역의 세포보다 짧다는 것이 밝혀졌습니다(그림 XNUMX). 2이력서, vi). 종합하면 이미징 데이터는 생물막 내의 세포 위치에 따라 뚜렷한 크기와 표면 토폴로지를 나타냅니다.
그람 음성 박테리아의 펩티도글리칸은 세포의 기계적 안정성을 제공하는 새장 모양의 폴리머입니다. 세포질 막과 외막 사이에 위치하며 그 모양이 박테리아의 형태를 결정합니다. 리소자임 및 베타 락탐 항생제는 펩티도글리칸을 파괴하여 세포 용해를 일으키는 것으로 널리 알려져 있습니다. 그러나 준 치사량에서는 다음을 포함한 그람 음성 박테리아가 E. 대장균 치료에서 살아남지만 막대에서 구체로 변환됩니다.33,34,35. 착색에 손상되지 않은 펩티도글리칸이 필요한지 여부를 확인하기 위해 30µg/mL 페니실린을 한천 플레이트에 첨가한 후 다음과 같이 접종했습니다. C. 리티카 (무화과. 2디). 48시간 후, 처리된 생물막은 C. 리티카 무지개 빛깔에 대한 펩티도글리칸의 중요성을 나타내는 구체로. 이러한 결과는 또한 외인성 모양 수정 시약이 생물막 광학 특성에 영향을 미치는 데 사용될 수 있음을 보여주었습니다.
제조용 생물막의 확장성 및 조정 가능성
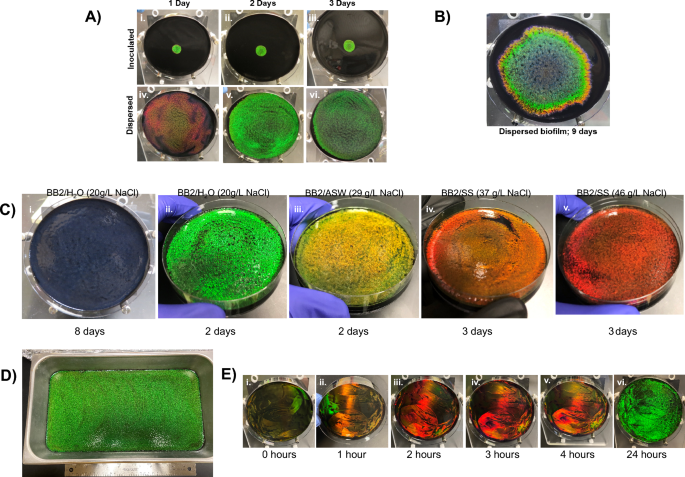
셀룰로파가 라이티카 생물막은 접종 지점에서 방사형으로 확장되고 줄무늬 색상을 나타냅니다(그림 XNUMX). 1ㅏ). 이러한 패터닝은 세포 성장 동안 국소 환경(예: 영양소 가용성, pH, 대사 산물 등)의 변화에 의해 유도된 세포 형태의 시간적 차이의 결과일 가능성이 높습니다. 단색 생물막은 일관된 형태를 나타내기 때문에 한천 표면 전체에 한 번에 충분한 세포를 추가하면 모든 세포가 동시에 동일한 환경에 노출되고 반사된 색상이 동기화될 것이라고 추론했습니다. 이 가설은 동일한 부피의 접종물이 셀 스프레더를 사용하여 한천에 분산된 생물막과 국소화된 100µL 접종물로 시작된 생물막을 비교하여 테스트되었습니다. (무화과. 3A) 대표 사진은 주변 조건에서 성장 1일 후, 접종된 생물막이 플레이트 중앙 주위에 밝은 녹색 무지개빛을 반사하는 반면 분산된 생물막은 플레이트 표면에 걸쳐 확산적으로 빨간색임을 보여줍니다. 성장 2일 후, 분산된 생물막이 한천의 전체 표면을 덮었지만 두 제제 모두 밝은 녹색 무지개빛을 나타냈습니다. 분산된 생물막의 무지개빛은 3일 후에 상당히 약해졌습니다. 추가 시간이 지나면 접종된 생물막이 확장되어 대부분의 한천 표면을 덮습니다(그림 XNUMX). 3비). 따라서 세포를 분산시키면 최적의 무지개 빛을 내는 시간이 단축되고 정렬된 단색 박테리아로 덮인 플레이트 영역이 확장됩니다.
이후 Kientz et al. 염분이 CECT 8139 생물막의 착색에 영향을 미친다는 것을 보여주었고, DSM 7489 생물막은 유사하게 테스트되었습니다.27 (무화과. 3씨). 매체는 Instant Ocean(BB2/ASW) 또는 Lake Products Sea Salt ASTM D1141-98(BB2/SS) 바다 소금 아날로그로 보강되었습니다. BB2/H에 분산된 생물막과 비교2O, BB2/ASW 및 BB2/SS에서의 성장은 배지에 추가된 해염 유사체의 양과 상관관계가 있는 적색 이동과 함께 거의 단색의 콜로니를 생성했습니다. 유사체는 주로 NaCl 농도가 다르다는 점을 감안하여 NaCl 농도를 높이는 것이 BB2/H에서 생물막을 성장시켜 적색 편이 색상을 생성하기에 충분한지 여부를 테스트했습니다.2다양한 양의 NaCl이 보충된 O 플레이트(보충 그림 XNUMX) 4ㅏ). 국소화된 플레이트에서 NaCl의 농도가 증가하면 적색 이동 색상이 생겨 생물막의 특성을 외인성으로 조작할 수 있습니다. 그림에 표시된 밴드는 1 반영 범위 에 의해 생성될 수 있는 색상의 C. 리티카 생물막. 여기서 우리는 BB2/H의 초기 색상인 빨간색을 보여줍니다.2O한천배지는 생육배지의 염도를 증가시켜 생성한 반면, 청색은 생육기간을 연장하여 생성하였다. 종합하면 착색의 시간적 측면은 지역 환경에 대한 세포 반응에서 파생된다는 결론을 내립니다.
단색 생물막. (A) 주변 온도에서 접종된(i-iii) 생물막과 분산된(iv-vi) 생물막의 비교. 분산된 생물막은 단색으로 최고조에 달하고 2일(v)에 플레이트를 채웁니다. (B) 반면, 접종된 생물막은 줄무늬 착색을 일으키고 표면을 덮는 데 훨씬 더 많은 시간이 필요합니다. (C) 흩어짐을 보여주는 사진 C. 리티카 세포는 아마도 모든 세포를 균일한 성장 조건(영양소, 대사 산물 등)에 동시에 노출시킴으로써 다양한 색상의 단색 생물막을 생성합니다. 해수 모사물을 사용하여 성장 기간(i)을 연장하거나 매체 염도(ii – v)를 변경하여 색상 범위에 액세스할 수 있습니다. 괄호 안에 주어진 레시피에서 효과적인 NaCl. 표시된 시간 동안 주변 조건에서 플레이트를 성장시켰습니다. (D) 3 x 41cm 팬의 표면에 비례 접종물을 분산시켜 주변 조건에서 23일 만에 큰 녹색 생물막을 생성했습니다. (E) 50배 농축된 배양물의 순차적 적용 및 분산은 단색 생물막 형성을 24시간 이하로 감소시켜 세포가 즉시 조직화되기 시작하고 세포 밀도가 산업 제조 응용 분야에서 중요한 고려 사항이 될 것임을 시사합니다. 세포 적용 사이에 플레이트를 27°C에서 배양했습니다. 보충 그림에 표시된 추가 시험 4E, F.
41cm × 23cm 한천 표면에 비례적으로 더 큰 접종물을 분산시키면 실온에서 3일 동안 배양한 후 표면을 채우는 단색 생물막이 생성되는 반면, 국부적인 접종물은 제한된 무지개 빛깔의 영역을 만들었습니다(그림 XNUMX 및 XNUMX). 3D, 보충 4비). 대면적 단색 생물막을 생성하는 시간을 더 줄이기 위해 접종원의 세포를 늘리면 무지개 빛깔이 빨라지는지 여부를 테스트했습니다. 구체적으로, 세포를 한천에 분산시키기 전에 밤새 배양액을 농축시켰다. 무지갯빛이 나타나는 속도는 표면에 분산된 접종물의 배수 농도와 상관관계가 있습니다(보충 그림 XNUMX). 4씨). 레이어링 전략은 50배 농축된 세포가 한천 플레이트에 연속적으로 적용되는 무지개 빛깔의 형성을 더욱 가속화했습니다(그림 XNUMX 및 XNUMX). 3E, 보충 그림. 4E, 4F, 5, 6) 특히, 생생한 노란색과 빨간색 반사가 초기에 나타났으며, 접종된 플레이트 주변에 빨간색이 일시적으로 나타난 다음 녹색이 나타나는 접종된 생물막의 착색 순서와 일치합니다. 24시간에 전체 플레이트가 녹색으로 반사되었습니다. 함께, 이 결과는 세포가 광자 구조로 빠르게 조직화할 수 있고 세포 수가 무지개 빛깔의 생물막 형성에 대한 제한 요소임을 보여줍니다.
생물막을 재료에 통합
정성 여과지(Whatman, Grade 2), 폴리에스터 트랙 에칭 막(Sterlitech), 면직물 및 영양 한천 위의 실크를 포함하는 다공성 기질에서의 성장을 테스트했습니다. 배지 보유 및 영양분 확산은 이러한 기질에서 생물막 성장 및 확장을 허용했습니다. 중요한 것은 반사된 색상 패턴이 한천 플레이트에서 직접 성장한 생물막의 색상 패턴과 유사하다는 것입니다(그림 XNUMX). 4). 테스트된 기질 중에서 무지개 빛깔 생물막의 품질, 낮은 기질 비용 및 유연성으로 인해 추가 연구를 위해 여과지를 선택했습니다. 성장 후, 무지개 빛깔을 보존하기 위해 고정을 위해 종이 관련 생물막(PAB)을 글루타르알데히드를 포함하는 한천으로 옮겼습니다. 이 종이는 특성화 및 후속 처리 중에 생물막의 취급을 용이하게 했습니다. PAB의 무지개 빛깔은 건조 후 소실되었지만 물을 첨가하면 빠르게 회복되었습니다(그림 4C). PAB는 무지개 빛깔의 손실을 최소화하면서 건조 및 재수화의 여러 주기를 견뎌냈습니다. 고정된 종이 생물막의 AFM 이미징은 세포의 결정질 배열을 확인했습니다(보충 그림 XNUMX). 7B).
종이를 포함한 다공성 기판에서 무지개 빛깔 생물막의 주변 성장은 특성화 및 다운스트림 처리를 위한 처리를 용이하게 합니다. (A) C. 리티카 생물막은 다양한 다공성 기판의 주변 조건에서 성장했습니다. (B) 영양소 한천 위에 놓인 Whatman 2 여과지는 여러 다공성 기질 중 하나입니다. C. 리티카 무지개 빛깔의 식민지를 형성합니다. 한천 플레이트에서와 같이 살아있는 종이 관련 생물막(PAB)은 BB3/H 위에서 2일 동안 성장한 후 녹색입니다.2O 한천(Ai) 및 BB2/SS(A-ii)에서와 같이 염도가 증가하면 적색 편이. (C) PAB는 한천에서 제거하고 글루타르알데히드(Bi)로 고정한 후에도 무지개 빛깔을 유지합니다. 고정된 PAB를 질소로 건조하면 무지갯빛을 잃습니다(B-ii). 그러나 구조적 색상은 재수화 시 복원됩니다(B-iii). (D) 살아있는 PAB는 환경 단서에 반응하는 능력을 유지합니다. BB2/H의 PAB2O 한천은 반사가 빨간색으로 이동하는 BB2/SS 플레이트로 이동할 때까지 대부분 녹색을 반사합니다(각각 Ci 및 C-ii). 마찬가지로, BB2/SS 한천 플레이트에서 생성된 PAB는 빨간색이지만 BB2/H에 놓이면 녹색으로 바뀝니다.2O(각각 C-iv 및 Cv). 두 경우 모두 생물막은 원래 배지 조건(C-iii 및 C-vi)으로 돌아갈 때 원래 색상으로 되돌아갈 수 있습니다. 고정 생물막은 이러한 동적 행동을 나타내지 않습니다(C-vii 및 C-viii).
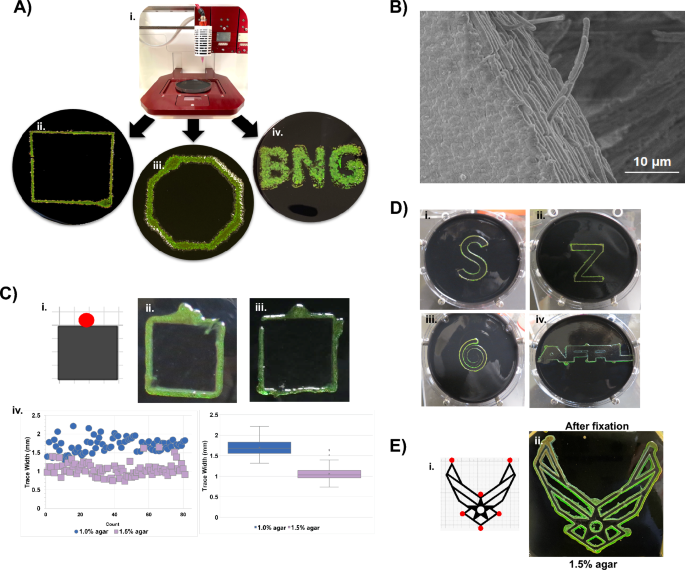
C. 리티카 무지개 빛깔의 bioink로 사용할 수 있습니다. (A) 포함하는 3D 인쇄 디자인 C. 리티카 Allevi 3 Bioprinter 설정(Ai에서 A-iv)을 사용하여 한천에서 생성되었습니다. 이전에 분산된 생물막에 대해 나타난 바와 같이, 증가된 염분 적색 이동은 C. 리티카 잉크의 반사. (보충 그림. 9()B) 인쇄된 생물막의 정렬된 세포를 보여주는 3D 인쇄된 생물막 가장자리의 SEM 이미지. (C, D) C. 리티카 종이 템플릿의 가장자리를 추적합니다(예: Ci의 회로도). 템플릿 디자인의 빨간색 원은 접종 부위를 나타냅니다. 세포는 주변 조건에서 다양한 패턴을 작성하기 위해 자가 인쇄 바이오잉크처럼 작동합니다. (B)한천 농도를 1.0%(C-ii)에서 1.5%(C-iii)로 늘리면 키엔스 측정(C-iv)에서 밝혀진 대로 추적의 폭이 줄어듭니다. 이 결과는 글라이딩 운동성이 더 높은 농도의 한천에서 템플릿에 더 가까운 세포를 제한하는 방식으로 조절됨을 시사합니다. (D) 추가 추적은 BACTracing이 다양한 복잡성, 각도 및 연결의 모양과 함께 사용될 수 있음을 보여줍니다. Agar 농도는 Air Force Symbol과 같은 복잡한 패턴의 경우와 같이 형상 사이의 거리가 작을 때 트레이스를 제한하는 데 사용할 수 있습니다(보충 그림 XNUMX). 6씨). (E) 무지개 빛깔의 패턴이 보존될 수 있음을 보여주는 고정 후 복잡한 패턴(i) 및 해당 BACTraced 상대(ii)의 템플릿.
살아있는 PAB(고정 없이)는 환경 단서에 반응하는 능력을 유지했습니다. 예를 들어 BB2/H의 PAB2O 한천 플레이트는 BB2/SS 플레이트로 이동될 때까지 대부분 녹색으로 반사되어 반사가 빨간색으로 이동하고 그 반대도 마찬가지입니다(그림 XNUMX). 4디). 두 경우 모두 생물막은 원래 배지 상태로 돌아갔을 때 원래 색상으로 되돌아갔습니다(보충 그림 XNUMX). 8ㅏ). 이러한 복귀는 세포를 글루타르알데히드로 고정했을 때 발생하지 않았으며, 이는 색상 변화를 감지하고 반응하는 살아있는 세포의 능력이 필요함을 확인했습니다. 국소화되고 분산된 생물막과 마찬가지로 페니실린 및 리소자임과 같은 외인성 시약은 종이 기질을 통해 생물막에 전달되어 생물막 특성을 제어할 수 있습니다(보충 그림 XNUMX). 8B).
셀룰로파가 라이티카 무지개 빛깔의 잉크로서의 생물막
기반으로 정렬된 세균 잉크 개발 모색 C. 리티카, Allevi 3™ 바이오프린터를 사용하여 사전 프로그래밍된 패턴으로 세포를 증착하고 Google SketchUp을 사용하여 모양에서 문자에 이르는 STL 디자인 파일을 생성했습니다. 인쇄된 배양은 BB2/H에서 원하는 패턴을 유지했습니다.227°C에서 배양 및 성장 후 O 플레이트(그림 XNUMX) 5ㅏ). 패턴은 또한 염분이 증가하면 다시 빨간색으로 색상이 이동되는 BB2/ASW 한천 플레이트에 인쇄되었습니다. (보충 그림. 9A) 가교된 생물막의 후속 SEM 이미지는 박테리아가 밀집되어 인쇄된 모양으로 배열되어 있음을 보여주었습니다(그림 XNUMX). 5B).
무지개 빛깔의 생물막을 생성하려면 박테리오데테스의 운동성이 필요합니다.20,30. 이 연구의 공초점 이미지는 인터페이스 상호 작용과 결합된 한천 표면에서 세포의 방향성 흐름으로 인해 발생할 가능성이 있는 세포 간의 정렬을 보여줍니다. 우리는 미끄러지는 세포의 경로에 있는 장애물이 세포 흐름의 방향을 바꿀 것이고 이러한 방해적인 조종이 일종의 "자가 인쇄" 박테리아 잉크를 초래할 수 있다는 가설을 세웠습니다. 이 아이디어를 테스트하기 위해 종이 템플릿을 영양 한천 플레이트에 놓고 종이에 인접한 접종물을 추가했습니다(그림 XNUMX 및 XNUMX). 5C, 보충 그림 9B) 배양하는 동안 세포는 박테리아 자율 집단 추적(일명 "BACTracing")이라고 하는 프로세스를 통해 템플릿 가장자리를 따라 무지개 빛깔의 흔적을 생성했습니다. BACTracing은 1% 및 1.5% 한천 플레이트 모두에서 발생했지만 한천 농도가 높을수록 트레이스가 더 좁아졌습니다. 온도는 또한 BACTracing으로 생성된 패턴의 품질에 영향을 미칩니다(보충 그림 XNUMX). 10). 적은 수의 접종 부위를 사용하여 점점 더 복잡한 패턴이 인쇄되었으며 BACTracing이 생체 재료의 고급 인쇄를 위한 손쉬운 접근 방식이 될 수 있음을 시사합니다(그림 XNUMX). 5이자형).
- SEO 기반 콘텐츠 및 PR 배포. 오늘 증폭하십시오.
- PlatoData.Network 수직 생성 Ai. 자신에게 권한을 부여하십시오. 여기에서 액세스하십시오.
- PlatoAiStream. 웹3 인텔리전스. 지식 증폭. 여기에서 액세스하십시오.
- 플라톤ESG. 자동차 / EV, 탄소, 클린테크, 에너지, 환경, 태양광, 폐기물 관리. 여기에서 액세스하십시오.
- PlatoHealth. 생명 공학 및 임상 시험 인텔리전스. 여기에서 액세스하십시오.
- 차트프라임. ChartPrime으로 트레이딩 게임을 향상시키십시오. 여기에서 액세스하십시오.
- BlockOffsets. 환경 오프셋 소유권 현대화. 여기에서 액세스하십시오.
- 출처: https://www.nature.com/articles/s41598-023-38797-0