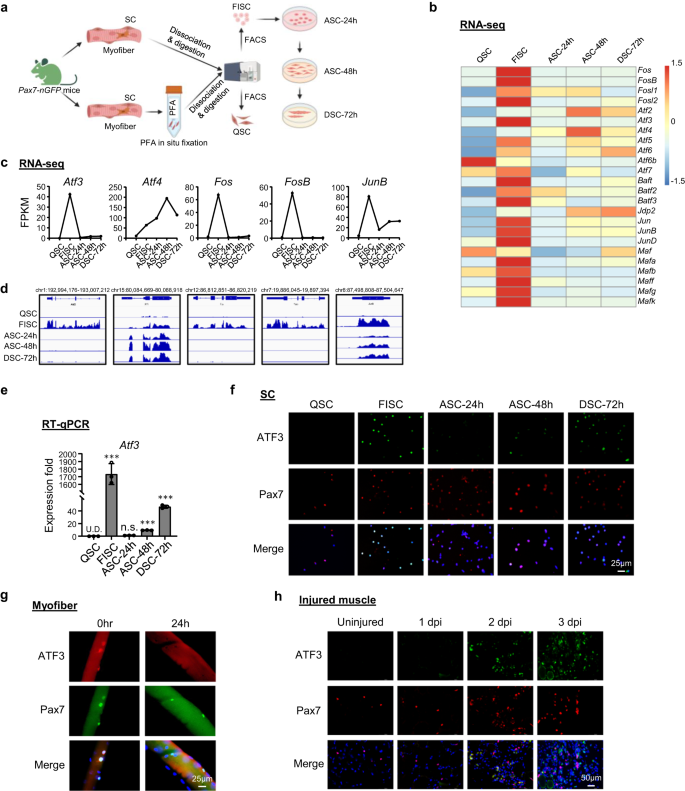
ATF3은 SC 초기 활성화 동안 신속하고 일시적으로 유도됩니다.
SC 정지에서 활성화로의 전환을 관리하는 전사 규제 이벤트를 탐색하기 위해 이전에 발표된 전사체 프로파일링 데이터 세트를 다시 분석했습니다.36 계보 진행 과정에서 SC로부터 획득합니다. 간단히 말해서 근육의 Pax7-nGFP 생쥐37 표준 3시간 동안 세포 해리 및 분리 과정을 거치고 FACS 분류를 거쳐 QSC를 얻기 전에 PFA에 의해 현장에서 고정되었습니다.13또는 새로 분리된 초기 활성화 SC(FISC)를 얻기 위해 사전 고정 없이(그림 XNUMX) 1a 및 보충 그림 1a); FISC는 완전히 활성화된(ASC-24h), 증식하는(ASC-48h) 또는 분화하는(DSC-72h) 세포를 얻기 위해 24, 48 또는 72시간 동안 시험관 내에서 배양되었습니다. 다른 최근 보고서의 결과와 일치38,39,40, 다음을 포함한 AP-1 계열 유전자 Fos, Atf, XNUMX월 과 마프 하위 패밀리는 QSC와 비교하여 FISC에서 극적으로 유도되었습니다(그림 XNUMX). 1b). 특히, Atf3 FISC에서는 급격히 유도되었지만(42.4배) ACS-24h에서는 급격히 감소했습니다(그림 XNUMX). 1c, d); 이는 RT-qPCR에서도 확인되었습니다(그림 XNUMX). 1e), 이는 분리에 의해 유도된 초기 활성화에 대한 빠르고 일시적인 반응 유전자임을 나타냅니다. 더욱이, 면역형광(IF) 염색은 FISC에서 ATF3 단백질의 동시 유도와 ASC의 감소를 입증했습니다(그림 XNUMX). 1f). 정지 틈새를 어느 정도 보존하고 SC 활성화를 최소화하는 것으로 여겨지는 새로 분리된 단일 근섬유에서도41,42관련 SC는 3시간 분리 직후에 ATF2 단백질의 높은 발현 수준을 보였으며 배양 24시간에는 감소했습니다(그림 XNUMX). 1g), ATF3가 초기 활성화된 SC에서 빠르게 유도된다는 개념을 강화합니다. 생체 내에서 ATF3 유도를 추가로 확인하기 위해 BaCl2를 C57BL/6 마우스의 전경골근(TA) 근육에 주입하여 급성 근육 손상을 유도했습니다. 이 부상 모델에서는36,43,44풍부한 면역 세포 침윤으로 인한 조직 변성은 일반적으로 손상 후 1일(dpi)에 관찰됩니다. SC는 빠르게 활성화되어 증식하는 근아세포로 확장된 후 융합되어 배아 미오신 중쇄(eMyHC)를 발현하고 중앙에 국한된 핵(CLN)을 특징으로 하는 작은 새로운 근섬유를 형성합니다. 이러한 eMyHC+ 섬유는 5dpi에서 쉽게 볼 수 있습니다. 7dpi에서 근육은 주로 eMyHC 발현이 하향 조절된 더 큰 재생성 근섬유로 구성됩니다. 근육 손상 및 염증 세포는 14dpi에서 대부분 제거되는 반면, 재생된 근섬유는 크기가 계속 증가하고 성숙하여 약 30dpi에서 완전한 재생을 달성합니다. 예상대로 ATF3 단백질은 IF에 의해 손상되지 않은 TA 근육에서 검출되지 않았지만 1dpi에서는 쉽게 볼 수 있었습니다. 일부 염색은 Pax7+ 세포와 병합되지 않았는데, 이는 손상 후 여러 세포에서 보고된 유비쿼터스 유도와 일치합니다.45. 2dpi에서 Pax3+ 세포의 ATF7 발현은 이 단계에서 SC의 완전한 활성화와 동시에 크게 증가했습니다(그림 XNUMX). 1h). 다른 여러 AP-1 제품군 구성원, Atf4, Fos, FosB및 준비, 유사한 동적 표현 프로필을 공유했습니다(그림 XNUMX). 1b~d), 이는 RT-qPCR에서도 확인되었습니다(보충 그림 XNUMX). 1b) 및 면역형광염색(보충 그림 XNUMX). 1c) 결과. 종합하면, 우리의 연구 결과는 ATF3 및 기타 여러 AP-1 계열 구성원이 초기 SC 활성화 중에 신속하고 일시적으로 유도되어 SC 초기 활성화 조절에 잠재적인 역할을 한다는 것을 보여줍니다.
a 현장 고정 후 정지 위성 세포(QSC)의 분리를 위한 도식, Tg 근육에서 사전 고정 없이 갓 분리된 SC(FISC): Pax7-nGFP 쥐. FISC는 이후 24(ASC-24h), 48(ASC-48h) 또는 72시간(DSC-72h) 동안 배양되고 활성화되었습니다. RNA-Seq 분석을 위해 RNA를 추출했습니다. BioRender.com으로 제작되었습니다. b RNA-Seq에 의해 검출된 AP-2 계열 TF의 유전자 발현 수준(Log1[FPKM])을 나타내는 히트 맵. c, d 발현 수준(FPKM) 및 게놈 스냅샷 Atf3, Atf4, Fos, FosB, 준비 위의 RNA-Seq로부터의 mRNA. e RT-qPCR 검출 Atf3 위의 셀에서. n = 그룹당 3마리의 마우스. p = 0.000025, 0.12, 0.0000011 및 0.0000052. f 위 세포에서 ATF3 및 Pax7 단백질의 면역형광(IF) 염색. 스케일 바: 50μm. g 분리 직후 또는 3시간 동안 배양한 EDL 근육의 단일 근섬유에 대한 ATF7 및 Pax24 단백질의 IF 염색. 스케일 바: 25μm. h 손상되지 않은 마우스 또는 3, 7 및 1dpi의 TA 근육 섹션에서 ATF2 및 Pax3 단백질의 IF 염색. 스케일 바: 50μm. 모든 막대 그래프는 평균 ± SD로 표시됩니다. 재학생 t 검정(양측 비대응)을 사용하여 통계적 유의성을 계산했습니다(e): *p < 0.05, **p < 0.01, ***p < 0.001. ns는 중요하지 않습니다. 소스 데이터는 소스 데이터 파일로 제공됩니다.
단기간의 Atf3 삭제는 급성 손상으로 인한 근육 재생을 가속화합니다
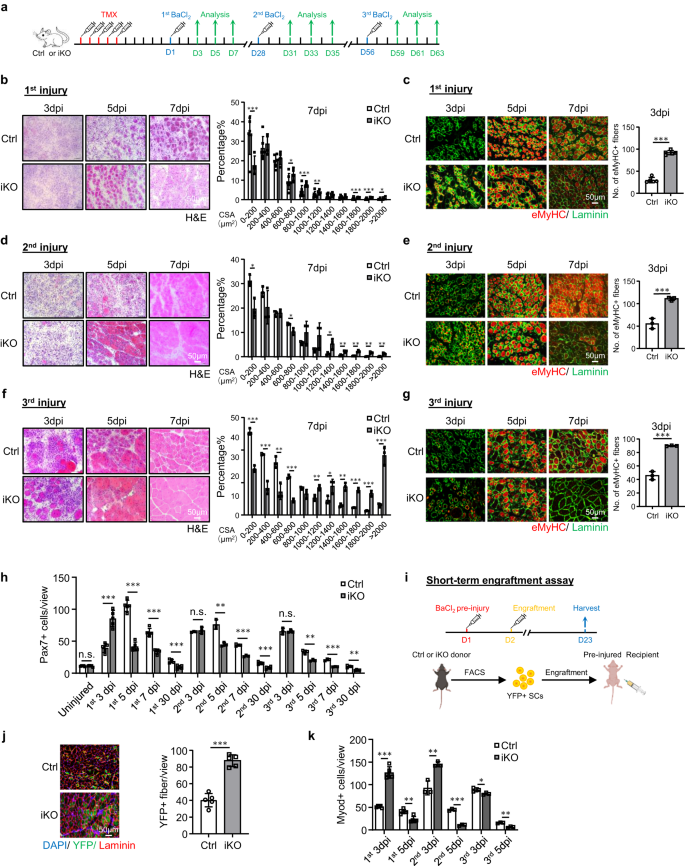
SC에서 ATF3 기능의 해부를 용이하게 하기 위해 우리는 Atf3플록스 대립 유전자46, 두 개의 LoxP 사이트가 삽입되었습니다. Atf3 엑손2와 팍스7CreERT2/CreERT2-R26RYFP/YFP 마우스43 컨트롤 생성(Ctrl)(Atf3+ / +– 팍스7CreERT2/CreERT2-R26RYFP/YFP) 및 유도성 녹아웃 마우스 Atf3 (Atf3 이코) (Atf3 플록스/플록스– 팍스7CreERT2/CreERT2-R26RYFP/YFP) (보충 그림. 2a). 타목시펜(TMX)을 5일 연속 복강내(IP) 주사한 후(그림 XNUMX) 2a), FISC에서 ATF3의 성공적인 삭제는 WB에 의해 확인되었습니다(보충 그림 XNUMX). 2b) 또는 IF(보조 그림. 2c); 단일 근섬유에서 SC의 IF 염색을 통해 그 고갈이 추가로 확인되었습니다(보충 그림 XNUMX). 2d). 형태학적으로 2개월 된 iKO는 Ctrl 한배 새끼 쥐와 뚜렷한 차이를 보이지 않았습니다. 신체 크기와 체중의 변화도 감지되지 않았습니다(보조 그림 XNUMX). 2e).
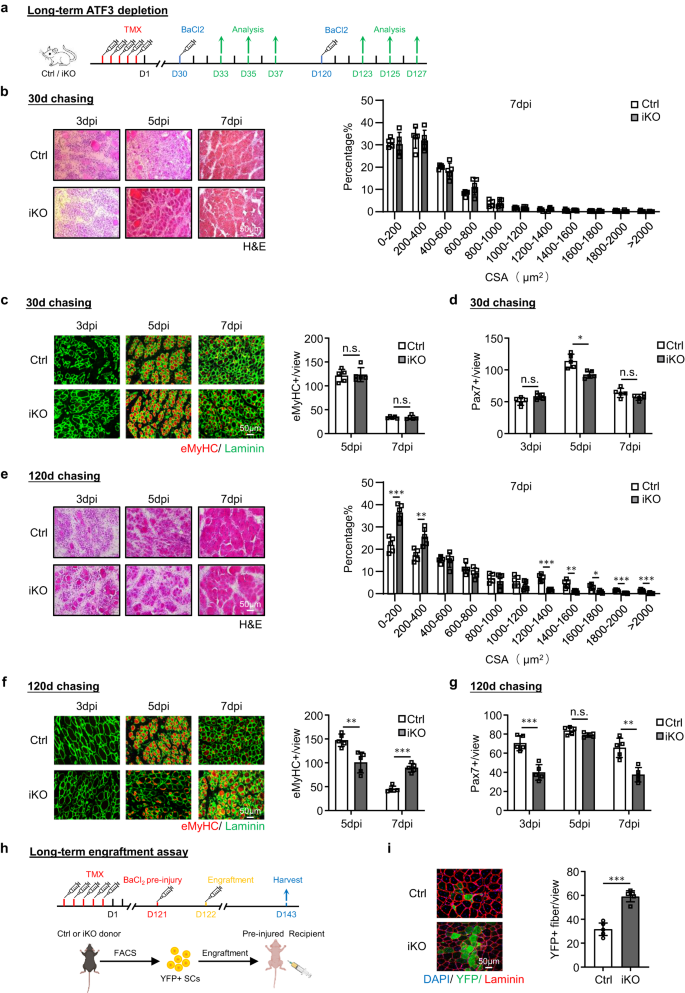
a 실험 설계의 개략도. b 3차 손상 후 5, 7, 1일에 수집된 TA 근육의 H&E 염색(dpi). 스케일 바: 50μm. 새로 형성된 섬유의 단면적(CSA)은 7dpi에서 TA 근육으로부터 정량화되었습니다. p = 0.000066, 0.018, 0.00069, 0.0087, 0.00082, 0.00047 및 0.046. c 위의 TA 근육에 대해 eMyHC(빨간색)와 Laminin(녹색)의 IF 염색을 수행했습니다. 스케일 바: 50μm. p = 0.00000011. d, e TA 근육의 H&E 및 eMyHC 염색은 2차 부상 이후입니다. 스케일 바: 50μm. p = 0.012, 0.019, 0.033, 0.0057, 0.0022, 0.0022 및 0.0093 (d); p = 0.00021 (e). f, g TA 근육의 H&E 및 eMyHC 염색은 3차 부상 이후입니다. 스케일 바: 50μm. p = 0.00015, 0.00087, 0.0063, 0.000074, 0.0089, 0.035, 0.0014, 0.00011, 0.00042 및 0.00071 (f); p = 0.000023 (g). h 뷰당 Pax7+ SC는 부상을 입지 않았거나 3라운드 부상 이후 Ctrl 및 iKO TA 근육에서 정량화되었습니다. p = 0.96, 0.00011, 0.0000013, 0.000014, 0.00066, 0.45, 0.0023, 0.00017, 0.00032, 0.95, 0.0022, 0.00019 및 0.0012. i 생착 분석에 대한 개략도. BioRender.com으로 제작되었습니다. j 생착 21일 후 TA 근육에 대한 YFP(녹색) 및 라미닌(빨간색)의 IF 염색. 스케일 바: 50μm. n = 그룹당 5마리의 마우스. p = 0.0000091. k Ctrl 및 iKO TA 근육에 대한 보기당 Myod+ SC의 정량화는 3라운드 부상을 게시합니다. p = 0.0000012, 0.0013, 0.0054, 0.000028, 0.041 및 0.0012. n = 5차 손상 후 3, 5, 7일 및 1차, 30차 및 1차 손상 및 생착 분석 후 2일 동안 그룹당 3마리의 마우스; n = 3차 및 3차 손상 후 5, 7, 2일 동안 그룹당 3마리의 마우스. 모든 막대 그래프는 평균 ± SD로 표시됩니다. t 검정(양측 비대응)을 사용하여 통계적 유의성을 계산했습니다(b-h, j, k): *p < 0.05, **p < 0.01, ***p < 0.001. ns는 중요하지 않습니다. 소스 데이터는 소스 데이터 파일로 제공됩니다.
초기 SC 활성화 동안 ATF3의 급속한 유도를 고려할 때, 우리는 ATFXNUMX의 손실이 SC 매개 근육 재생에 영향을 미칠 수 있다고 추론했습니다. 이 개념을 테스트하기 위해 BaCl2 TMX 결실 5일 후 급성 근육 손상을 유발하기 위해 Ctrl 또는 iKO 생쥐의 TA 근육에 주사했습니다(그림 XNUMX). 2a). 위의 손상된 TA 근육을 3, 5, 7 및 30dpi에서 검사합니다(그림 XNUMX). 2a), iKO 근육은 매우 빠른 재생 속도를 나타냈습니다. H&E 염색으로(Fig. 2b), 5dpi에서 CLN이 있는 재생 섬유는 iKO에 이미 존재했지만 Ctrl 근육에는 존재하지 않았습니다. 7dpi에서 손상된 근육은 균질한 섬유로 거의 복구되었으며 iKO에서는 면역 세포의 흔적이 없었으며 섬유 크기도 Ctrl(오른쪽의 정량화)에 비해 상당히 컸습니다. 이러한 실험적 관찰은 eMyHC의 IF 염색에 의해 추가로 뒷받침되었습니다(그림 XNUMX). 2c); eMyHC+ 섬유는 3dpi에서도 iKO에서 쉽게 관찰되었지만(iKO에서는 91.64, Ctrl에서는 29.86) 7dpi만큼 급격히 감소했습니다. 일관되게 7dpi에서 Pax3+ 셀의 수는 iKO와 Ctrl에서 상당히 높았지만 5dpi와 7dpi에서는 더 낮았습니다(그림 XNUMX). 2h 및 보충 그림 2f). 또한 iKO 생쥐로부터 30dpi로 수집한 TA 근육은 Ctrl(43.7 대 48.4mg)에 비해 근육 무게가 증가했습니다(보충 그림 XNUMX). 2g) 및 확대된 근섬유 크기(1137.4 vs. 862.8 μm)2) (보충 그림. 2h), 향상된 수리를 반영합니다.
놀랍게도 재생능력이 향상되었습니다. Atf3 iKO SC는 BaCl을 한 번 더 처리한 후에도 지속되었습니다.2- 한 달 후에 유발된 급성 부상(그림 XNUMX) 2a). 그림과 같이 2d, e, 가속된 재생은 7차 손상 후 3dpi에서 증가된 섬유 크기와 2dpi에서 eMyHC+ 섬유의 수를 기반으로 동일하게 강력하게 유지되었습니다. 30dpi에서 iKO 근육은 Ctrl(61.7 대 55.8mg)에 비해 근육 무게가 증가한 것으로 나타났습니다(보충 그림 XNUMX). 2i) 및 약간 확대된 근섬유 크기(1724.8 vs. 1633.8 μm)2) (보충 그림. 2j). 이후 3차 부상이 발생했다(Fig. 2a) 신속한 수리가 여전히 분명했습니다(그림 XNUMX). 2f,g), 3dpi에서 eMyHC+ 섬유의 수는 iKO 대 Ctrl 근육(89.9 대 45.7)에서 여전히 더 높았습니다(그림 XNUMX). 2g), 7dpi에서 더 많은 수의 더 큰 섬유가 관찰되었습니다(그림 XNUMX). 2f). 그러나 30차 부상 후 Ctrl 3일에 비해 iKO의 TA 근육 무게가 약간 증가했음에도 불구하고(보충 그림 XNUMX) 2k), 평균 근섬유 크기에는 큰 차이가 없었습니다(보충 그림 XNUMX). 2l), 이는 iKO 근육의 가속화된 재생이 결국 3차 부상 이후 사라졌음을 시사합니다.
그런 다음 iKO SC의 향상된 재생 능력을 추가로 검증하기 위해 생착 분석을 수행했습니다. 그림에 도시된 바와 같이. 2i, Ctrl 또는 iKO 생쥐의 YFP+ SC를 수용체 누드 생쥐의 손상 전 TA 근육에 주사한 지 21일 후, TA 근육을 수집하여 YFP 발현을 기반으로 기증자 세포의 재생 능력을 평가했습니다. 실제로, 우리는 iKO 대 Ctrl SC로 이식된 수용체 마우스에서 더 많은 수의 YFP+ 근섬유를 관찰했습니다(그림 XNUMX). 2j). 전체적으로, 우리의 결과는 다음을 입증합니다. Atf3 삭제는 급성 손상으로 인한 근육 재생을 향상시킵니다.
Atf3 삭제는 항상성 근육의 조기 SC 활성화 및 의사 재생을 유발합니다
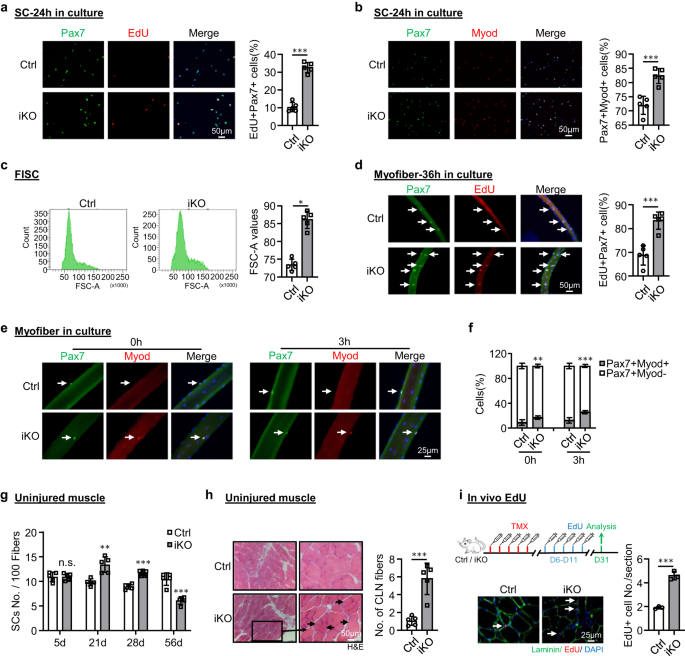
ATF3 손실 시 재생 능력이 향상되는 근본 원인을 분석하기 위해 우리는 iKO SC가 BaClXNUMX에 따라 빠르게 활성화되었다고 추측했습니다.2 부상. 실제로 3단계의 부상/재생 과정을 따라 MyoD+ SC의 역학을 플롯할 때. 훨씬 더 많은 수의 MyoD+ 세포가 XNUMXdpi에서 검출되었습니다(그림 XNUMX). 2k 및 보충 그림 2m), 그러나 셀 번호는 5dpi에서 빠르게 감소했습니다. 이러한 현상은 처음 두 번의 부상 동안 존재했으나 세 번째 라운드에서는 사라졌습니다(Fig. 2k 및 보충 그림 2m). Ctrl과 비교하여 급성 손상 시 iKO 세포의 더 빠른 활성화는 정지 상태에서 활성화로 더 빠른 전환을 의미합니다. 실제로 FISC는 Atf3-iKO 생쥐는 배양 24시간 후 EdU 혼입을 기반으로 세포 주기 진입에 대한 현저하게 증가된 경향을 나타냈습니다(~23% 증가)(그림 XNUMX). 3a). 또한, iKO의 Pax7+MyoD+ 세포는 배양 10시간 후 Ctrl에 비해 24% 증가를 나타냈습니다(그림 XNUMX). 3b). 또한 iKO 근육의 FISC 크기도 Ctrl 근육의 FISC(86.1 대 72.9)보다 약간 더 컸습니다(그림 XNUMX). 3c). 일관되게, iKO 근육에서 분리된 단일 근섬유는 배양 14시간 후 Ctrl 근섬유보다 EdU 통합이 훨씬 더 높았습니다(36% 증가)(그림 XNUMX). 3d), iKO SC의 더 빠른 세포주기 진입을 강화합니다. 새로 분리된 단일 근섬유의 iKO SC는 배양하지 않거나 1.90시간 동안 배양한 Ctrl SC보다 2.08배 및 7배 더 많은 Pax3+MyoD+ 세포를 생성했습니다(그림 XNUMX). 3e, 에프). 전체적으로, 이러한 결과는 ATF3의 손실로 인해 정지 상태가 해제되어 급성 손상 없이 급속한 SC 활성화가 발생함을 나타냅니다.
a Ctrl 또는 iKO 생쥐의 SC를 24시간 동안 배양하고 EdU(빨간색) 및 Pax6(녹색)으로 염색하기 전에 EdU로 7시간 동안 처리했습니다. 스케일 바: 50μm. p = 0.0000014. b 7시간 동안 배양된 위의 SC에서 Pax24(녹색) 및 MyoD(빨간색)의 IF 염색. 스케일 바: 50μm. p = 0.00050. c Ctrl 또는 iKO 근육에서 정렬된 FISC의 크기를 보여주는 대표적인 FACS 플롯입니다. p = 0.050. d Ctrl 또는 iKO 생쥐에서 새로 분리된 근섬유를 36시간 동안 배양하고 EdU(빨간색) 및 Pax6(녹색)으로 염색하기 전에 EdU로 7시간 동안 처리했습니다. 스케일 바: 50μm. p = 0.00034. e 분리 직후 또는 7시간 동안 배양한 위의 근섬유에 Pax3(녹색) 및 MyoD(빨간색)를 IF 염색합니다. 스케일 바: 25μm. f Myod-Pax7+ 및 Myod+Pax7+ SC의 백분율 정량화. p = 0.0098 및 0.00035. g TMX 주사 후 7일, 100일, 5일 및 21일에 손상되지 않은 Ctrl 또는 iKO 근육의 섬유 28개당 Pax56+ SC 수의 정량화. p = 0.96, 0.0018, 0.000049 및 0.00018. h TMX 주입 56일 후 위의 손상되지 않은 근육의 H&E 염색. 스케일 바: 50μm. p = 0.00043. i 위: 손상되지 않은 Ctrl 또는 iKO 근육에서 수행된 생체 내 EdU 분석의 도식적 개요; EdU는 TMX 5일 후 IP로 주입되었습니다. 근육은 21일 후에 수집되었습니다. EdU(빨간색) 및 Laminin(녹색)의 IF 염색이 더 낮습니다. 스케일 바: 25μm. p = 0.00024. n = 그룹당 5마리의 마우스(a-h); n = 그룹당 3마리의 마우스(i). 모든 막대 그래프는 평균 ± SD로 표시됩니다. t 검정(양측 비대응)을 사용하여 통계적 유의성을 계산했습니다(a-d, f-i): *p < 0.05, **p < 0.01, ***p < 0.001. ns는 중요하지 않습니다. 소스 데이터는 소스 데이터 파일로 제공됩니다.
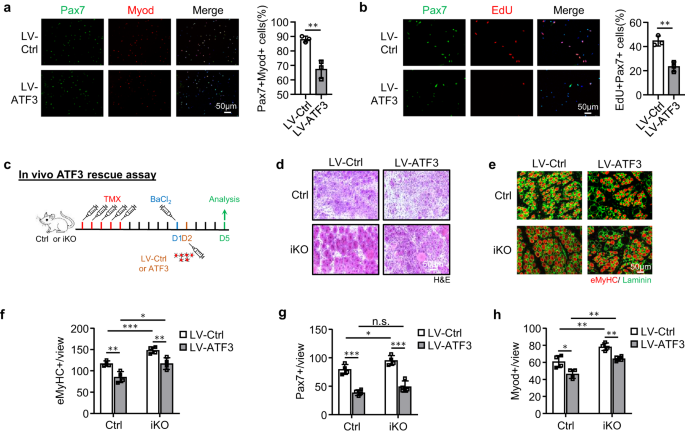
iKO SC의 향상된 재생 능력으로 인해 ATF3 손실이 부상 없이 근육의 자발적인 활성화 및 의사 재생으로 이어질 수 있는지 추가 테스트를 하게 되었습니다. Ctrl과 비교하여 TMX 주사 후 7일에 iKO TA 근육에서 Pax5+ SC의 증가는 없었지만 7일(21 대 13.4) 및 9.58일(28 대 11.7)에 iKO TA 근육의 Pax8.9+ 세포가 크게 증가했습니다. .XNUMX) (그림. 3g 과 S3a), 이는 항상성 근육에서 iKO SC의 자발적 활성화 및 확장이 발생함을 나타냅니다. 흥미롭게도, TMX 주사 후 56일까지 iKO 근육의 Pax7+ 세포 수가 Ctrl에 비해 마침내 감소했습니다(그림 XNUMX 및 XNUMX). 3g 과 S3a); 이는 쉽게 볼 수 있는 CLN+ 섬유를 동반했습니다(그림 XNUMX). 3h), 이는 활성화된 SC 유래 근모세포가 기존 섬유에 융합됨을 나타내며, 이는 유사 재생으로 알려져 있습니다.47. 이러한 결과를 확인하기 위해 우리는 TMX 주사 후 5일에 21회 용량의 EdU 주사를 수행하여 EdU 주사 후 XNUMX일에 Ctrl보다 iKO의 근육 부분에 더 많은 EdU+ 세포가 있음을 보여주었습니다(그림 XNUMX). 3i). 마찬가지로, 단일 용량의 EdU를 투여한 경우, EdU+ 세포는 12시간 후에 분리된 iKO 근섬유 또는 TA 근육에서만 검출되었지만 Ctrl 근육에서는 검출되지 않았습니다(보충 그림 XNUMX). 3b). 종합적으로, 이 결과는 다음을 시사합니다. Atf3 결실은 항상성 근육에서 SC의 조숙한 활성화를 유발하므로 ATF3는 SC 활성화를 적극적으로 억제하는 기능을 할 수 있습니다. 이는 렌티바이러스에 의해 FISC에서 ATF3를 과발현함으로써 더욱 강화되었습니다(보충 그림 XNUMX). 3c); 이는 SC 활성화를 상당히 억제했습니다(그림 XNUMX). 4a, Pax20.9+MyoD+ 세포의 7% 감소 및 그림. 4b, EdU+ 세포의 21.3% 감소). 또한, 3dpi에서 렌티바이러스 입자를 근육내 주사하여 생체 내에서 ATF1를 과발현했습니다(그림 XNUMX). 4c) Ctrl 마우스의 재생을 지연시켰으며 iKO 마우스의 재생 가속화도 둔화시켰습니다(그림 XNUMX 및 XNUMX). 4일~시 과 S3d, 전자).
a Ctrl 또는 iKO 생쥐의 FISC를 ATF3 과발현 렌티바이러스에 감염시키고 7시간 후에 Pax48(녹색) 및 Myod(빨간색)에 대해 염색했습니다. 스케일 바: 50μm. p = 0.0050. b EdU 분석을 수행하고 EdU+ 세포를 정량화했습니다. 스케일 바: 50μm. p = 0.0031. c 생체 내에서 ATF3를 과발현하기 위한 도식. ATF3 발현 렌티바이러스는 BaCl 1일 후 Ctrl 또는 iKO TA 근육에 주입되었습니다.2 부상. 분석을 위해 감염 5일 후 근육을 수집했습니다. d 위의 TA 근육의 H&E 염색. 스케일 바: 50μm. e 위의 TA 근육에 대해 eMyHC(빨간색)와 Laminin(녹색)의 IF 염색을 수행했습니다. 스케일 바: 50μm. f 뷰당 eMyHC+ 섬유의 수가 정량화되었습니다. p = 0.0044, 0.00081, 0.015 및 0.0072. g 위의 TA 근육에 대한 보기당 Pax7+ 세포의 수를 정량화했습니다. p = 0.00018, 0.041, 0.098 및 0.00040. h 위의 TA 근육에 대한 보기당 Myod+ 세포의 수를 정량화했습니다. p = 0.016, 0.0058, 0.0010 및 0.0019. n = 그룹당 3마리의 마우스(a, b); n = 그룹당 4마리의 마우스(d-h). 모든 막대 그래프는 평균 ± SD로 표시됩니다. 재학생 t 검정(양측 비대응)을 사용하여 통계적 유의성을 계산했습니다(a, b, f-h): *p < 0.05, **p < 0.01, ***p < 0.001. ns는 중요하지 않습니다. 소스 데이터는 소스 데이터 파일로 제공됩니다.
또한, 우리는 24시간 배양 후 Ctrl에 비해 분리된 iKO 근육 섬유에서 MyoD+ MyoG+ 분화 세포가 72% 증가하는 것을 관찰했습니다(보충 그림 XNUMX). 3f), 다음과 같이 제안한다. Atf3 삭제는 SC 자손 분화를 가속화할 수 있습니다. 이는 72시간 동안 배양된 SC에서 MyoD 및 MyoG를 염색하여 확인되었습니다. iKO 대 Ctrl에서 이중 양성 세포의 9% 증가가 감지되었습니다(보충 그림 XNUMX). 3g). 흥미롭게도 iKO 근육 섬유의 Pax7+MyoD- 세포도 Ctrl(10.13% 대 8.48%)에 비해 약간 감소했습니다(보충 그림 XNUMX). 3h), 이는 Atf3 손실이 자가 재생 장애로 이어질 수도 있음을 시사합니다. 일관되게 우리는 각 부상 라운드 이후 SC 수가 점진적으로 감소하는 것을 확인했습니다(그림 XNUMX). 2h 및 보충 그림 2f).
장기 Atf3 결핍은 SC 풀을 고갈시키고 근육 재생을 손상시킵니다.
다음으로 장기간 테스트를 해보겠습니다. Atf3 결핍은 SC 피로를 유발하고 근육 재생을 손상시키며 BaCl에 의해 근육 손상을 유발합니다.2 삭제 후 30일 또는 120일 투여 Atf3 SC에서 3, 5, 7dpi로 손상된 TA 근육을 검사했습니다(그림 XNUMX). 5a). 삭제 XNUMX일 후 근육 재생(근육 섬유 크기 및 eMyHC+ 섬유 수 기준)은 Ctrl 마우스와 비교하여 큰 변화를 나타내지 않았습니다(그림 XNUMX). 5b, c). Pax7+ SC의 수는 3dpi와 7dpi에서도 비슷했으며 5dpi에서는 iKO가 약간 더 낮았습니다(그림 XNUMX). 5d 및 보충 그림 4a). 대조적으로, 삭제 후 120일 동안 Ctrl 마우스에 비해 iKO에서는 근육 재생이 명백히 손상되었습니다. 7dpi에서 더 작은 섬유의 상당한 증가가 관찰되었습니다(그림 XNUMX). 5e); eMyHC+ 섬유의 수는 5dpi에서는 훨씬 낮았지만 7dpi에서는 더 높았습니다(그림 XNUMX). 5f); Pax7+ SC의 수도 3dpi와 7dpi 모두에서 크게 감소했습니다(그림 XNUMX). 5g 및 보충 그림 4b). 이러한 결과는 장기적으로 Atf3 결핍은 SC 풀을 축소하여 재생에 해롭습니다. 흥미롭게도 TMX 주입 4개월 후 Ctrl 또는 iKO 마우스에서 분리한 동일한 수의 YFP+ 세포를 생착 분석에 사용했습니다(그림 XNUMX). 5h), iKO 세포가 이식된 수용자 누드 마우스에서 더 많은 수의 YFP+ 근섬유가 관찰되었습니다(59.28 대 31.72, 그림 XNUMX). 5i), 이는 iKO 세포의 향상된 재생 능력이 장기간 ATF3 손실 후에도 지속되고 손상된 근육 재생이 실제로 감소된 세포 풀에서 발생함을 시사합니다.
a 장기간의 효과를 테스트하기 위한 실험 설계의 개략도 Atf3 근육 재생 과정의 삭제. BaCl 투여 전 TMX 주사 후 30일 또는 120일 추적2 주입. b 왼쪽: 3일 추적 기간 후 5, 7, 30dpi에서 수집된 TA 근육의 H&E 염색. 스케일 바: 50μm. n = 그룹당 5마리의 마우스. 오른쪽: 새로 형성된 섬유의 CSA는 7dpi에서 위에서 염색된 TA 근육으로부터 정량화되었으며 분포가 표시됩니다. n = 그룹당 5마리의 마우스. c 왼쪽: 위의 TA 근육에서 eMyHC(빨간색)와 라미닌(녹색)의 IF 염색이 수행되었습니다. 스케일 바: 50μm. 오른쪽: 5dpi 및 7dpi에서 뷰당 eMyHC+ 섬유 수의 정량화. n = 그룹당 5마리의 마우스. p = 0.83 및 0.98. d 보기당 Pax7+ SC 수를 정량화합니다. n = 그룹당 5마리의 마우스. p = 0.054, 0.0047 및 0.11. e-g 위의 분석/정량화는 3일의 추적 기간 후 5, 7 및 120 dpi에서 수집된 Ctrl 또는 iKO 근육에 대해 수행되었습니다. 스케일 바: 50μm. n = 그룹당 5마리의 마우스. p = 0.00020, 0.0047, 0.000068, 0.0024, 0.013, 0.00019 및 0.00057 (e); p = 0.0034 및 0.000018(f); p = 0.00031, 0.063 및 0.0010 (g). h 생착 분석에 대한 개략도. TMX 주사 120일 후, 기증자 마우스(Ctrl/iKO)의 FISC를 미리 손상된 수용자 누드 마우스에 주사했습니다. TA 근육은 분석을 위해 이식 후 21일에 수집되었습니다. BioRender.com으로 제작되었습니다. i 왼쪽: 위의 TA 근육에 대한 YFP(녹색) 및 라미닌(빨간색)의 IF 염색. 스케일 바: 50μm. 오른쪽: 뷰당 YFP+ 섬유의 수가 정량화되었습니다. n = 그룹당 5마리의 마우스. p = 0.000047. 모든 막대 그래프는 평균 ± SD로 표시됩니다. 재학생 t 검정(양측 비대응)을 사용하여 통계적 유의성을 계산했습니다(b-g, i): *p < 0.05, **p < 0.01, ***p < 0.001. ns는 중요하지 않습니다. 소스 데이터는 소스 데이터 파일로 제공됩니다.
중요성을 더욱 확고히 하기 위해 Atf3 SC 구축 및 유지관리에 있어서 성공적으로 삭제하였습니다. Atf3 Pax7+ 근생 전구세포에서 Atf3플록스 비유도성 대립유전자 팍스7Cre-R26RYFP 형질전환 마우스 계통48Cre 재조합 효소는 E7만큼 일찍 Pax9.5+ 전구 세포에서 발현됩니다(보충 그림 XNUMX). 5a-c). 흥미롭게도 cKO 근육은 SC 풀이 확립되었을 때 생후 84개월쯤에 Ctrl에 비해 Pax7+ SC의 1% 증가를 나타냈습니다.49그러나 79개월 된 성체 쥐에서는 XNUMX% 감소했습니다(보충 그림 XNUMX). 5e) 이는 ATF3이 성인기 SC 유지에 필요하지만 SC 확립에는 필요하지 않음을 나타냅니다. 1개월 된 cKO에서 감소된 TA 근육 무게가 감지되었습니다(29.42mg 대 34.88mg, 보충 그림 XNUMX). 5f), 체중에는 유의미한 차이가 없었습니다(12.66 mg 대 12.42 mg, 보충 그림 XNUMX). 5d) 및 섬유 크기(861.96μm)2 대 848.71μm2보충 그림. 5g) 따라서 어린 cKO 생쥐에서 근육 비대가 발생하는지 결론을 내리기는 어렵습니다. 예상대로, 성인 SC를 분리하고 배양했을 때 cKO 세포는 Pax7+Myod+ 염색으로 평가한 활성화 경향이 훨씬 더 높았습니다(보충 그림 XNUMX). 5h, cKO 대 Ctrl의 23.8% 증가) 및 EdU 분석(보충 그림 XNUMX) 5i, 99.9% 증가). 이에 따라 급성 부상 후 재생 능력은 cKO 근육에서 분명히 손상되었습니다 (보충 그림 XNUMX). 5j–l). 따라서 ATF3의 손실은 조숙한 SC 활성화를 유도하고 궁극적으로 SC 풀의 감소로 이어집니다.
Atf3 삭제는 자발적 및 지구력 운동 중 SC 활성화를 향상시킵니다.
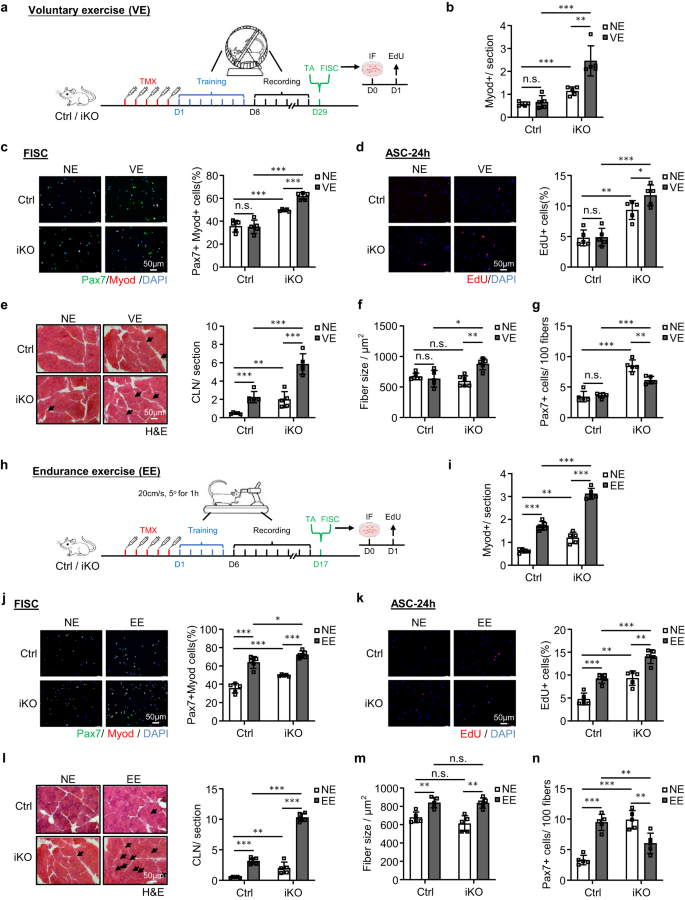
단기 및 비격렬한 자발적 운동(VE)은 SC 활성화를 유발하지 못하지만 지구력 운동(EE)은 SC를 활성화합니다.50,51,52,53,54. SC 활성화를 방지하는 ATF3의 기능을 추가로 입증하기 위해 ATF3 고갈이 VE 유발 SC 활성화에 영향을 미치는지 확인하려고 했습니다. TMX 주사를 7회 투여한 직후, Ctrl 및 iKO 생쥐는 확립된 자발적 바퀴 달리기 체제를 받게 되었습니다. 마우스에게 자유롭게 회전하는 바퀴에 접근할 수 있는 권한을 제공했습니다. 훈련 후 21일 이내에 안정적인 VE 루틴에 도달했으며 XNUMX일 동안 VE가 계속되었습니다(그림 XNUMX). 6a). 일일 달리기 거리가 기록되었으며 Ctrl(14.38km) 마우스와 iKO(13.78km) 마우스 사이에는 유의미한 차이가 발견되지 않았습니다(보충 그림 XNUMX). 6a, b).
a VE에 대한 실험 설계의 개략도. b 위의 TA 근육에 있는 Myod+ 세포의 정량화. p = 0.54, 0.00024, 0.00049 및 0.0024. c 위의 마우스로부터 분리하고 7시간 동안 배양한 SC에 대한 Pax24(녹색) 및 MyoD(빨간색)의 IF 염색. 스케일 바: 50μm. p = 0.91, 0.00035, 0.000018 및 0.000032. d EdU(빨간색)는 위의 마우스에서 분류된 SC에 염색되어 24시간 동안 배양되었습니다. 스케일 바: 50μm. p = 0.90, 0.0010, 0.00013 및 0.046. e 위의 TA 근육의 H&E 염색. 스케일 바: 50μm. p = 0.00043, 0.0073, 0.00021 및 0.00047. f 위 TA 근육의 섬유 크기(e). p = 0.54, 0.19, 0.012 및 0.0017. g 위의 TA 근육에 대한 Pax7+ SC의 정량화. p = 0.66, 0.000023, 0.000052 및 0.0017. h 실험 설계(EE)의 개략도. i EE가 있거나 없는 위의 Ctrl 및 iKO 마우스에서 수집된 TA 근육의 Myod+ 세포의 정량화. p = 0.0000026, 0.0010, 0.0000073 및 0.0000015. j 위의 마우스에서 분류한 SC에 대한 Pax7(녹색) 및 MyoD(빨간색)의 IF 염색을 24시간 동안 배양했습니다. 스케일 바: 50μm. p = 0.000062, 0.00035, 0.035 및 0.0000018. k EdU(적색)는 상기 마우스로부터 분리된 SC에서 염색되었고 24시간 동안 배양되었다. 스케일 바: 50μm. p = 0.00031, 0.0010, 0.00034 및 0.0012. l 위의 TA 근육의 H&E 염색. 스케일 바: 50μm. p = 0.0000039, 0.0073, 0.000000071 및 0.00000026. m 위 TA 근육의 섬유 크기(l). p = 0.0022, 0.19, 0.91 및 0.0012. n 위의 TA 근육에 대한 Pax7+ SC의 정량화. p = 0.000018, 0.000024, 0.0067 및 0.0049. n = 그룹당 5마리의 마우스(b-g, i-n). 모든 막대 그래프는 평균 ± SD로 표시됩니다. 재학생 t 검정(양측 비대응)을 사용하여 통계적 유의성을 계산했습니다(b-g, i-n): *p < 0.05, **p < 0.01, ***p < 0.001. ns는 중요하지 않습니다. 소스 데이터는 소스 데이터 파일로 제공됩니다.
예상대로, AP-1 계열 구성원의 발현은 Ctrl SC의 VE에 의해 유도되었습니다(보충 그림 XNUMX). 6c). 또한 이전 보고서와 일치54VE 전후의 근육 단면에서 MyoD+ 세포가 검출되지 않았기 때문에 VE는 Ctrl 마우스에서 SC 활성화를 유도하지 않았습니다(그림 XNUMX). 6b 및 보충 그림 6d); 지속적으로 FISC의 Pax7+MyoD+ 염색이 이루어졌습니다(그림 XNUMX). 6c) 또는 24시간 동안 배양된 ASC의 EdU 염색(그림 XNUMX). 6d)는 VE 전후의 활성화율 증가를 나타내지 않았습니다. 대조적으로, iKO 세포는 VE에 의해 쉽게 활성화되었습니다(그림 XNUMX). 6b~d 및 보충 그림 6d). 지속적으로 iKO 근육에서는 CLN 섬유의 수가 상당히 증가한 것으로 나타났습니다(136% 증가). 6e) 및 VE 후 명백한 비대(섬유 크기가 43.3% 증가)(그림 XNUMX). 6f). Ctrl 근육에서는 VE 이후 CLN의 수가 증가했지만 비대 성장을 유발할 만큼 충분하지는 않았습니다(그림 XNUMX). 6e, 에프). 따라서 위의 발견은 ATF3 손실이 VE에 의한 SC의 빠른 활성화를 유도한다는 개념을 강화합니다. 그 결과, VE 체제가 끝날 때 SC 풀이 감소했습니다(Pax38.2+ FISC의 7% 감소). 6g 및 보충 그림 6e).
EE는 SC 활성화 및 근육 비대를 유발하는 것으로 알려져 있기 때문에50,51,52,53, 우리는 다음으로 Atf3 결핍은 EE 유발 SC 활성화에 영향을 미칩니다. 이를 위해 Ctrl 및 iKO 마우스는 런닝머신 달리기 체제를 받았습니다.55,56 런닝머신은 5° 경사와 20 cm/s의 속도로 60분 동안 설정되었습니다. TMX 주사를 5회 투여한 후, 생쥐는 10일간의 적응 기간 동안 훈련을 받은 후 XNUMX일간의 지구력 훈련(+EE)을 받거나 대조 조건으로 훈련 없이(NE) 훈련을 받았습니다. 6h). 예상한 대로 AP-1 계열 구성원의 발현은 SC의 EE에 의해 빠르게 유도되었습니다(보충 그림 XNUMX). 6c). 더욱이, EE는 Ctrl 근육에서 분명한 SC 활성화를 일으켰지만, iKO 근육에서는 활성화가 훨씬 더 강했습니다(그림 XNUMX). 6i–k 및 보충 그림 6f). 일관되게 CLN 섬유는 EE 이후 Ctrl 및 iKO 근육 모두에서 유도되었습니다. Ctrl 근육에 비해 iKO에서 CLN 섬유의 더 높은 증가가 나타났습니다(그림 XNUMX). 6l). 또한, Ctrl과 iKO 근육 모두 EE 이후 비대 성장을 보였지만 차이는 발견되지 않았습니다(그림 XNUMX). 6m). EE 체제가 끝나면 Pax7+ FISC의 수가 Ctrl에서는 크게 증가했지만 iKO에서는 감소했습니다(그림 XNUMX). 6n 및 보충 그림 6g) 이는 iKO SC 풀의 급속한 고갈을 나타냅니다. 전체적으로, 이러한 발견은 ATF3의 손실이 VE에 의한 SC 활성화를 유발하고 EE에 의한 SC 활성화도 향상시킨다는 것을 나타냅니다.
ATF3은 규제한다 H2B 유전자 발현 및 뉴클레오솜 패터닝
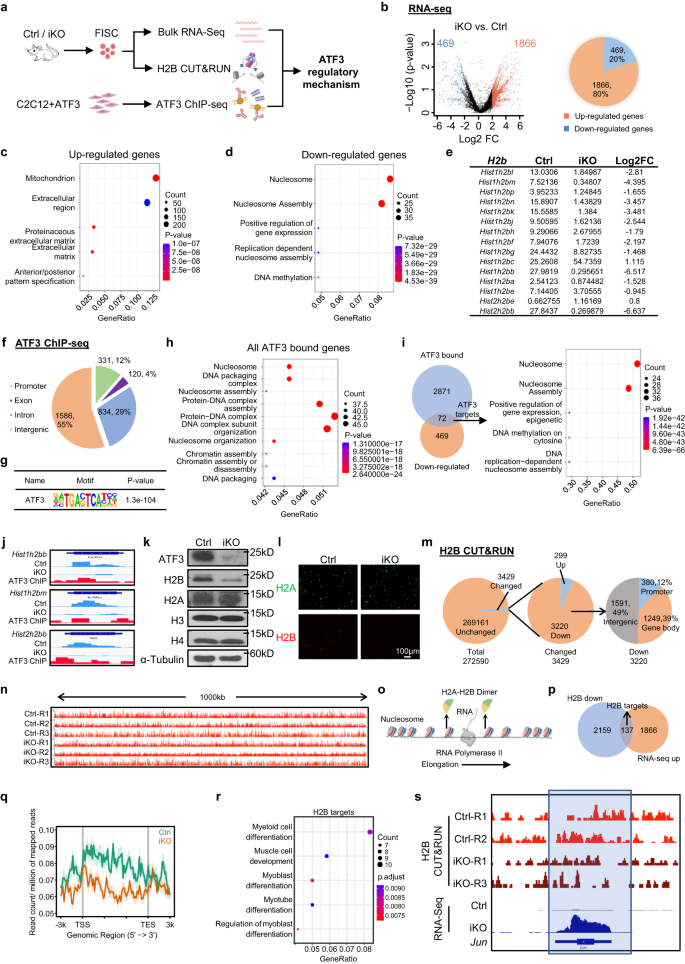
위의 결과는 조숙한 SC 활성화를 예방하는 데 있어 ATF3 유도의 필수적인 역할을 제시하고, 기본 분자 메커니즘을 밝히기 위해 Ctrl 및 iKO 근육에서 수집한 FISC에서 RNA-Seq을 수행하여 ATF3 전사 출력을 프로파일링했습니다(그림 XNUMX). 7a). iKO에서는 Ctrl에 비해 총 1866개의 전사체(빨간색 점)(79.9%)가 상향 조절된 반면, 469개(파란색 점)(20.1%)는 하향 조절되었습니다(그림 XNUMX). 7b보충 그림. 7a 및 보충 데이터 1), ATF3 손실이 전체 전사 활성화를 유도했음을 시사합니다. GO 분석에서는 상향 조절된 유전자가 "미토콘드리아", "세포외 기질" 등에 대해 풍부하다는 사실이 밝혀졌습니다(그림 XNUMX). 7c 및 보충 데이터 1). 주목할 만한 점은, 증가된 미토콘드리아 활성 및 세포외 기질 발현이 이전에 G경보 세포10이는 ATF3가 이러한 활성화 유전자의 발현을 억제하여 조기 SC 활성화를 방지하는 기능을 한다는 것을 시사합니다. 하향 조절된 유전자는 흥미롭게도 "뉴클레오솜" 및 "뉴클레오솜 조립" 등에 대해 풍부했습니다. 7d 및 보충 데이터 1). 특히, 히스톤 단백질을 암호화하는 유전자는 하향 조절된 유전자 중에서 높게 나타납니다(그림 XNUMX). 7e), 이는 RT-qPCR에서도 확인되었습니다(19-46% 감소)(보충 그림 XNUMX). 7b). 히스톤 코딩 유전자는 일반적으로 다중 유전자 클러스터로 구성되며 H2B 단백질은 Chr2에 15개가 있는 13개의 유전자 클러스터에 의해 코딩됩니다. 역사1시간2b 클러스터와 Chr2의 3가 역사2시간2b 클러스터(보조 그림. 7c). 놀랍게도 13명 중 17명이 H2b iKO SC에서는 유전자가 하향 조절되었습니다(그림 XNUMX). 7e). 추가적으로, 우리는 또한 Ctrl 및 Atf3-cKO 생쥐와 유사한 결과가 얻어졌습니다 (보충 그림 XNUMX). 7d–g 및 보충 데이터 3). 이러한 결과는 ATF3 손실이 감소함을 보여줍니다. H2b 유전자 발현.
a 실험 설계의 개략도. BioRender.com으로 제작되었습니다. b DEG는 위의 Ctrl 대 iKO RNA-seq로부터 확인되었습니다. c, d 위의 상향 및 하향 조절 유전자에 대한 GO 분석. e FPKM 및 Log2FC H2b iKO 대 Ctrl의 유전자. f 2871 ATF3 결합 피크의 게놈 분포. g 위의 결합 영역에서 표준 ATF3 모티프의 강화. h ATF3 결합이 있는 위의 모든 유전자에 대한 GO 분석. i 왼쪽: 위에서 확인된 ChIP-Seq 표적(72)과 하향 조절된 유전자(2871) 사이의 중첩(469개 유전자)을 보여주는 벤 다이어그램. 오른쪽: 위의 72개 유전자에 대한 GO 분석을 통해 히스톤 관련 용어가 극도로 풍부해진 것으로 나타났습니다. j 위 항목 중 3개의 게놈 스냅샷이 확인되었습니다. H2b TSS(ChIP-Seq 트랙)에 ATF3 결합이 있고 ATF3 결실(RNA-Seq 트랙)에 의해 하향 조절되는 유전자입니다. k ATF3, H2A, H2B, H3 및 H4 단백질은 Ctrl 및 iKO 마우스의 FISC에서 웨스턴 블롯으로 측정되었습니다. α-Tubulin은 로딩 컨트롤로 사용되었습니다. l 위의 FISC에서 H2A(녹색) 및 H2B(빨간색)의 IF 염색. 스케일 바: 100μm; n = 그룹당 3마리의 마우스. m H2B가 변경된(3429, 299 위쪽 및 3220 아래쪽) 및 변경되지 않은(269161) bin 수(왼쪽 및 가운데)와 하향 조정된 H2B 신호의 게놈 분포(오른쪽)를 보여주는 원형 차트. n Chr1000의 Ctrl 및 iKO에서 H2B 신호의 4kb 영역 IGV(Integrative Genomics Viewer) 트랙의 게놈 스냅샷. o DNA 전사 중 RNA 중합효소 II 신장 과정의 개략도. BioRender.com으로 제작되었습니다. p 하향 조절된 H137B CUT&RUN 신호(2)가 있는 위 영역과 위의 (A) RNA-Seq에서 상향 조절된 유전자(2159) 사이의 중첩(1866개 유전자)을 보여주는 벤 다이어그램. q 평균 H2B CUT&RUN 신호를 보여주는 메타플롯은 TSS의 업스트림에서 다운스트림까지 3kb입니다. r (P)의 위 252개 유전자에 대한 GO 분석. s 게놈 스냅샷 6월 iKO 대 Ctrl에서 하향 조절된 H2B CUT&RUN 신호와 상향 조절된 RNA-Seq 신호를 보여주는 유전자. iKO와 Ctrl의 H2B 신호 감소 영역은 파란색 프레임으로 강조 표시됩니다. 소스 데이터는 소스 데이터 파일로 제공됩니다.
다음으로, 우리는 ATF2의 직접 결합 표적을 정의하기 위한 대리 시스템으로 외인성 ATF12 과발현을 갖는 C3C3 근아세포에 대해 ChIP-Seq를 수행했습니다(그림 XNUMX). 7a 및 보충 그림 7h). 총 2871개의 결합 피크가 869개 유전자에서 확인되었으며, 그 중 60%는 유전자간 영역, 인트론 및 프로모터에 각각 28%, 9% 및 XNUMX% 위치합니다(그림 XNUMX). 7f 및 보충 데이터 2). 이들 피크는 알려진 ATF3 결합 모티프인 TGACTCA에 대해 강화되었습니다(그림 XNUMX). 7g), 이는 좋은 데이터 품질을 증명합니다. 이러한 ATF3 결합 유전자에 대한 GO 분석은 뉴클레오솜과 관련된 용어가 현저하게 풍부하다는 것을 나타냅니다(그림 XNUMX). 7h 및 보충 데이터 2). RNA-Seq와 ChIP-Seq 결과를 통합함으로써, 72개의 하향 조절된 유전자는 ATF3 결합 부위를 포함하고 다시 뉴클레오솜 관련 GO 용어가 풍부해졌으며 그 중 다수는 히스톤 유전자였습니다(그림 XNUMX). 7i 및 보충 데이터 2). 특히 8개 중 13개가 하향 규제되었습니다. H2b 유전자의 프로모터에는 ATF3 결합 부위가 있었습니다(그림 XNUMX). 7i, j보충 그림. 7i 및 보충 데이터 2). 한편, 112개의 상향 조절된 유전자는 ATF3 결합을 보유하고 미토콘드리아 관련 GO 용어가 풍부해졌습니다(보충 그림 XNUMX). 7j 및 보충 데이터 2). 웨스턴블롯(그림. 7k) 및 IF 염색(그림. 7l) 결과는 H2, H3 및 H4A와 같은 다른 히스톤 단백질이 변경되지 않은 상태로 유지되는 동안 iKO FISC에서 H2B 단백질의 실질적인 감소 또는 거의 손실을 확인했습니다. 이 결과는 다음을 입증합니다. H2b 유전자는 ATF3의 진정한 전사 표적입니다.
히스톤의 전체적인 감소는 뉴클레오솜의 양을 감소시키고, 뉴클레오솜 간격을 증가시키며, 뉴클레오솜 점유를 변경하여 전사에 영향을 줍니다.57,58,59, iKO SC의 H2B 손실이 뉴클레오솜 위치 지정 및 점유를 변경하는지 확인하기 위해 CUT&RUN 분석60,61 Ctrl 및 iKO 세포에서 H2B의 게놈 위치를 매핑하기 위해 수행되었습니다(그림 XNUMX). 7a). 총 272590개의 빈이 XNUMX개의 복제물에서 게놈 전체에 걸쳐 정의되었습니다(보충 데이터 4). 예기치 않게 평균 H2B CUT&RUN 신호는 iKO 대 Ctrl에서 크게 변경되지 않았으며 단지 3429개의 빈(1.4%)만이 변경 사항을 나타냈습니다(그림 XNUMX). 7분, 엔). 그럼에도 불구하고 변경된 빈 중 3220개는 실제로 프로모터(2%), 유전자 본체(12%) 및 유전자간 영역(39%)을 포함한 다양한 게놈 영역에서 H49B 농축이 감소한 것으로 나타났습니다. 7m). Pol II 전사를 촉진하기 위해 하나의 H2A-H2B 이합체를 제거하여 뉴클레오솜이 부분적으로 분해되기 때문에61 (무화과. 7o), 우리는 H2B의 국소적 손실이 뉴클레오솜 불안정화를 촉진하여 관련 유전자의 전사를 촉진할 수 있다는 가설을 세웠습니다. 실제로, RNA-Seq 데이터와 교차함으로써, 137개의 상향 조절된 유전자는 프로모터 또는 유전자체에서 H2B 신호가 감소한 것으로 나타났습니다. 오후 7시, q 및 보충 데이터 4). 이러한 H2B 표적 유전자는 근육 분화와 관련된 GO 용어가 풍부했으며 또한 포함되었습니다. 아이디3, IGF-1 과 6월등.(그림. 7r, 초), 이는 iKO SC의 활성화 상태와 일치합니다.11,62,63. 종합하면, 이러한 발견은 감소된 H2B 수준이 ATF3 손실 후 조숙한 SC 활성화를 중재할 수 있음을 보여줍니다.
H2B는 SC 활성화 및 근육 재생에서 ATF3 기능을 중재합니다.
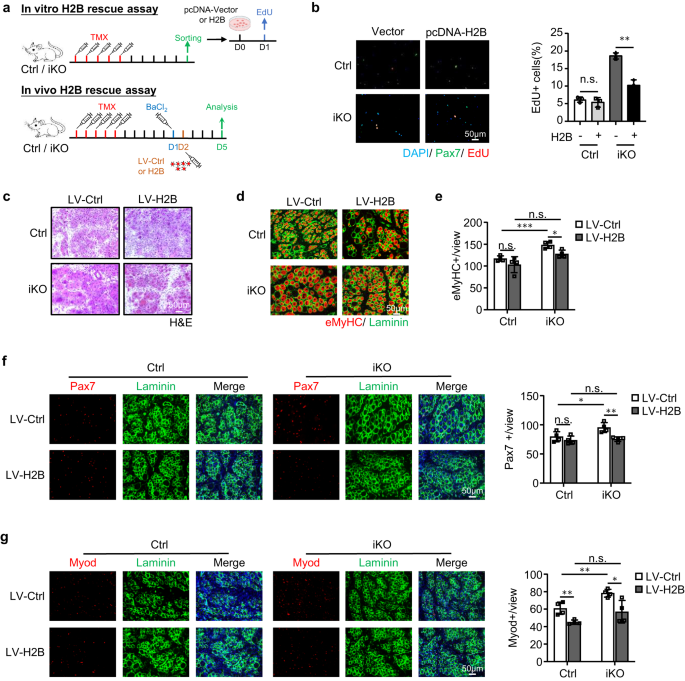
SC 활성화 및 근육 재생에서 ATF3과 H2B 사이의 기능적 연결을 강화하기 위해 우리는 FISC에서 pcDNA-H2B 플라스미드를 형질감염하여 H2B를 과발현하는 것이 실제로 Atf3 iKO 세포의 활성화 가속화를 억제했지만 Ctrl 세포에는 영향을 미치지 않는다는 것을 발견했습니다(그림 XNUMX). 8a, b). 그리고 생체 내에서 우리는 또한 H2B를 과발현했습니다(보충 그림 XNUMX). 7k) 1dpi로 렌티바이러스 입자를 근육내 주사함으로써(그림 XNUMX) 8a). 그림과 같이 8c–g, 이는 또한 Atf3-iKO 생쥐에서 급성 손상으로 인한 재생을 회복시켰습니다. eMyHC+ 섬유의 수가 5dpi에서 상당히 적은 것으로 관찰되었습니다(그림 XNUMX). 8d, e), 이는 Pax7+ 세포의 수가 감소함을 동반했습니다(그림 XNUMX). 8f) 및 MyoD+ 세포(그림. 8g). 이러한 발견은 전체적으로 H2B 손실이 ATF3 손실 시 관찰되는 조숙한 SC 활성화 및 강화된 근육 재생을 중재한다는 것을 입증합니다.
a 위: 시험관 내에서 H2B를 과발현하는 도식. Ctrl 또는 iKO 생쥐의 FISC를 대조군(Ctrl) 또는 pCDNA-H2B 플라스미드로 형질감염시키고 SC 활성화를 평가하기 위해 EdU 분석을 수행했습니다. 하단: 렌티 바이러스를 통해 생체 내에서 H2B를 과발현하는 도식. H2B 발현 렌티바이러스는 BaCl 1일 후 Ctrl 또는 iKO TA 근육에 주입되었습니다.2 손상 및 근육은 분석을 위해 감염 5일 후 수집되었습니다. b 왼쪽: 위의 형질감염된 세포를 24시간 동안 배양한 후 EdU로 6시간 동안 처리했습니다. EdU 양성 세포를 염색하고 정량화했습니다. 스케일 바: 50μm; n = 그룹당 3마리의 마우스. p = 0.44 및 0.0013. c 감염 후 5dpi로 수집된 위 TA 근육의 H&E 염색. 스케일 바: 50μm. n = 그룹당 4마리의 마우스. d 위의 TA 근육에 대해 eMyHC(빨간색)와 Laminin(녹색)의 IF 염색을 수행했습니다. 스케일 바: 50μm. e 뷰당 eMyHC+ 섬유의 수가 정량화되었습니다. n = 그룹당 4마리의 마우스. 왼쪽에서 오른쪽으로, p = 0.20, 0.00081, 0.052 및 0.012. f 왼쪽: 위의 TA 근육에 Pax7(빨간색)과 Laminin(녹색)의 IF 염색이 수행되었습니다. 스케일 바: 50μm. 오른쪽: 뷰당 Pax7+ 셀 수가 정량화되었습니다. n = 그룹당 4마리의 마우스. 왼쪽에서 오른쪽으로, p = 0.33, 0.041, 0.67 및 0.0052. g 왼쪽: 위의 TA 근육에 Myod(빨간색)와 Laminin(녹색)의 IF 염색이 수행되었습니다. 스케일 바: 50μm. 오른쪽: 뷰당 Myod+ 세포 수가 정량화되었습니다. n = 그룹당 4마리의 마우스. 왼쪽에서 오른쪽으로, p = 0.0053, 0.0058, 0.12 및 0.020. 모든 막대 그래프는 평균 ± SD로 표시됩니다. 재학생 t 검정(양측 비대응)을 사용하여 통계적 유의성을 계산했습니다(b, e-g): *p < 0.05, **p < 0.01, ***p < 0.001. ns는 중요하지 않습니다. 소스 데이터는 소스 데이터 파일로 제공됩니다.
H2B 손실은 DNA 손상과 노화를 증가시킵니다. Atf3 iKO SC
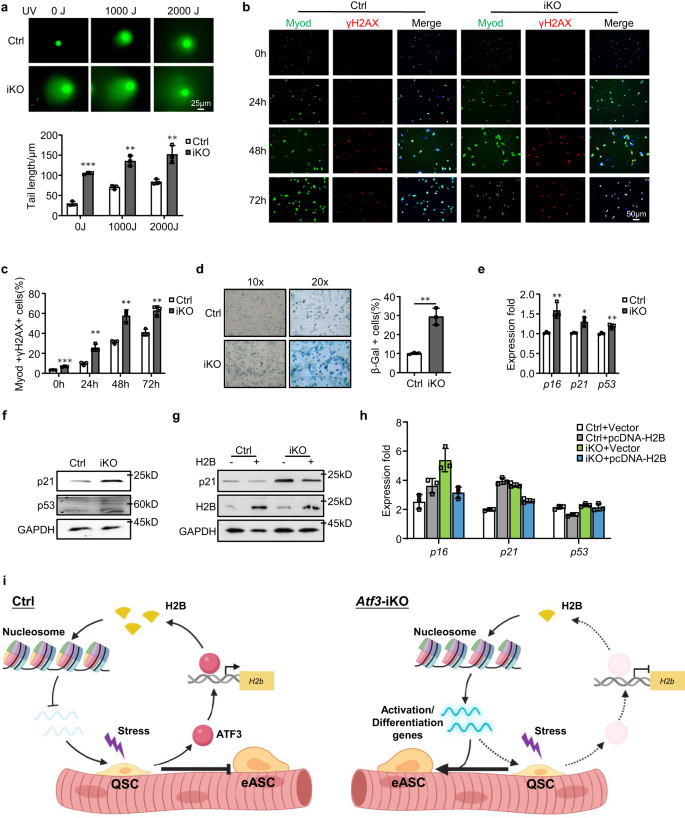
SC에서 H2B 손실의 결과를 더 자세히 설명하기 위해 히스톤 단백질이 염색질 무결성 및 게놈 안정성에 중요하다는 점을 고려하여 게놈 불안정성과 세포 노화를 조사했습니다.57,59. iKO 또는 Ctrl 근육의 FISC를 다양한 용량(0, 1000 또는 2000J)의 UV 광으로 처리하고 혜성 분석을 수행했습니다. 실제로 Ctrl에 비해 iKO의 세 가지 복용량 모두에서 혜성 꼬리 길이의 상당한 증가가 관찰되었습니다(그림 XNUMX). 9a), 이는 H2B 감소가 게놈 불안정성을 유발함을 시사합니다. 이는 Ctrl에 비해 배양된 iKO 세포에서 훨씬 더 높은 비율의 γH2AX+ 세포에 의해 추가로 확인되었습니다(그림 XNUMX). 9b, c). 게놈 불안정성이 세포 노화로 이어지는지 조사하기 위해 세포를 성장 배지에서 9일 동안 배양하고 β-Gal 염색을 수행했습니다. iKO에서는 Ctrl에 비해 β-Gal+ 세포가 19% 증가한 것으로 나타났습니다(그림 XNUMX). 9d). 지속적으로 상당한 상향 조정이 이루어지고 있습니다. p16, p21및 p53 mRNA(그림. 9e) 그리고 더 높은 수준의 p21 및 p53 단백질도 iKO에서 검출되었습니다(그림 XNUMX). 9f). 위의 결과는 H2B 손실이 게놈 불안정성과 세포 노화를 증가시킨다는 것을 보여줍니다. Atf3 iKO 세포. 예상대로, iKO 세포에서의 H2B 과발현은 감소된 p21 단백질에 의해 평가된 바와 같이 DNA 손상 축적을 감소시키고 세포 노화를 억제했습니다(그림 XNUMX). 9g) 만큼 잘 p16, p21 과 p53 mRNA(그림. 9h). 이러한 결과는 H2B 발현 감소로 인해 SC가 복제 노화를 겪는다는 것을 나타냅니다.
a 0, 1000 또는 2000J UV 처리 후 Ctrl 또는 iKO SC에서 Comet 분석을 수행했습니다. 스케일 바: 25μm. n = 그룹당 3마리의 마우스. p = 0.000029, 0.0012, 0.0071. b γH2AX(적색) 및 Myod(녹색)의 IF 염색은 0, 24, 48 또는 72시간 동안 배양한 후 Ctrl 또는 iKO 생쥐의 SC에서 수행되었습니다. 스케일 바: 50μm. c Myod+/γH2AX+ 세포의 백분율 정량화; n = 그룹당 3마리의 마우스. p = 0.00014, 0.0024, 0.0021 및 0.0031. d 9일 동안 배양한 후 Ctrl 또는 iKO 마우스의 SC에서 β-Gal(파란색) 염색을 수행했습니다. n = 그룹당 3마리의 마우스. p = 0.0017. e 다음을 포함하는 선별된 노화 표지 유전자의 발현 p16, p21 과 p53 Ctrl 및 iKO의 SC에서 RT-qPCR로 정량화했습니다. p = 0.0078, 0.011 및 0.0061. f p21 및 p53 단백질 수준은 Ctrl 및 iKO 생쥐의 SC에서 Western blotting으로 검출되었습니다. GAPDH는 로딩 컨트롤로 사용되었습니다. g, h Ctrl 및 iKO 생쥐의 SC를 H2B 과발현 또는 벡터 제어 플라스미드로 형질 감염시켰습니다. 형질감염 96시간 후, 표시된 유전자의 발현이 웨스턴 블롯팅 및 RT-qPCR에 의해 검출되었습니다. GAPDH는 로딩 컨트롤로 사용되었습니다. i SC 조숙한 활성화를 방지하는 ATF3의 기능적 역할을 묘사하는 도식 모델. 항상성 근육에서는 가벼운 스트레스에 대한 ATF3의 급속한 유도가 H2b 적절한 뉴클레오솜 위치를 유지하고 활성화 유전자의 발현을 억제하여 SC의 조숙한 활성화를 방지합니다. ATF3 손실 시 H2B 결핍이 발생하여 뉴클레오솜 위치 지정이 변경되고 활성화 유전자가 상향 조절되어 SC가 정지 상태를 깨고 초기 활성화 단계에 진입하게 됩니다. BioRender.com으로 제작되었습니다. 모든 막대 그래프는 평균 ± SD로 표시됩니다. 재학생 t 검정(양측 비대응)을 사용하여 통계적 유의성을 계산했습니다(a, c-e): *p < 0.05, **p < 0.01, ***p < 0.001. ns는 중요하지 않습니다. 소스 데이터는 소스 데이터 파일로 제공됩니다.
SC 및 재생에서 다른 기능적 AP-1 제품군 구성원 스크리닝
SC에서 ATF3의 기능과 메커니즘을 위에서 전체적으로 특성화한 후, 우리는 ATF1, FOS, FOSB 및 JUNB와 같은 다른 AP-4 계열 TF도 유사한 점을 고려하여 SC에서 기능적 역할을 수행하는지 질문하여 연구를 확장하려고 했습니다. SC 초기 활성화 동안 빠르고 일시적인 유도 역학(그림 XNUMX) 1b~d 과 S1C). 아이디어를 테스트하기 위해 최근 개발된 팍스7Cas9/AAV-sgRNA 매개 생체 내 게놈 편집 플랫폼64이는 Cre 의존성 Cas9 녹인 마우스 및 AAV 매개 sgRNA 전달을 기반으로 합니다. 간략하게, 각 TF를 표적으로 하는 한 쌍의 sgRNA가 선택되어 AAV9 바이러스 입자로 패키징되었습니다. 4×1011 AAV9-sgRNA의 바이러스 게놈(vg)/마우스를 TA 근육에 근육내(IM) 주사했습니다. 팍스7Cas9 출생 후(P) 연령 10일(P10)의 마우스. 대조군(Ctrl) 그룹의 경우, sgRNA 삽입 없이 pAAV9-sgRNA 벡터 골격을 포함하는 동일한 용량의 AAV9 바이러스를 주입했습니다. 그런 다음 XNUMX주 후에 SC 분리 및 분석을 위해 마우스를 희생시켰습니다(그림 XNUMX). S8a). XNUMX개의 TF 모두에 대해 성공적인 DNA 편집 효율성이 확인되었습니다(보충 그림 XNUMX). 8b–e); 일관되게 각 단백질의 다양한 수준(52.4%~83.6%)의 녹다운(KD)이 WB에 의해 감지되었습니다(보충 그림 XNUMX). 7b–e) 또는 IF(보조 그림. 8f) 변경되지 않은 mRNA 수준에도 불구하고 (보충 그림 XNUMX) 8g).
SC 활성화에 대한 위의 AP-1 TF KD의 효과를 조사하기 위해 각 돌연변이의 FISC를 시험 관내 EdU 분석을 위해 배양했습니다 (보충 그림 XNUMX). 8a). 비슷하다 Atf3 KO, Fos-KD 세포는 SC 활성화가 가속화된 반면 준비-KD는 활성화가 무뎌진 것으로 나타났습니다. 그만큼 Atf4 or FosB반면에 KD는 아무런 영향을 미치지 않았습니다(보충 그림 XNUMX). 8h). 약 7개월 된 손상되지 않은 근육에서 Pax2+ 세포를 측정했을 때 흥미롭게도 근육 수의 감소가 관찰되었습니다. Atf4, Fos or 준비-KD(보조 그림. 8i), 이는 SC 풀의 손실을 암시합니다. 이후 Atf4 or 준비-KD는 조숙한 SC 활성화로 이어지지 않았으며, 출생 후 단계에서 매우 초기에 삭제가 발생한 것을 고려하면 SC 번호 손실은 다른 이유로 인해 발생할 수 있습니다.64. 그만큼 FosB-KD는 Pax7+ SC 풀에 아무런 영향을 미치지 않았습니다.
근육 재생 능력에 미치는 영향을 더 조사하기 위해 BaCl2 AAV 주사 7주 후에 주사했습니다(보충 그림 XNUMX). 8a) 재생은 H&E에 의해 평가되었습니다(보조 그림 XNUMX). 8j), eMyHC(보조 그림. 8k), Pax7(보조 그림. 8l) 및 MyoD (보조 그림 XNUMX) 8m) 5dpi로 염색. 손상된 재생이 밝혀졌습니다. Atf4 과 포스-KD는 아마도 장기간 삭제 후 SC가 소진되었기 때문일 것입니다. 에서의 재생 준비-KD도 SC 풀 감소로 인해 손상되었을 수 있습니다. 지속적으로, 재생에 대한 영향은 관찰되지 않았습니다. FosB-KD. 전체적으로, 이들 AP-1 계열 구성원이 SC 활성화 및 근육 재생에서 다양한 기능을 수행할 수 있다는 결과가 나왔습니다.
- SEO 기반 콘텐츠 및 PR 배포. 오늘 증폭하십시오.
- PlatoData.Network 수직 생성 Ai. 자신에게 권한을 부여하십시오. 여기에서 액세스하십시오.
- PlatoAiStream. 웹3 인텔리전스. 지식 증폭. 여기에서 액세스하십시오.
- 플라톤ESG. 자동차 / EV, 탄소, 클린테크, 에너지, 환경, 태양광, 폐기물 관리. 여기에서 액세스하십시오.
- PlatoHealth. 생명 공학 및 임상 시험 인텔리전스. 여기에서 액세스하십시오.
- 차트프라임. ChartPrime으로 트레이딩 게임을 향상시키십시오. 여기에서 액세스하십시오.
- BlockOffsets. 환경 오프셋 소유권 현대화. 여기에서 액세스하십시오.
- 출처: https://www.nature.com/articles/s41467-023-40465-w