(나노 워크 뉴스) 종양 세포에 화학요법 약물을 전달하는 최선의 방법을 찾는 것은 까다로울 수 있습니다. 이상적으로, 치료법은 건강한 세포는 그대로 두고 종양 세포를 표적으로 삼는 것입니다. 면역리포솜이 답이 될 수 있습니다. 그들은 표면 표적 리간드를 통해 종양 세포 표면의 항원에 효율적으로 결합할 수 있어 종양 세포가 "독"을 흡수할 수 있는 충분한 시간을 허용합니다. 암 치료에서 면역리포솜의 이점은 지난 1981년 동안 광범위하게 문서화되었습니다. 그러나 면역리포좀 약물은 XNUMX년 이후 실험실에서 시연되었음에도 불구하고 아직 시장에 출시되지 않았습니다. 이유는 무엇입니까? 주요 장벽 중 하나는 대규모, 저비용이지만 실행 가능한 제조 기술이 부족하다는 것입니다. 일반에 표적화 리간드 접목 리포좀 면역리포솜을 형성하려면 약 6개의 단계가 필요하며 잠재적인 문제가 발생할 수 있습니다. Binghamton University의 Thomas J. Watson 공학 및 응용과학 대학 부교수인 Yuan Wan은 최근 저널에 연구 결과를 발표했습니다. 자연 나노 기술 (“자기조립에 의한 키메라 나노바디로 장식된 리포솜”) 면역리포좀 제조를 위한 1단계 제조 공정의 개요를 설명합니다. 화학적 결합 및 관련 화학시약이 필요하지 않아 친환경적입니다.
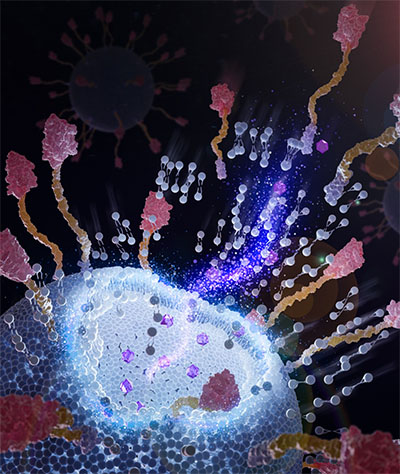 면역리포솜 표면의 키메라 나노바디는 종양 세포에 부착되어 더 나은 약물 전달을 촉진할 수 있습니다. (이미지: 연구원 제공) "면역리포좀의 전통적인 제조 과정은 상대적으로 복잡합니다"라고 생의학 공학과 교수인 Wan이 말했습니다. “많은 화학적 결합과 정제가 필요합니다. 화학적 접합과 필요한 시약은 표적화 리간드의 안정성과 항원 결합을 손상시킵니다. 다단계 프로세스로 인해 페이로드 누출 및 제품 손실이 발생합니다. 따라서 면역리포좀은 낮은 수율, 높은 생산 비용 및 배치 간 변동 위험이 높기 때문에 산업 제조업체에게는 덜 매력적입니다. 이러한 단점은 면역리포좀의 상업적 생산과 임상적 사용을 방해합니다.” Wan의 연구가 다른 점은 "끈적끈적한" 끝부분을 가진 조작된 키메라 나노바디를 추가했다는 것입니다. 2,500개 이상의 나노바디가 인간의 머리카락보다 약 100배 작은 단일 1,000나노미터 리포솜 외부에 통합될 수 있습니다. 이 방법은 기존 방법보다 더 쉽고 빠르며 저렴하며 최종 제품을 더 잘 제어할 수 있습니다. 표면 나노바디는 또한 리포솜 주위에 보호층을 형성하여 신체에서 너무 빨리 제거되는 것을 방지하고 혈류에 더 오래 머물 수 있도록 도와줍니다. 또 다른 큰 장점은 이 방법에 가혹한 화학 물질이 필요하지 않다는 것입니다. 전통적인 방법에서는 종종 폴리에틸렌 글리콜(PEG)이라는 물질을 사용하는데, 이는 때때로 환자에게 문제를 일으킬 수 있으며 심지어 사망까지 초래할 수 있습니다. 이러한 우려 때문에 연방 식품의약국(FDA)은 PEG가 포함된 약물에 대해 추가 모니터링을 요구합니다. “우리가 발견한 정말 흥미로운 점은 이러한 키메라 나노바디가 지질 이중층에 삽입되면 실제로 전체 면역리포솜의 강성과 열 안정성이 증가한다는 것입니다. 따라서 내부에 포장된 약물은 누출 없이 10개월 동안 잘 버틸 수 있습니다.”라고 Wan은 말했습니다. 이미 사용 중인 일반 리포솜 약물이 약 20개이기 때문에 Wan은 추가 연구와 의학적 실험을 통해 면역리포솜을 제조하고 임상 용도로 연방 승인을 받을 수 있기를 희망합니다. “우리는 또한 생산량을 최소 30배로 늘리기 위해 새로운 키메라 나노바디를 개발하기 위해 노력하고 있습니다. 이는 이러한 키메라 나노바디의 제조 비용을 훨씬 낮추게 만들 것입니다.” 완이 말했다.
면역리포솜 표면의 키메라 나노바디는 종양 세포에 부착되어 더 나은 약물 전달을 촉진할 수 있습니다. (이미지: 연구원 제공) "면역리포좀의 전통적인 제조 과정은 상대적으로 복잡합니다"라고 생의학 공학과 교수인 Wan이 말했습니다. “많은 화학적 결합과 정제가 필요합니다. 화학적 접합과 필요한 시약은 표적화 리간드의 안정성과 항원 결합을 손상시킵니다. 다단계 프로세스로 인해 페이로드 누출 및 제품 손실이 발생합니다. 따라서 면역리포좀은 낮은 수율, 높은 생산 비용 및 배치 간 변동 위험이 높기 때문에 산업 제조업체에게는 덜 매력적입니다. 이러한 단점은 면역리포좀의 상업적 생산과 임상적 사용을 방해합니다.” Wan의 연구가 다른 점은 "끈적끈적한" 끝부분을 가진 조작된 키메라 나노바디를 추가했다는 것입니다. 2,500개 이상의 나노바디가 인간의 머리카락보다 약 100배 작은 단일 1,000나노미터 리포솜 외부에 통합될 수 있습니다. 이 방법은 기존 방법보다 더 쉽고 빠르며 저렴하며 최종 제품을 더 잘 제어할 수 있습니다. 표면 나노바디는 또한 리포솜 주위에 보호층을 형성하여 신체에서 너무 빨리 제거되는 것을 방지하고 혈류에 더 오래 머물 수 있도록 도와줍니다. 또 다른 큰 장점은 이 방법에 가혹한 화학 물질이 필요하지 않다는 것입니다. 전통적인 방법에서는 종종 폴리에틸렌 글리콜(PEG)이라는 물질을 사용하는데, 이는 때때로 환자에게 문제를 일으킬 수 있으며 심지어 사망까지 초래할 수 있습니다. 이러한 우려 때문에 연방 식품의약국(FDA)은 PEG가 포함된 약물에 대해 추가 모니터링을 요구합니다. “우리가 발견한 정말 흥미로운 점은 이러한 키메라 나노바디가 지질 이중층에 삽입되면 실제로 전체 면역리포솜의 강성과 열 안정성이 증가한다는 것입니다. 따라서 내부에 포장된 약물은 누출 없이 10개월 동안 잘 버틸 수 있습니다.”라고 Wan은 말했습니다. 이미 사용 중인 일반 리포솜 약물이 약 20개이기 때문에 Wan은 추가 연구와 의학적 실험을 통해 면역리포솜을 제조하고 임상 용도로 연방 승인을 받을 수 있기를 희망합니다. “우리는 또한 생산량을 최소 30배로 늘리기 위해 새로운 키메라 나노바디를 개발하기 위해 노력하고 있습니다. 이는 이러한 키메라 나노바디의 제조 비용을 훨씬 낮추게 만들 것입니다.” 완이 말했다.
- SEO 기반 콘텐츠 및 PR 배포. 오늘 증폭하십시오.
- PlatoData.Network 수직 생성 Ai. 자신에게 권한을 부여하십시오. 여기에서 액세스하십시오.
- PlatoAiStream. 웹3 인텔리전스. 지식 증폭. 여기에서 액세스하십시오.
- 플라톤ESG. 탄소, 클린테크, 에너지, 환경, 태양광, 폐기물 관리. 여기에서 액세스하십시오.
- PlatoHealth. 생명 공학 및 임상 시험 인텔리전스. 여기에서 액세스하십시오.
- 출처: https://www.nanowerk.com/nanotechnology-news3/newsid=64839.php



