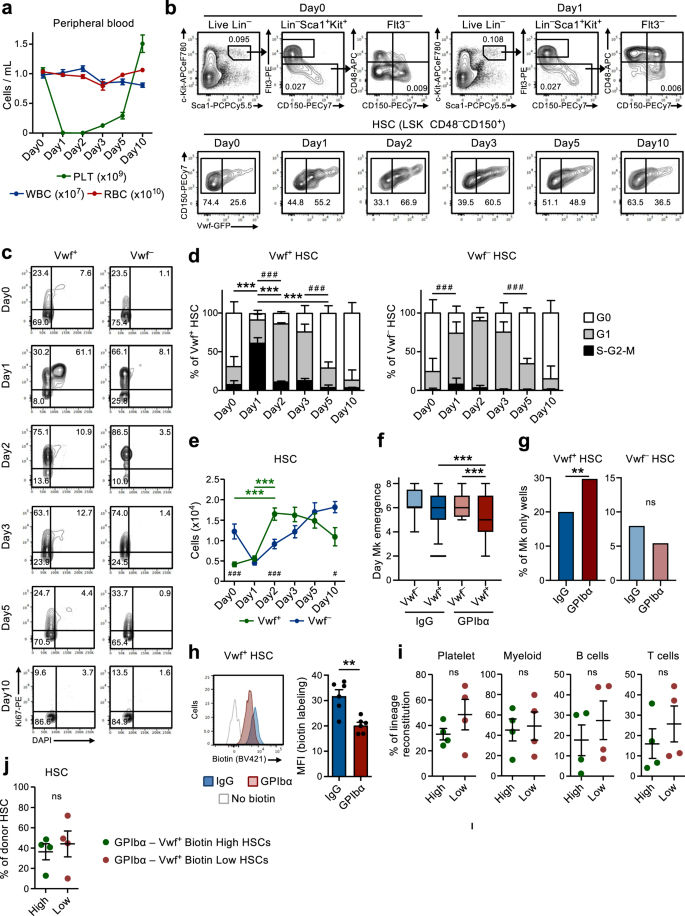
급성 혈소판 고갈은 정지 상태의 HSC를 빠르게 증식시킵니다.
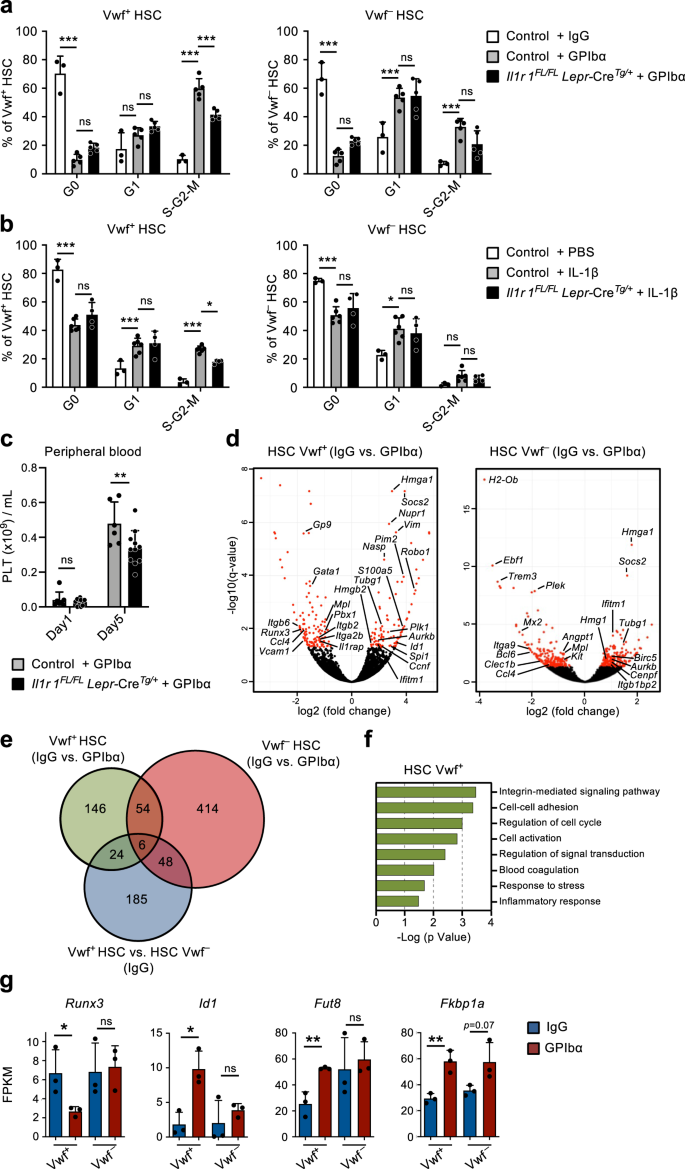
이전 연구에 따라9, 항-GPIbα 항체를 단회 투여한다. 폭스바겐-GFP 마우스는 면역성 혈소판감소자색반증(ITP) 환자에서 관찰되는 혈소판감소증을 모방하기 위해 다른 혈액 세포 계통에 큰 영향을 주지 않으면서 1일 동안 혈소판을 빠르고 효율적으로 고갈시켰습니다(그림 XNUMX). 1a). 이는 Lin의 빠른(1일 이내) 세포 주기 활성화를 동반했습니다.-스캐1+c-키트+ (LSK) Flt3-CD48-CD150+ HSC. 활성 세포 주기로의 모집은 다음에서 우선적으로 관찰되었습니다. 폭스바겐-GFP+ (폭풍+) HSC 구획(그림. 1b~d), 이는 혈소판 편향 HSC가 풍부하지만 주로 HSC를 재구성하는 다중 계통을 포함합니다.9,18. Vwf의 60% 이상이면서+ LSKFlt3-CD48-CD150+ HSC는 세포주기의 S-G2-M 단계에 들어갔습니다. 폭스바겐-GFP- (폭풍-) HSC는 S-G2-M에 진입했습니다. 그럼에도 불구하고 대부분의 VWF는- HSC는 정지 상태(G0)에서 보다 활성화된 G1 단계로 이동했습니다(그림 XNUMX). 1c, d).
(보충 그림과 관련됨. 1 과 2). a 항-GPIbα 항체 투여 후 말초 혈액 세포 매개변수의 동역학 분석. 0일째 마우스를 IgG 이소형 대조 항체로 처리하였다. 데이터는 10개의 독립적인 실험에서 얻은 0마리(Day13), 1(Day10), 2(Day9), 3(Day8), 5(Day7) 및 10(Day14) 마우스의 평균 ± SEM을 나타냅니다. PLT 혈소판, WBC 백혈구, RBC 적혈구. b 대표적인 FACS 프로필 및 게이팅 전략 폭스바겐-GFP+ (폭풍+) and 폭스바겐-GFP- (폭풍-) LSKFlt3-CD150+CD48- 혈소판 고갈 후 표시된 시점의 HSC. 게이트/사분면의 숫자는 전체 살아있는 세포(상단 패널) 또는 HSC(하단 패널) 중 게이트 세포 집단의 빈도(분석된 모든 마우스의 평균)를 나타냅니다. c, d Vwf의 세포주기 분석+ 그리고 VWF- LSKFlt3-CD150+CD48- 표시된 시점의 HSC는 혈소판 고갈 이후입니다. c Vwf의 대표적인 세포주기 FACS 프로파일+ (왼쪽)과 Vwf- (오른쪽) G0의 HSC(DAPI-키녹스-) G1(DAPI-키녹스+) 또는 S-G2-M(DAPI+키녹스+) 세포주기의 단계. 게이트의 숫자는 총 HSC의 빈도(분석된 모든 마우스의 평균)를 나타냅니다. d Vwf의 평균 ± SD 세포 주기 위상 분포+ (왼쪽)과 Vwf- (오른쪽) HSC. 5번의 독립적인 실험에서 0(Day5), 1(Day3), 2(Day5), 3(Day5), 5(Day4) 및 10(Day6) 마우스의 데이터입니다. ***p <0.001; **p S-G0.01-M 세포주기 분율의 경우 <2; # # #p G0.001 세포 주기 분획의 경우 < 1(둘 다 Tukey의 다중 비교와 함께 2원 ANOVA 사용); e Vwf의 절대 수+ 그리고 VWF- HSC(다리 2개당, 방법 참조). 8번의 독립적인 실험에서 얻은 0(Day8), 1(Day7), 2(Day5), 3(Day6), 5(Day5) 및 10(Day9) 마우스의 평균 ± SEM 데이터입니다. ***p Vwf의 경우 < 0.001+ HSC(Tukey의 다중 비교를 사용한 양방향 ANOVA); #p <0.05 및 # # #p Vwf 비교를 위한 < 0.001+ 대 VWF- HSC(Sidak의 다중 비교를 사용한 양방향 ANOVA). 첫 번째 Mk의 출현 시간 (f) 및 Mk 세포만 있는 콜로니의 빈도(g) 배양된 단일 Vwf에서-또는 VWF+ IgG 또는 GPIbα 처리 16시간 후 마우스에서 분리된 HSC. 138개, 364개, 147개 및 451개 단일 세포 유래 콜로니의 데이터는 5번의 독립적인 실험에서 4번의 생물학적 복제를 통해 각각 분석되었습니다. f 가운데 선은 중앙값을 나타내고, 상자 한계는 25~75 백분위수를 나타내고, 수염은 5~95 백분위수를 나타냅니다. 5-95 백분위수 외부의 셀은 이상값으로 표시됩니다. P Dunn의 다중 비교를 사용한 Kruskal-Wallis 테스트로 계산된 값. g P 양측 Fisher의 정확 검정으로 계산된 값입니다. ***p <0.001; **p < 0.01; *p < 0.05; ns, 중요하지 않음(p > 0.05). h 비오틴 증식 분석 폭스바겐-GFP+ HSC는 IgG 또는 GPIbα 치료 2일 후입니다. 6번의 독립적인 실험에서 그룹당 3마리의 마우스로부터 얻은 대표 플롯(왼쪽) 및 평균 ± SD MFI(비오틴 표지 제어 없음의 MFI에 대해 정규화됨, 오른쪽). **p < 0.01; 양측 t-검정으로 계산되었습니다. 혈액 내 혈소판, 골수 및 림프 세포 계통의 장기 재구성(16주)(i) 및 BM HSC 구획(j) 비오틴 높음 및 비오틴 낮음 폭스바겐-GFP+ 혈소판 고갈 후 2일째의 HSC 분획. 마우스당 50개의 세포가 이식되었습니다. 데이터는 4회의 독립적인 실험에서 2명의 기증자의 평균 ± SEM을 나타냅니다. 각 점은 기증자당 이식된 수용자 마우스 2마리의 평균을 나타냅니다. ns, 중요하지 않음(p > 0.05); 양측 t-검정으로 계산됩니다. 보충 그림도 참조하십시오. 1 과 2.
다음으로 우리는 혈소판 고갈 후 관찰된 HSC 활성화에 대한 기계적 기초를 더 탐구하려고 했습니다. 항-GPIbα 항체는 트롬빈 및 VWF 수용체인 GPIbα(CD42b)에 결합합니다.19, Fc 수용체 독립적 방식으로 혈소판 활성화, 탈시알화 및 후속 제거로 이어짐20. GPIbα는 MkP를 포함하여 거핵구(Mk)-혈소판 계통에서 특이적으로 발현되지만 중요한 것은 우리 연구와 이전에 다른 사람들이 보고한 바와 같습니다21, GPIbα 발현은 HSC에서 사실상 감지할 수 없습니다(보충 그림 XNUMX). 1a). 초기 혈소판 고갈 이후 혈소판 수는 서서히 회복되었으며, 고갈 후 5~10일 사이에 정상적인 혈소판 수가 다시 확립되었습니다(그림 XNUMX). 1a). 특히, 이러한 혈소판 고갈로 인해 Vwf 수가 4배 증가했습니다.+ LSKFlt3-CD48-CD150+ HSC는 2일, Vwf는- HSC는 초기 감소 후 느린 동역학으로 증가했습니다(그림 XNUMX). 1e). 그 후, Vwf+/VWF- HSC 비율과 절대 수치는 혈소판 수치의 정상화와 함께 점차적으로 정상으로 돌아왔습니다(그림 XNUMX). 1a, 전자). Vwf의 증가+ HSC는 또한 LSK Flt3 수의 선택적 증가를 동반했습니다.-CD48+CD150+ MPP의 하위 집합(그림 XNUMX) 1b 및 보충 그림 1b)는 Mk 편향된 것으로 표시됨22. 게다가 MkP23 또한 Vwf가 증가한 지 며칠 후에 크게 증가했습니다.+ HSC는 적혈구계(Pre-CFU-E)와 골수성(GMP) 전구세포에는 크게 영향을 미치지 않았습니다(보충 그림 XNUMX). 1c, d). 주목할 점은 강력한 GPIbα 발현에도 불구하고 항체가 혈소판 고갈을 초래하는 Fc 독립적 메커니즘과 일치한다는 점입니다.20, MkP는 초기에 약간 (크게는 아니지만) 감소한 반면 Mks는 항체 투여에 의해 BM에서 고갈되지 않았습니다 (보충 그림 XNUMX). 1d–g). 신속한 초기 활성화 이후, HSC는 혈소판 고갈 후 이미 5일에 관찰되는 표준화된 세포 주기 위상 분포와 함께 빠르게 다시 정지 상태로 돌아왔습니다(그림 XNUMX). 1c, d). 대체 단일클론 항체(NIT E)20 고갈된 혈소판 및 활성화된 Vwf+ 그리고 VWF- HSC 세포 주기는 항-GPIbα 항체와 유사한 방식으로 진행됩니다(보충 그림 XNUMX). 2a, b). GPIbα 항체 치료는 Vwf 수가 증가한 경미하고 일시적인 비장종대를 동반했습니다.+ 하지만 Vwf는 아니야- 비장의 HSC(보충 그림 XNUMX) 2c, d).
정지 LSKFlt3 모집-CD48-CD150+ 급성 혈소판 활성화 및 고갈 시 BM 세포의 증식은 정지 HSC가 모집되어 Mk 및 혈소판 항상성을 재설정하는 피드백 메커니즘의 존재를 의미합니다. 혈소판이 고갈된 생쥐의 HSC가 Mks 생성에 더 효율적인지 조사하기 위해 단일 세포 Mk/GM 시험관 분화 분석을 사용했습니다. 단일 Vwf의 클론원성+ 또는 VWF- LSKFlt3-CD48-CD150+ 항상성(IgG) 또는 혈소판 고갈(GPIbα) 상태의 생쥐에서 분리된 HSC는 유사했습니다(~80%; 보충 그림 XNUMX). 2e). 그러나 단일 Vwf+ 혈소판이 고갈된 생쥐에서 분리한 HSC는 Vwf보다 Mks로 더 빨리 분화되었습니다.- 혈소판이 고갈된 생쥐 또는 Vwf의 HSC+ 항상성 상태에 있는 쥐로부터 분리된 HSC(그림 XNUMX). 1f) 또한 Mks로만 구성된 더 많은 수의 콜로니를 생성했습니다(그림 XNUMX). 1g 및 보충 그림 2f,g). 표현형적으로 HSC와 유사한 줄기형 Mk 커밋 전구세포는 이전에 폴리(I:C) 유발 혈소판 감소증에 반응하여 증식하는 것으로 나타났습니다.24. 따라서 LSKFlt3을 보다 확실하게 확립하려면-CD48-CD150+ 항-GPIbα 유도 혈소판 고갈에 반응하여 증식하도록 유도된 BM 세포에는 진정한 장기 재증식 HSC가 포함되며, 우리는 독시사이클린 유도성(tet-ON) H2B-mCherry 마우스를 사용했습니다.6,25. 이 시스템에서 독시사이클린 처리 펄스는 mCherry로 표지된 히스톤을 뉴클레오솜에 통합시켜 세포가 증식할 때 딸세포 간에 균등하게 나눕니다. 세포주기 분석과 일치합니다 (그림 XNUMX). 1c, d), 항-GPIbα 유도 혈소판 고갈은 3일 후 mCherry 라벨링의 희석 증가로 입증된 바와 같이 HSC의 증식을 증가시켰습니다(보충 그림 XNUMX). 2h). 중요한 것은 FACS가 mCherry를 정렬했다는 것입니다.lo (증식성) LSKFlt3-CD48-CD150+ 혈소판이 고갈된 생쥐에서 분류된 세포는 생체 내 장기(LT; 16주) 다계통 재구성 가능성을 가지고 있었습니다(보충 그림 XNUMX). 2i), 이는 항-GPIbα 유도 혈소판 고갈이 강력한 LT-HSC를 증식으로 모집한다는 것을 입증합니다. Vwf를 보다 직접적으로 비교하려면+ 혈소판 고갈 후 활성화되거나 비증식 상태로 유지되는 HSC는 모든 BM 세포의 막 단백질을 효율적으로 라벨링하는 N-하이드록실설포숙신이미드 비오틴 유도체(비오틴)의 주입을 기반으로 하는 비침습적 라벨링 방법을 사용했습니다.26. 세포가 분열할 때 표지된 막 단백질은 딸세포 사이에 균등하게 분포되어 생체 내에서 세포 분열 이력을 분석할 수 있습니다. 마찬가지로, H2B-mCherry 모델과 마찬가지로 혈소판 고갈로 인해 Vwf의 비오틴 라벨링이 감소했습니다.+ HSC(그림. 1h) 그리고 또한 Vwf의- HSC(보조 그림. 2j). Vwf의 세포주기 및 증식 분석에서 관찰된 차이점- HSC는 이전에 설명한 Vwf 간의 계층적 관계를 잠재적으로 반영할 수 있습니다.+ 그리고 VWF- HSC9. 따라서 Vwf가 확산되고 있습니다.+ HSC는 Vwf로 분화될 수 있습니다.- 비오틴 라벨 희석의 역사를 이어가는 HCS. 중요한 것은 FACS가 Vwf를 정렬했다는 것입니다.+비오틴lo (증식성) LSKFlt3-CD48-CD150+ 혈소판이 고갈된 쥐로부터 분류된 세포(보충 그림 XNUMX). 2k, 리터)는 생체 내 장기(LT; 16주) 다계통 재구성 가능성을 가지고 있었습니다(그림 XNUMX). 1i), 이는 항-GPIbα에 의해 유도된 혈소판 고갈이 강력한 LT-HSC를 증식시킨다는 것을 입증합니다. 혈소판을 강력하게 보충하는 동안 Vwf에서는 유의미한 혈소판 편향이 관찰되지 않았습니다.+ 비증식성 HSC(비오틴)와 비교하여 혈소판 고갈에 반응하여 증식하는 HSCHi) 폭스바겐+ HSC(그림. 1i). 그럼에도 불구하고, Vwf의 두 비오틴 분획물 모두+ HSC는 유사한 LT-HSC 재구성을 보여주었습니다(그림 XNUMX). 1j) Vwf를 생성하는 데 전반적으로 동일하게 효율적이었습니다.+ 그리고 VWF- HSC 구획(보조 그림. 2m). 이는 기능적으로 정의된 LT-HSC가 확산되고 Vwf의 상대적 비율이 증가한다는 사실과 일치합니다.+ 그리고 VWF- HSC는 항상성이 다시 확립되면 대체로 정상으로 돌아옵니다(그림 XNUMX). 1b, 전자).
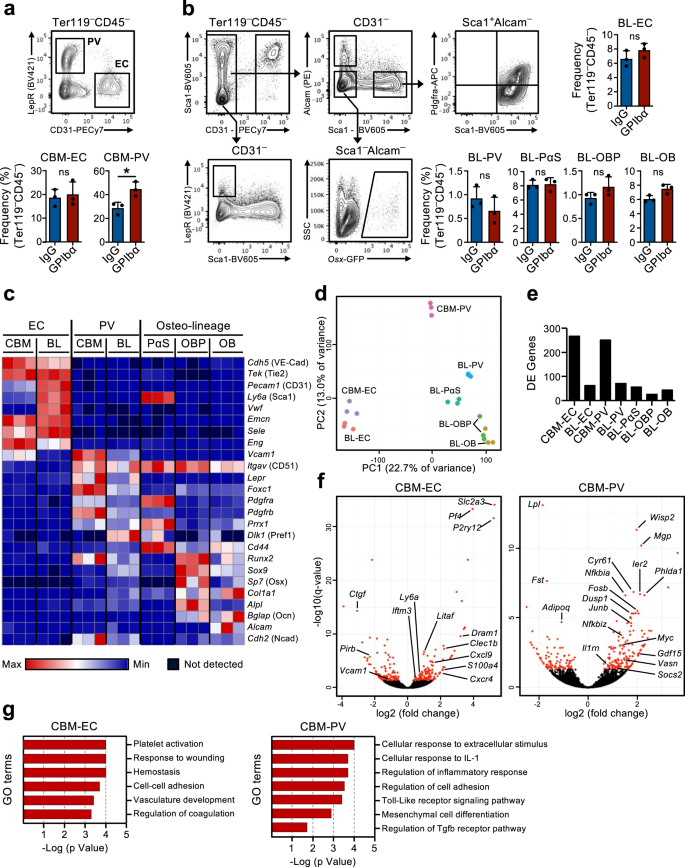
급성 혈소판 고갈에 대한 반응으로 HSC 틈새의 전사 재프로그래밍
혈소판 고갈에 반응하여 정지 HSC를 증식에 동원하는 피드백 메커니즘의 존재는 BM의 HSC가 혈소판 생산에 대한 수요를 감지할 수 있어야 함을 의미합니다. 우리는 골수의 간질 틈새 세포가 이 과정에 관여할 수 있다는 가설을 세웠습니다. 실제로 혈소판 고갈 후 BM 틈새의 변화는 이전에 제안되었습니다16,17 그러나 이러한 맥락에서 HSC 기능 조절에 특정 틈새 세포가 관여한다는 사실은 직접적으로 입증되지 않았습니다. 따라서 우리는 혈소판 고갈에 대한 HSC 반응에 관여하는 이들 세포 사이의 가능한 분자 상호 작용을 조사하기 위해 이전에 특성화 된 BM 틈새 세포 집단과 HSC의 전체 RNA 서열 분석을 사용했습니다. 이를 위해, 비조혈 세포는 기술된 두 가지 세포로부터 분리되었습니다.27,28,29 BM의 뚜렷한 해부학적 영역: 중앙 BM(CBM) 세포와 뼈 내막(BL) 세포(보충 그림 XNUMX) 3a). CD45 내에서-Ter119- BL 및 CBM 분획 모두의 비조혈 세포, 뚜렷한 틈새 세포 집단은 CD31로 정의됩니다.Hi 내피 세포 (EC) 및 CD31-문둥병자+ 혈관주위 세포(PV). BL 분획에서 우리는 CD31을 추가로 정의했습니다.-알캄-Pdgfrα+스캐1+ (PαS) 중간엽 전구세포 및 CD31-알캄-스캐1-OSX-GFP+ 조골세포 전구세포(OBP) 및 CD31-알캄+스캐1- 조골세포(OB)(그림. 2a, b). 항상성 상태 및 혈소판 고갈 후 1일에 마우스로부터 분리된 이들 세포의 유세포 분석에서는 CBM-PV 세포의 작지만 유의미한 증가 외에 세포 구성의 주요 변화가 나타나지 않았습니다(그림 XNUMX). 2a, b). RNA 서열 분석은 서로 다른 내피, 중간엽 및 HSC 집단의 뚜렷한 클러스터링을 보여주었습니다(보충 그림 XNUMX). 3b). 뚜렷한 틈새 세포 집단을 정의하는 알려진 마커의 발현(그림 XNUMX) 2c 및 보충 데이터 1) 및 유전자 발현 패턴에 따라 클러스터링된 다양한 조혈 조절제(보충 그림 XNUMX). 3c 및 보충 데이터 1), 그들의 뚜렷한 세포 정체성을 추가로 확인했습니다. 추가적으로, 틈새 세포 집단의 주성분 분석(PCA)은 주성분(PC)1 축을 따라 내피 및 중간엽 계통 세포의 분리를 보여주었고, 분화 단계에 기초하여 PC2 축을 따라 중간엽 집단의 추가 분리를 보여주었습니다(그림 XNUMX). 2d). 항상성 상태와 혈소판 고갈 후 1일째에 마우스로부터 분리한 틈새 세포를 비교하는 차등 유전자 발현 분석에서는 CBM-EC(266개 유전자) 및 CBM-PV(249개 유전자) 세포에서 차등적으로 발현되는(DE) 유전자의 수가 높은 것으로 나타났습니다(그림 XNUMX). . 2e, 에프 및 보충 데이터 2, 3). 대조적으로, 상응하는 뼈 관련 BL-EC 및 BL-PV를 포함하는 다른 틈새 집단에서는 훨씬 적은 수의 DE 유전자가 검출되었습니다(그림 XNUMX). 2e, 에프보충 그림. 3d, e 및 보충 데이터 2-4), 이는 혈소판 감소증에 대한 반응에 우선적으로 CBM 틈새 시장이 관여함을 시사합니다. CBM-EC의 DE 유전자에 대해 수행된 유전자 온톨로지(GO) 분석은 혈소판 활성화/응고와 관련된 생물학적 과정을 강조했습니다.PF4, 클렉1b, P2ry12), 스트레스에 대한 반응(Iftm3, 리타프, S100a4) 및 세포 접착 (Vcam1, Ctgf) (Fig. 2g 및 보충 데이터 5). CBM-PV DE 유전자에 대한 GO 분석은 염증, 특히 전염증성 인터루킨-1(IL-1)에 대한 세포 반응과 관련된 생물학적 과정을 보여주었습니다. 2g 및 보충 데이터 5). CBM-PV 세포에서 강조된 다른 생물학적 과정은 Toll-like 수용체(TLR)-4 신호전달인데, 이 신호전달 경로는 수용체 하류의 신호전달 경로가 IL-1 신호전달, 중간엽 분화 및 TGFβ 신호전달과 부분적으로 공유됩니다.Vasn, Fst, Wisp2, Cyr61) (Fig. 2f,g).
(보충 그림과 관련됨. 3). 중앙 골수에서 내피 세포와 간질 세포를 분류하기 위한 FACS 분석 및 게이팅 전략(CBM; a) 및 뼈 안감(BL; b) 혈소판 고갈(GPIbα 항체 치료) 1일 후 마우스의 세포 구획. 대조 마우스에는 이소타입(IgG) 대조 항체가 제공되었습니다. 막대 다이어그램은 총 비조혈 CD45 중 각 세포 집단의 평균 ± SD 빈도(%)를 나타냅니다.-Ter119- 세포. 데이터는 3개 그룹당 3마리의 마우스로부터 얻은 것입니다(a) 및 2 (b) 독립적인 실험. *p < 0.05; ns 중요하지 않음(p > 0.05); 양측 t-검정으로 평가합니다. c-g 혈소판 고갈 1일 후 생쥐의 내피/간질 세포 구획에 대한 RNA 서열 분석. c 다양한 틈새 세포 집단을 특징짓는 유전자의 발현(FPKM). d 조사된 다양한 세포 집단의 정규화된 유전자 발현에 대한 주요 성분 분석. e IgG와 GPIbα 처리된 마우스 사이의 차별적으로 발현된(DE) 유전자의 수(조정됨) p 가치 (q)<0.05), 조사된 각 틈새 세포 집단에서. f 화산 플롯과 g CBM 내피 세포 (EC) 및 Lepr에서 차별적으로 발현되는 유전자의 유전자 온톨로지 (GO) 용어 분석+ 혈관주위(PV) 세포. ~ 안에 f, 빨간색 점은 유의미한 DE 유전자를 나타냅니다(q < 0.05. 모든 패널의 데이터는 3개의 독립적인 실험에서 얻은 2개의 생물학적 복제물의 평균 ± SD FPKM을 나타냅니다. OB 조골세포, OBP 조골세포 전구세포, PαS Pdfgrα+스캐1+ 중간엽 전구세포. 보충 그림도 참조하십시오. 3.
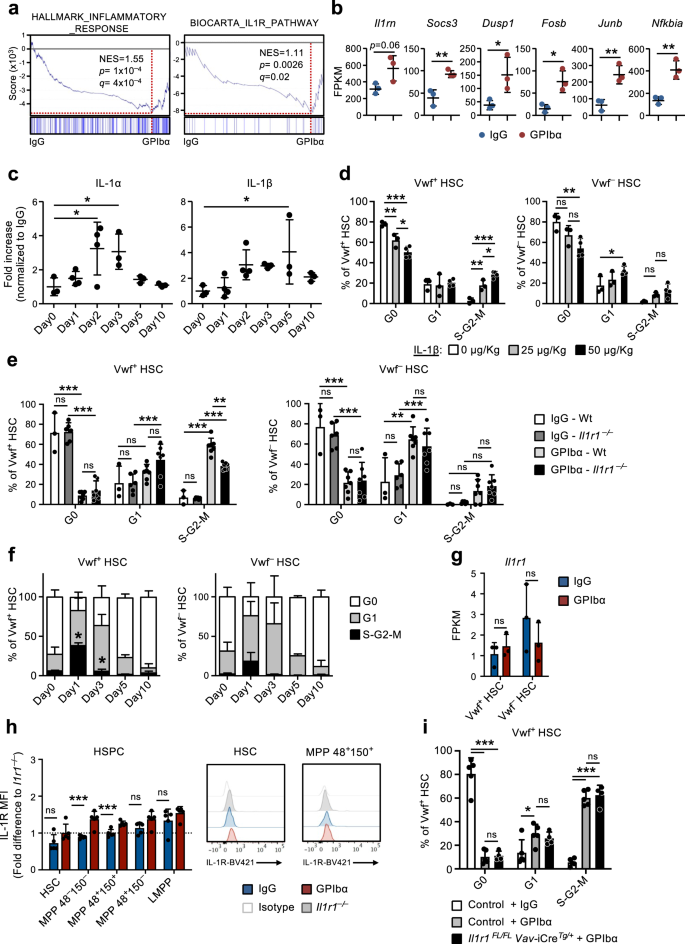
비조혈 세포에서의 IL-1 신호전달은 혈소판 고갈에 대한 HSC 반응에 중요합니다
유전자 세트 농축 분석(GSEA)을 통해 GPIbα 처리 마우스에서 분리한 CBM-PV 세포에서 관찰된 염증 반응 및 IL-1 수용체 신호 전달과 관련된 유전자의 농축이 확인되었습니다(그림 XNUMX). 3a). 이 유전자에는 다음이 포함됩니다. Il1rn (IL-1 표적 유전자 및 IL-1 신호전달 경로 길항제), Socs3 과 Dusp1 (IL-1 신호전달 경로의 조절자) 및 포스브, 준브 과 은프비아 (IL-1 신호전달 캐스케이드의 하류에서 활성화된 경로의 구성요소) 3b). 이 과정에서 무균 염증의 역할을 추가로 조사하기 위해 우리는 GPIbα 처리 마우스의 BM 세포외액에서 다양한 전염증성 사이토카인의 수준을 분석했습니다. 이 분석은 혈소판 고갈 후 IL-1α와 IL-1β 모두의 수준이 상당히 증가한 것으로 나타났습니다(그림 XNUMX). 3c), 동역학은 Vwf의 확장 및 후속 정규화와 평행합니다.+ HSC(그림. 1e). TNFα에 대해서도 유사한 초기 증가가 나타났지만 이는 Vwf가 발생한 시간 이후에도 지속되었습니다.+ HSC 세포 주기 상태가 정상화되었습니다(보충 그림 XNUMX). 4a). 다른 염증성 사이토카인은 크게 변하지 않았거나(IL-6 및 IL-12) 혈소판 고갈 후 후기 단계(INFγ)에서 감소했습니다(보충 그림 XNUMX). 4a). 정상 상태에서 IL-1은 주로 순환 T 세포(IL-1α)와 과립구(IL-1β)에 의해 생산되는 것으로 나타났습니다.30. IL-1 발현을 분석하는 데이터세트에서 두 가지 모두 Il1a 과 Il1b HSC뿐만 아니라 다른 틈새 세포 집단에서도 대부분 감지할 수 없었습니다(보충 그림 XNUMX). 4b), 기본 Mks (보조 그림. 4c, d)가 특히 높은 표현력을 보였다. Il1a (보충 그림. 4b).
(보충 그림과 관련됨. 5). a 표시된 유전자 세트에 대한 CBM-PV 세포의 전체 유전자 발현 데이터에 대한 유전자 세트 농축 분석(GSEA). NES, 정규화된 농축 점수(또는 확장 점수). b 혈소판 고갈 후 1일째에 CBM-PV 세포에서 IL-1 신호전달 경로 관련 유전자의 발현. 데이터는 3번의 독립적 실험에서 얻은 2번의 생물학적 복제의 평균 ± SD FPKM을 나타냅니다. **p < 0.01; *p < 0.05(양측 t-검정). c 혈소판 고갈(GPIbα 항체 치료) 후 지정된 시점에 마우스로부터 분리된 골수 세포외액의 IL-1α 및 IL-1β의 평균 ± SD 수준. 대조 마우스(0일)에는 이소형(IgG) 대조 항체를 투여받았습니다. 데이터는 3번의 독립적인 실험에서 얻은 0(Day4), 1(Day4), 2(Day3), 3(Day3), 5(Day3) 및 10(Day4) 마우스에서 얻은 것입니다. *p < 0.05(Dunnett의 다중 비교를 사용한 일원 분산 분석). d Vwf의 세포주기 분석+ (왼쪽)과 Vwf- (오른쪽) 표시된 양의 IL-1β를 정맥 내 투여한 지 1일 후 마우스의 HSC. 데이터는 3회의 독립적인 실험에서 0 또는 25 μg/Kg을 투여받은 4마리 마우스와 50 μg/Kg IL-1β를 투여받은 2마리 마우스의 평균 ± SD입니다. Vwf의 세포주기 분석+ (왼쪽)과 Vwf- (오른쪽) Wt의 HSC 및 Il1r1-/- 생쥐 1일(e) 또는 HSC의 경우 Il1r1-/- 표시된 시점의 마우스(f) 혈소판 고갈 이후. e 3(IgG-Wt), 6(IgG-)의 평균 ± SD 데이터Il1r1-/-) 7(GPIbα -Wt) 및 7(GPIbα –Il1r1-/-) 5번의 독립적인 실험에서 얻은 마우스. f 6번의 독립적인 실험에서 0(Day7), 1(Day3), 3(Day3), 5(Day3) 및 10(Day4) 마우스의 평균 ± SD 빈도. *p < 0.05(Wt Vwf의 동일한 분석과 비교)+ 그리고 VWF- 그림의 HSC 1d). g, h Il1r1/IL-1R 발현 분석(h) Vwf의 RNA 서열분석(FPKM)에 의한 RNA 수준+ 그리고 VWF- HSC 및 (i) 항상성 또는 혈소판 고갈 후 1일에 마우스에서 분리된 HSPC 하위 집합의 유세포 분석에 의한 단백질 수준. h 조건당 3번의 생물학적 복제의 평균 ± SD FPKM 데이터입니다. i 동등한 세포 집단의 MFI로 정규화된 평균 형광 강도(MFI)의 평균 ± SD 데이터 Il1r1-/- 동일한 실험 내에서 분석된 마우스. 데이터는 5번의 독립적인 실험에서 조건당 2마리의 마우스로부터 얻은 것입니다. i 세포주기 분석 폭스바겐-td토마토+ 조건부 결실이 있는 생쥐의 HSC Il1r1 모든 조혈 세포에서 (Il1r1플로리다/플로리다 Vav-CreTg/+) 혈소판 고갈 후 1일. 컨트롤에는 다음이 포함됩니다. 폭스바겐-td토마토+ HSC의 Il1r1플로리다/+ Vav-CreTg/+, Il1r1+ / + Vav-CreTg/+ 과 바브-크레+ / + 마우스(IL-1R 기능 상실이 없는 유전자형을 나타냄). 데이터는 5(대조군-IgG), 5(대조군-GPIbα) 및 4(대조군-GPIbα)의 평균 ± SD 빈도를 나타냅니다.Il1r1플로리다/플로리다 Vav-CreTg/+-GPIbα) 마우스는 3번의 독립적인 실험에서 얻은 것입니다. ***p <0.001; **p < 0.01; *p < 0.05; ns 중요하지 않음(p > 0.05); 양측 t-검정 사용(b, g, h) 또는 Tukey의 다중 비교를 사용한 양방향 ANOVA(d-f, i). 보충 그림도 참조하십시오. 4.
재조합 IL-1을 마우스에 투여하면 Vwf의 세포주기가 활성화됩니다.+ 그리고 VWF- HSC(그림. 3d), Vwf와 함께+ HSC는 세포주기의 S-G2-M 단계에 더 많이 모집됩니다 (보충 그림 XNUMX). 4e), 항-GPIbα에 의해 유발된 혈소판 감소증에 반응하여 HSC 활성화를 매개하는 IL-1과 호환됩니다. 이 가설을 보다 구체적으로 조사하기 위해 우리는 IL-1R 결핍 마우스에서 혈소판 고갈을 유도했습니다.Il1r1-/-), 일반 HSC 구획이 있음30 그리고 정상적인 혈소판 수치. 중요한 것은, Il1r1-/- 생쥐는 활성 사이클링(S-G2-M) Vwf의 빈도가 크게 감소한 것으로 나타났습니다.+ 혈소판 고갈 후의 HSC(그림 XNUMX) 3e, 에프), GPIbα 처리된 야생형(Wt) 마우스와 비교. 사실 그 Il1r1 결핍은 GPIbα 치료에 대한 반응으로 HSC의 세포주기 활성화를 완전히 폐지하지 않았으며 다른 (IL-1 독립적) 메커니즘이 관련되어 있음을 시사합니다. 이에 동의하여 우리는 이전에 혈소판 고갈 후 1일째 혈청에서 THPO 수준이 증가한 것을 보여주었습니다.9. 혈소판 고갈 후 HSC 활성화에서 IL-1과 잠재적으로 시너지 효과를 발휘하는 다른 신호를 확인하기 위해 우리는 다음을 포함하여 알려진 HSC 조절 인자의 발현을 분석했습니다. Tgfb1 과 PF4, 이전에 HSC 정지에 연루됨31,32및 FGF1, 이전에 HSC 증식과 관련이 있음32. 뚜렷한 틈새 세포 집단에 대한 RNA 서열 분석을 통해 20배 이상의 상향 조절이 밝혀졌습니다. PF4 CBM-EC(보조 그림 XNUMX)에서 4f), 표현에는 변화가 없지만 Tgfb1 과 FGF1 관찰되었다. 우리는 혈소판 고갈 후 BM 세포 외액에서 이러한 조절 인자의 단백질 수준을 추가로 조사했습니다. 유전자 발현 분석에 따라 TGFβ1 및 FGF1 수준은 변경되지 않았지만 PF4는 GPIbα 매개 혈소판 고갈 후 1일에 유의하게 증가했습니다(보충 그림 XNUMX). 4g). HSC 정지 유도에서 이전에 설명한 PF4의 역할을 고려하면31,33, BM 세포 외액에서 관찰 된 PF4 수준의 증가는 혈소판 고갈 후 HSC 증식의 활성화를 설명하지 못할 것입니다.
RNA 시퀀싱 결과 매우 낮은 수준(약 1 FPKM)이 밝혀졌습니다. Il1r1 HSC의 성적표(그림. 3g). 유세포 분석에서는 HSC에서 IL-1R 단백질의 수준이 검출되지 않았으며 여러 MPP 하위 집합에서는 낮은 수준이 나타났습니다(그림 XNUMX). 3h 및 보충 그림 5a). 검출 가능한 IL-1R 발현이 부족한 것 외에도 CBM-PV에서 상향 조절된 IL-1 신호 전달 관련 유전자 중 어느 것도 Vwf에서 상향 조절되는 것으로 밝혀지지 않았습니다.+ 또는 VWF- GPIbα 처리 후 HSC(보조 그림 XNUMX) 5b). 표현형적으로 정의된 HSC에서 검출 가능한 IL-1R 발현은 관찰되지 않았지만 IL-1은 이전에 HSC를 활성화하는 것으로 제안되었습니다.30. 따라서 IL-1이 항-GPIbα에 의해 유발된 혈소판 감소증 이후 HSC의 활성화를 직접적으로 매개할 수 있는지 조사하기 위해 우리는 혈소판 고갈을 유도했습니다. Il1r1플로리다/플로리다 바브-iCreTg/+ 삭제를 목표로 하는 쥐 Il1r1 HSC를 포함한 모든 조혈 세포에 적용됩니다. Vwf의 액적 디지털 PCR 분석+ 그리고 VWF- HSC는 99% 이상의 삭제 효율성을 확인했습니다. Il1r1 두 Vwf 모두에서 Vav-iCre에 의한 floxed 대립유전자+ 그리고 VWF- HSC 하위 집합(보조 그림 5c). 우리가 생식계열에서 관찰한 것과는 반대로 Il1r1-/- 쥐(도. 3e, 에프), Il1r1플로리다/플로리다 바브-iCreTg/+ 마우스는 Vwf의 항-GPIbα에 의해 유도된 세포 주기 활성화에 동등하게 효율적인 효과를 보여주었습니다.+ Wt 마우스에서와 같은 HSC(그림 XNUMX) 3i). 함께, 이러한 결과는 HSC 또는 다른 조혈 세포를 통한 직접적인 IL-1R 신호 전달이 혈소판 고갈에 반응하여 HSC의 뚜렷한 세포 주기 활성화에 관여하지 않으며 오히려 이 과정에서 비조혈 IL-1 신호 전달의 역할을 암시한다는 것을 보여줍니다.
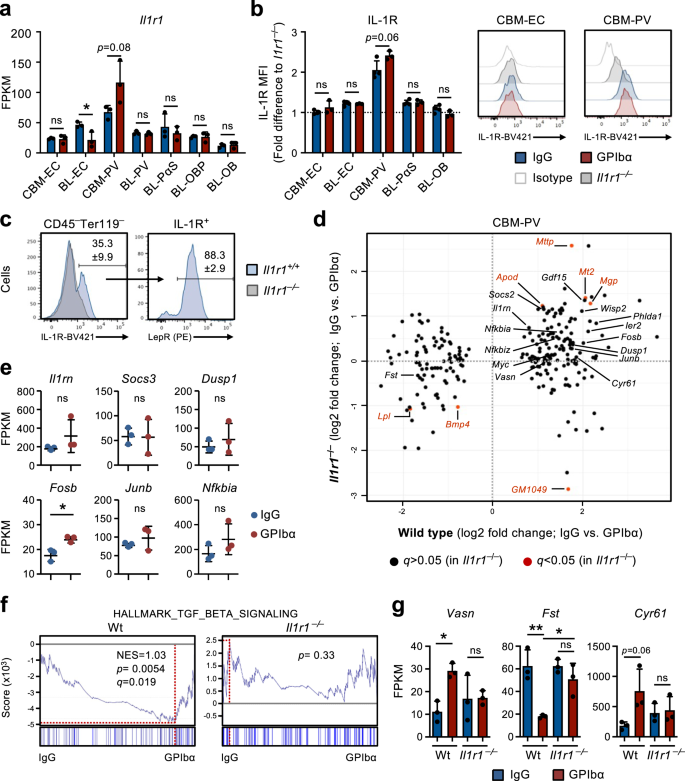
혈소판 고갈은 혈관 주위 세포에서 IL-1 신호 전달을 활성화시킵니다.
우리의 연구 Il1r1플로리다/플로리다바브-iCreTg/+생쥐와 BM 틈새 세포의 RNA 서열 분석은 HSC나 다른 조혈 세포보다는 틈새 세포에서 IL-1 신호 전달이 혈소판 고갈 후 HSC의 피드백 활성화에 역할을 할 수 있음을 시사했습니다. 틈새 세포 중에서 CBM-PV 세포가 가장 높은 전사 수준을 보였습니다. Il1r1의 식(도. 4a) 또한 뚜렷한 IL-1R 단백질 발현을 보인 반면, 다른 모든 간질/내피 세포 집단은 검출 가능한 IL-1R 세포 표면 발현에 대해 사실상 음성이었습니다(그림 XNUMX). 4b). 실제로 CBM의 거의 모든 IL-1R 발현은 Lepr에 할당될 수 있습니다.+ PV 셀(그림. 4c), 이는 다음과 같은 중요한 HSC 규제 기관의 더 높은 수준을 나타냅니다. Cxcl12 과 키틀, 골내 IL-1R과 비교-/봐라 BL-PV 셀(보조 그림 XNUMX) 3c). 중요한 것은 Wt와 CBM-PV 세포의 DE 유전자를 비교하는 것입니다. Il1r1-/- 항상성 및 GPIbα 처리 후 마우스는 혈소판 고갈 후 Wt 마우스에서 확인된 DE 유전자의 대부분이 밝혀졌습니다(그림 XNUMX 및 XNUMX). 2f 과 3b)는 혈소판이 고갈된 CBM-PV 세포에서 차별적으로 발현되지 않았습니다. Il1r1-/- 쥐(도. 4d), IL-1 신호 전달 경로의 활성화와 직접적으로 연관된 유전자를 포함합니다(그림 XNUMX). 4e). IL-1 신호전달 관련 유전자에 더하여, 우리는 TGFβ 신호전달 경로를 포함하여 HSC 증식의 외적 조절에 연루된 경로의 IL-1R 의존성 DE에 대한 증거를 발견했습니다(그림 XNUMX 및 XNUMX). 2g 과 4d, 에프, 지)34. 여기에는 바센 (Vasorin), TGFβ 신호 전달의 직접 억제제35 이전에 HSC 활성화에 연루됨36. 기타 IL-1R 의존 DE 유전자 포함 처음 (Folisatin), BMP/Activin 신호 전달의 직접 억제제37 이전에는 조혈 전구 세포로부터 Mk 분화를 억제하는 것으로 나타났습니다.38, 세포 접착 및 인테그린 결합/조절과 관련된 유전자(그림 XNUMX 및 XNUMX). 2f,g 과 4d–g).
a RNA 서열 분석 Il1r1 항상성(IgG 처리) 또는 혈소판 고갈(GPIbα 처리) 후 1일에 마우스로부터 분리된 다양한 틈새 세포에서의 유전자 발현(FPKM). 3번의 독립적인 실험에서 얻은 2번의 생물학적 복제의 평균 ± SD FPKM 데이터입니다. b, c 항상성 상태 또는 혈소판 고갈 후 1일에 마우스로부터 분리된 다양한 내피/간질 세포 집단에서의 IL-1R 발현의 유세포 분석. 동등한 세포 집단의 MFI로 정규화된 평균 형광 강도(MFI)의 평균 ± SD 데이터 Il1r1-/- 동일한 실험 내에서 분석된 마우스(b). c 나병의 빈도+ 전체 IL-1R의 PV 셀+ 항상성 상태에 있는 쥐로부터 분리된 CBM 비조혈 세포. 4번의 독립적인 실험에서 3마리(IgG) 및 2마리(GPIbα) 마우스의 데이터. d 에서 분리된 CBM-PV 세포의 RNA 서열 분석 Il1r1+ / + 과 Il1r1-/- CBM-PV-GPIbα 치료 반응 유전자의 발현을 위해 항상성 및 혈소판 고갈 후 마우스. 조건당 3번의 생물학적 복제에서 얻은 데이터입니다. e 분리된 CBM-PV 세포에서 IL-1 신호전달 경로 관련 유전자의 발현 Il1r1-/- 혈소판 고갈 후 1일째의 마우스. 조건당 3번의 생물학적 복제의 평균 ± SD FPKM 데이터입니다. 표시된 유전자 세트에 대한 전체 유전자 발현 데이터의 GSEA(f) 및 표시된 유전자의 발현(FPKM; 평균 ± SD)(g), 야생형의 CBM-PV 세포에서 Il1r1-/- 항상성 및 혈소판 고갈 후의 생쥐. 조건당 3마리의 마우스로부터 얻은 데이터. NES, 정규화된 농축 점수(또는 확장 점수). *p <0.05; **p < 0.01; ns, 중요하지 않음(p > 0.05); 양측 t-검정 사용(a, b, e) 및 Tukey'a 다중 비교를 사용한 2원 ANOVA(g).
혈관 주위 세포의 IL-1 신호 전달은 Vwf의 최적 활성화에 중요합니다.+ HSC
Vwf 활성화에서 CBM-PV 세포의 IL-1 신호 전달 역할을 보다 직접적으로 조사하기 위해+ 혈소판 감소증에 반응하여 HSC를 조건부 삭제한 생쥐에서 혈소판 고갈을 유도했습니다. Il1r1 특히 Lepr에서+ PV 셀(보조 그림. 5d). Il1r1플로리다/플로리다문둥병자-크레Tg/+ 생쥐는 활성 사이클링(S-G2-M) Vwf가 크게 감소한 것으로 나타났습니다.+ 항-GPIbα 처리 대조군 마우스와 비교한 HSC(그림 XNUMX). 5a). 세포주기 활성화의 감소는 결실된 생식계열에서 관찰된 것과 비슷했습니다. Il1r1-/- 쥐(도. 3e, 에프), Lepr을 지원합니다+ CBM-PV 세포는 Vwf의 IL-1R 의존성 활성화에 관여하는 주요 세포입니다.+ 항-GPIbα에 의해 유발된 혈소판 감소증에 반응하는 HSC. 이러한 발견을 확증하기 위해 재조합 IL-1을 투여했습니다. Il1r1플로리다/플로리다문둥병자-크레Tg/+ 쥐로 인해 Vwf 모집이 감소했습니다.+ HSC를 활성 S-G2-M으로 전환합니다(그림 XNUMX). 5b). 또한, 특정 삭제 Il1r1 레프르에서+ PV 셀은 혈소판 고갈 후 혈소판 회복에 작지만 상당한 지연을 가져왔습니다(그림 XNUMX). 5c).
(보충 그림과 관련됨. 6). a-c 조건부 삭제 마우스 분석 Il1r1 레프르에서+ 혈관주위세포(Il1r1플로리다/플로리다 레프-CreTg/+) 혈소판 고갈 후 생쥐. 컨트롤에는 다음이 포함됩니다. Il1r1플로리다/+ 레프-CreTg/+, Il1r1+ / + 레프-CreTg/+, Il1r1플로리다/플로리다 레프-CreTg/+ (IgG만 해당) 및 문둥병자-크레+ / + 쥐. a Vwf의 세포주기 분석+ 그리고 VWF- HSC는 혈소판 고갈 후 1일입니다. 데이터는 3(대조-IgG), 5(대조-GPIbα) 및 5(대조군-GPIbα)의 평균 ± SD 빈도를 나타냅니다.Il1r1플로리다/플로리다 레프-CreTg/+-GPIbα) 마우스는 3번의 독립적인 실험에서 얻은 것입니다. b Vwf의 세포주기 분석+ 그리고 VWF- 1ug/Kg의 IL-50β를 정맥내 투여한 지 1일 후 마우스의 HSC. 데이터는 3(대조군-IgG), 6(대조군-GPIbα) 및 4(대조군-GPIbα)의 평균 ± SD입니다(Il1r1플로리다/플로리다 레프-CreTg/+-GPIbα) 마우스는 3번의 독립적인 실험에서 얻은 것입니다. c 혈소판 고갈 후 표시된 시점에서 혈소판 회복에 대한 말초 혈액 분석. 6(대조군)과 11(대조군)의 평균 ± SD 혈소판 수(Il1r1플로리다/플로리다 레프-CreTg/+) 3번의 독립적인 실험에서 생쥐. d-g Vwf의 차등 유전자 발현 분석+ 그리고 VWF- 혈소판 고갈(GPIbα 처리) 1일 후 야생형 마우스로부터 분리된 HSC. d Vwf에서 차별적으로 발현되는 유전자의 화산 도표+ 그리고 VWF- HSC. 빨간색 점은 상당한 발현 차이가 있는 유전자를 나타냅니다(조정됨). p 가치 (q)<0.05). e Vwf에서 차별적으로 발현되는 유전자의 수를 보여주는 벤 다이어그램+ 그리고 VWF- HSC는 혈소판 고갈 후 그리고 항상성(IgG)의 HSC 하위 집합 사이에 존재합니다. f Vwf에서 상향 조절된 생물학적 과정/경로에 대한 GO 용어 분석+ 혈소판 고갈 후 HSC. g Vwf에서 Activin/BMP 신호 전달과 관련된 유전자의 발현(FPKM)+ 그리고 VWF- 항상성 및 혈소판 고갈 후 1일에 있는 Wt 마우스의 HSC. 모든 데이터 (d-g) 유전자형 및 조건당 3개의 생물학적 복제물의 평균 ± SD FPKM 데이터를 나타냅니다. *p <0.05; **p <0.01; ***p < 0.001; ns 중요하지 않음(p > 0.05); Tukey의 다중 비교와 함께 양방향 ANOVA 사용(a, b), Sidak의 다중 비교를 사용한 양방향 ANOVA(c) 및 양측 t-검정(g). 보충 그림도 참조하십시오. 5.
Vwf 방법에 대한 추가 통찰력을 얻으려면+ HSC는 항-GPIbα에 의해 유발된 혈소판 고갈에 반응하여 증식으로 모집됩니다. 우리는 Vwf의 RNA 시퀀싱을 수행했습니다.+ 그리고 VWF- HSC. Vwf의 RNA 시퀀싱+ HSC는 혈소판 고갈 후 차별적으로 발현되는 유전자 230개를 확인했으며, 그 중 170개는 Vwf에서만 차별적으로 발현되었습니다.+ Vwf는 아니고- HSC 및 이들 중 24개는 이미 뛰어난 Vwf입니다.+ 그리고 VWF- 혈소판/Mk 계통 관련 유전자를 포함한 항상성의 HSC(그림 XNUMX) 5d, e보충 그림. 5e, 에프 및 보충 데이터 6, 7). VWF의 비교+ 그리고 VWF- 혈소판이 고갈된 쥐의 HSC는 Vwf에서 세포 주기 활성화 유전자의 농축을 나타냈습니다.+ HSC는 분자 수준에서 Vwf의 우선적 활성화를 확인합니다.+ 혈소판 고갈에 반응하는 HSC(보조 그림 XNUMX) 5g 및 보충 데이터 8). Vwf에서 차별적으로 발현되는 유전자+ 혈소판 활성화 및 고갈 후 HSC는 주로 TGFβ 신호 전달에 의해 조절되는 것으로 알려진 인테그린 신호 전달 및 세포 부착과 관련이 있습니다.39뿐만 아니라 세포 주기, 혈액 응고 및 스트레스/염증에 대한 반응도 포함됩니다(그림 XNUMX). 5일~금). 이러한 유전자의 조절에 다른 신호 전달 경로가 관여한다는 점을 배제할 수는 없지만, 처음 CBM-PV 셀에서(그림 XNUMX) 4g), 후보 Activin/BMP 표적 유전자 실행x3 과 아이디140 Vwf에서는 각각 하향 및 상향 조정되었습니다.+ 하지만 Vwf는 아니야- HSC는 혈소판 고갈 이후에 발생합니다(그림 XNUMX). 5g). 주목할 만한 것은 α1,6-푸코실트랜스퍼라제(αXNUMX-fucosyltransferase) 유전자(Fut8) TGFβ 및 Activin 수용체의 활성을 차등적으로 조절합니다.41 또한 인테그린 신호전달의 조절자이기도 합니다.42 특히 Vwf에서 상향 규제된 것으로 밝혀졌습니다.+ HSC는 혈소판 고갈을 나타냅니다. 또한, 항-GPIbα에 의해 유발된 혈소판 고갈 Vwf에 반응하여+ Vwf-HSC가 아닌 HSC가 상향 조정됨 Fkbp1a, TGFβ, Activin 및 BMP 수용체의 하류 신호의 강도와 지속 시간을 조절하는 Smad 신호 전달의 세포 내 조절제43,44 (무화과. 5g). 규제 완화와 함께 처음 CBM-PV 셀에서(그림 XNUMX) 4g), 이러한 데이터는 정지 강화 TGFβ 신호 전달에서 Activin/BMP 신호 전달 활성화로의 전환이 급성 혈소판 활성화 및 고갈에 반응하여 HSC의 인테그린 활성, 세포 부착 및 세포 주기 상태의 변화를 초래할 수 있음을 시사합니다.
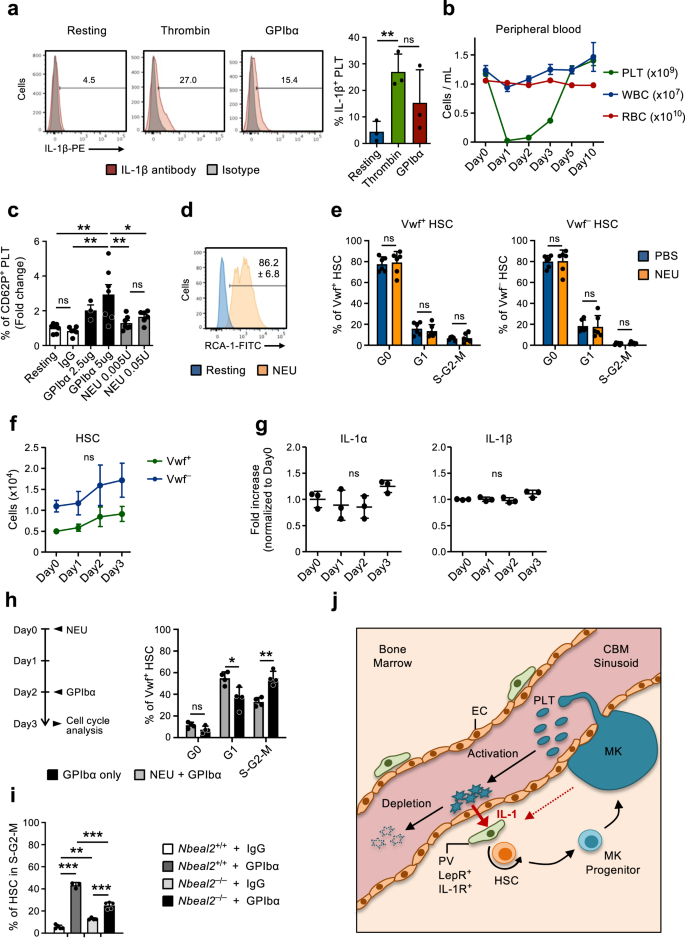
혈소판 활성화는 혈소판 고갈에 대한 HSC 반응에 필수적입니다.
CBM-EC의 유전자 발현 분석에서는 혈소판 활성화 및 응고와 관련된 혈소판 고갈 시 상향 조절되는 여러 유전자가 밝혀졌습니다(그림 XNUMX). 2f,g). 이는 혈소판이 자주 소모되는 메커니즘과 일치합니다.45, 여기에서는 Fc 독립적인 혈소판 활성화를 유도하여 기능하는 GPIbα 매개 혈소판 고갈에 의해 모방되어 혈소판 시알리다제 뉴라미니다제-1(NEU) 막으로의 전위, 시알릴화 및 간에서의 후속 제거를 유도합니다.20. 또한 혈소판은 염증의 중요한 매개체로 인식됩니다.46,47 활성화 시 IL-1 단백질 발현을 빠르게 상향 조절합니다(그림 XNUMX). 6a), 이전에 다른 사람들이 보여준 것처럼48,49,50. 이는 여기서 관찰된 Vwf의 IL-1 의존성 활성화를 중재하는 데 있어 혈소판 활성화 및 후속 소비에 대한 역할을 뒷받침합니다.+ 혈소판 감소증에 반응하는 HSC. 이 가능성을 더 조사하기 위해 우리는 쥐를 NEU로 치료했습니다.51이는 GPIbα 처리와 유사합니다(그림 XNUMX). 1a)은 효율적인 혈소판 고갈을 유도합니다(그림 XNUMX). 6b) 그러나 혈소판 활성화를 우회합니다.20. GPIbα 처리는 표면 P-Selectin(CD62P) 염색으로 측정했을 때 시험관 내에서 혈소판을 효율적으로 활성화한 반면, 시험관 내 NEU 처리는 매우 약한 혈소판 활성화만을 가져왔고 고농도에서만 나타났습니다(그림 XNUMX). 6c). 그러나 시험관 내 NEU 활동은 다음에 의해 확인되었습니다. Ricinus 응집소 I(RCA-1) 라벨링(그림 XNUMX) 6d), 이는 탈시알화된 단백질에 특이적으로 결합합니다.20. 동일한 효율로 생체 내에서 혈소판을 고갈시켰음에도 불구하고, 항-GPIbα 치료와 달리 NEU 치료는 HSC 세포 주기 활성화를 가져오지 못했습니다(그림 XNUMX). 6e) 또한 Vwf의 수가 크게 증가하지도 않았습니다.+ 또는 VWF- HSC(그림. 6f), LSK Flt3-CD48+CD150+ BM의 MPP, pre-MegE 및 MkP(보조 그림 XNUMX) 6a, b). 주목할 점은, NEU 처리된 마우스에서 BM의 IL-1α 및 IL-1β 수준은 크게 변하지 않은 채로 유지되었다는 것입니다(그림 XNUMX). 6g). 이러한 결과는 단순한 혈소판 손실보다는 항-GPIbα 활성화에 의한 혈소판 고갈이 관찰된 HSC의 IL-1 의존성 활성화에 관여함을 시사합니다. 이전 연구에서는 HSC 정지/증식 조절에 있어서 Mks 및 그 분비 인자의 역할을 암시했습니다.31,32,33,52. Mks는 또한 GPIbα를 발현하므로 항-GPIbα 항체 치료에 대한 반응으로 관찰된 HSC 활성화에서 혈소판의 역할을 보다 구체적으로 입증하기 위해 Mks와 독립적으로 혈소판이 NEU로 효율적으로 고갈된 마우스에 항-GPIbα 항체를 투여했습니다. -치료(그림. 6b), 이는 Mks의 수를 변경하지 않습니다.33. 이 순차적 NEU-GPIbα 처리로 인해 Vwf의 세포주기 활성화가 감소했습니다.+ HSC는 GPIbα 단독 치료와 비교했을 때(그림 XNUMX) 6h), 이 과정에 혈소판이 관여함을 확인합니다. 그러나 혈소판 수가 정상인 대조군 마우스와 비교했을 때, NEU가 고갈된 혈소판이 있는 마우스에서 일부 HSC 활성화가 관찰되었다는 사실이 나타났습니다(그림 XNUMX 및 XNUMX). 1d 과 3e)은 또한 항-GPIbα 항체 치료에 대한 반응으로 관찰된 HSC 활성화에서 Mks의 역할을 뒷받침합니다.
(보충 그림과 관련됨. 4). a 휴식 중인 혈소판에서 또는 트롬빈 또는 GPIbα 항체를 사용한 시험관 내 활성화(1시간) 후 IL-3β의 발현. (왼쪽), 대표적인 FACS 프로필. 플롯의 숫자는 3개의 독립적인 실험에서 얻은 평균 빈도입니다. (오른쪽) IL-1β의 빈도+ 혈소판; 3번의 독립적인 실험에서 조건당 3번의 생물학적 복제의 평균 ± SD. 각 생물학적 복제물은 2~3마리의 마우스에서 수집된 혈소판으로 구성됩니다. b 생체 내 뉴라미니다제(NEU) 투여 후 말초 혈액 세포 계통의 동역학 분석. 데이터는 10개의 독립적인 실험에서 얻은 0마리(Day7), 1마리(Day8), 2마리(Day9), 3(Day6), 5마리(Day3) 및 10마리(Day6) 마우스의 평균 ± SEM을 나타냅니다. PLT 혈소판, WBC 백혈구, RBC 적혈구. c 표시된 농도에서 GPIbα 항체 또는 NEU와 함께 시험관 내 배양 후 유세포 분석으로 측정한 혈소판에서 표면 P-셀렉틴(CD62P)의 발현. 데이터는 % CD62P의 평균 ± SD 배수 변화를 나타냅니다.+ 치료되지 않은(휴식) 혈소판과 관련된 각 조건의 세포 중 7(휴식), 6(IgG), 3(GPIbα-2,5ug), 7(GPIbα-5ug), 7(NEU 0.005U) 및 6(NEU) 0.05개의 독립적인 실험에서 3U) 마우스. d 휴면 혈소판에서 또는 NEU로 30분간 처리한 후 시험관 내 뉴라미니다제(NEU) 활성을 RCA-1 결합으로 분석했습니다. 1개의 생물학적 복제물 중 3개의 대표 프로필. 숫자는 평균 ± SD % RCA-1+ 혈소판을 나타냅니다. e Vwf의 평균 ± SD 세포 주기 위상 분포+ (왼쪽)과 Vwf- (오른쪽) NEU로 인해 혈소판이 고갈된 지 1일 후의 HSC. 6번의 독립적인 실험을 통해 조건당 3마리의 마우스에서 얻은 데이터입니다. f NEU로 인한 혈소판 고갈 후 지정된 시점에 생쥐 골수 내 HSC 구획에 대한 FACS 기반 평가. 데이터는 절대적인 숫자를 나타냅니다. 폭스바겐-GFP+ (폭풍+) 또는 폭스바겐-GFP- (폭풍-) 혈소판 고갈 후 표시된 시점의 HSC(평균 ±SEM). 데이터는 5번의 독립적인 실험에서 0마리(Day4), 1마리(Day5), 2마리(Day6) 및 3마리(Day4)의 마우스에서 얻은 것입니다. Vwf 수에는 큰 변화가 관찰되지 않았습니다.+ 또는 VWF- 언제든지 HSC. g 뉴라미니다제로 혈소판이 고갈된 후 표시된 시점에 마우스에서 분리된 골수 세포외액에 표시된 사이토카인의 평균 ± SD 수준(0일에 비해 배수 증가). 3번의 독립적인 실험에서 시점당 2마리의 마우스로부터 얻은 데이터. h 마우스를 0일차에 NEU로 처리한 후 2일차에 GPIbα 항체를 투여하고 3일차(왼쪽)에 Vwf의 세포 주기 단계 분포를 분석했습니다.+ HSC(오른쪽). 대조군 마우스에는 GPIbα 항체만 처리하고 1일 후에 분석했습니다. 데이터는 4회의 독립적인 실험에서 그룹당 2마리의 마우스의 평균 ± SD 빈도를 나타냅니다. i S-G2-M의 HSC Nbeal2-/- 혈소판 고갈(GPIbα) 1일 후의 마우스. 데이터는 5(Wt-IgG), 3(Wt-GPIbα), 4(Nbeal2-/--IgG) 및 5(Nbeal2-/--GPIbα) 3번의 독립적인 실험에서 얻은 조건별 마우스. j 제안된 피드백 메커니즘을 묘사하는 구성표. 활성화된 혈소판은 섭취되는 동안 IL-1을 분비하며, 이는 IL-1R 발현 PV 세포를 활성화하여 HSC 증식 및 혈소판 계통으로의 분화를 유도합니다. 표시된 바와 같이, Mks는 또한 항-GPIbα 항체를 사용한 치료에 반응하여 활성화 의존성 혈소판 고갈을 초래하는 HSC의 증식에 대한 설명된 모집에 기여할 수 있습니다. 모든 데이터에 대해 ***p <0.001; **p < 0.01; *p Tukey의 다중 비교와 함께 일원 분산 분석을 사용하여 < 0.05(유의한 차이에 대해서만 표시됨)(a, c, f, i), Sidak의 다중 비교를 사용한 양방향 ANOVA(e, h) 또는 Dunnett의 다중 비교(g); ns는 중요하지 않습니다. 보충 그림도 참조하십시오. 6.
혈소판은 혈소판 활성화 시 방출되는 혈소판 과립에 여러 염증 조절제를 저장합니다.53,54. GPIbα 매개 HSC 활성화에 혈소판 과립 함량의 방출이 필요한지 추가 조사하기 위해 우리는 혈소판 결핍 쥐에서 혈소판 고갈(GPIbα 치료)을 유도했습니다. Nbeal2 (Nbeal2-/-), 혈소판 α-과립이 부족함55. Nbeal2-/- 생쥐는 혈소판 수가 약간 감소하고 HSC가 약간 증가함에도 불구하고 전반적으로 정상적인 조혈을 나타냅니다. 6c~e). 항-GPIbα 치료 후 XNUMX일 Nbeal2-/- 마우스는 치료 전 주기에 있는 HSC의 빈도가 더 높음에도 불구하고 Wt 마우스와 비교했을 때 적극적으로 순환하는 HSC의 빈도가 상당히 감소했습니다(그림 XNUMX). 6i). 종합적으로, 이러한 발견은 혈소판 활성화 시 분비되는 IL-1 및 기타 조절인자가 혈소판 감소증에 반응하여 HSC의 활성화를 조절하는 역할을 할 수 있음을 시사합니다.
- SEO 기반 콘텐츠 및 PR 배포. 오늘 증폭하십시오.
- PlatoData.Network 수직 생성 Ai. 자신에게 권한을 부여하십시오. 여기에서 액세스하십시오.
- PlatoAiStream. 웹3 인텔리전스. 지식 증폭. 여기에서 액세스하십시오.
- 플라톤ESG. 탄소, 클린테크, 에너지, 환경, 태양광, 폐기물 관리. 여기에서 액세스하십시오.
- PlatoHealth. 생명 공학 및 임상 시험 인텔리전스. 여기에서 액세스하십시오.
- 출처: https://www.nature.com/articles/s41467-023-41691-y