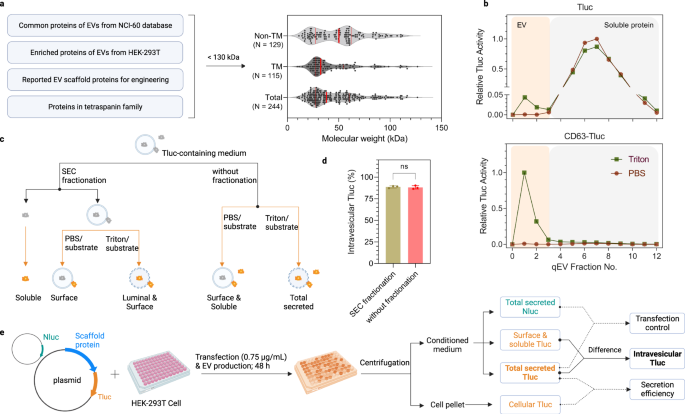
EV 분류 단백질 스크리닝을 위한 간단한 분석
효율적인 EV 정렬 단백질을 찾기 위해 문헌 검토 및 프로테오믹스 데이터베이스를 기반으로 후보 목록을 작성했습니다. 잠재적인 후보는 (1) NCI-60 세포에 걸쳐 EV에서 풍부한 것으로 밝혀진 단백질 중 하나에서 파생되었습니다.29, (2) 인간 배아 신장 상피(HEK)-293T 세포에 의해 생성된 EV에 풍부한 단백질34, (3) 이전 연구에 대한 참조로 EV-선별 단백질을 보고했습니다.32,33, 및 (4) 테트라스파닌 수퍼패밀리의 모든 단백질. 과발현/엔지니어링을 용이하게 하기 위해 130kDa보다 큰 단백질은 제외되었습니다. 중앙값 크기가 244kDa인 총 38개의 후보가 포함되었으며, 그 중 129개는 비-막 단백질이고 115개는 막관통 단백질이었습니다(그림 XNUMX). 1a; 전체 목록은 데이터 소스 파일을 참조하십시오).
a EV-선별 단백질 후보의 선택 기준 및 개요. 빨간색 실선은 25%, 50% 및 75% 백분위수 값을 나타냅니다. b Tluc 또는 CD293-Tluc를 발현하는 HEK-63T 세포로부터의 조절 배지의 SEC 용출 프로파일. 각 분획의 Tluc 활성은 직접(그룹 PBS) 또는 막 용해 후(그룹 Triton) 정량화되었고 가장 높은 신호를 갖는 분획으로 정규화되었습니다. EV와 가용성 단백질은 각각 분획 0-3 및 4-12에서 회수되었습니다. c 컨디셔닝 배지에서 Tluc 형태를 차별화하는 계획. d 분획 및 비분획 배지를 사용하는 CD63-Tluc에 대한 방광내 Tluc의 백분율. 결과는 세 가지 생물학적 복제의 평균 ± 표준 편차로 표시됩니다. 양면 학생의 t 테스트 (P > 0.9999). ns: 중요하지 않음. e 스크리닝 절차 및 데이터 분석의 개요. HEK-293T 세포를 96-웰 마이크로플레이트에서 성장시키고 Tluc 융합 플라스미드 및 Nluc 플라스미드로 동시 형질감염시켰다. 세포 배양물을 원심분리하고 Tluc 활성을 세포 펠렛 및 조절 배지에서 측정했습니다. Nluc 활성은 조절된 배지에서만 정량화되었습니다. c, e BioRender.com으로 제작되었습니다. 소스 데이터는 소스 데이터 파일로 제공됩니다. SEC 크기 배제 크로마토그래피.
EV에 대한 후보자의 내강 로딩 능력을 평가하기 위해 루시퍼라제 리포터 ThermoLuc(Tluc; 60.5 kDa)를 기반으로 한 분석법을 개발했습니다.18. 요컨대, Tluc는 모든 후보의 C 말단에 융합되었으며, N 말단은 일반적으로 신호 펩타이드 및 번역 후 변형에 대한 부위라는 점을 염두에 두었습니다. 융합 단백질을 암호화하는 플라스미드를 HEK-293T 세포에 형질감염시켰다. 48시간 후, 조정된 배지를 수집하고 생물발광 측정 전에 추가로 처리했습니다. 처음에, 이 검정의 타당성을 평가하기 위해, Tluc 단독 및 CD63-Tluc를 발현하는 세포의 조절 배지를 분석하였다. 둘 다 자유 단백질에서 소낭을 분리하기 위해 크기 배제 크로마토그래피(SEC) 컬럼으로 분류되었습니다(그림 XNUMX). 1b)35. 분획을 가용성/표면 관련 Tluc를 결정하기 위해 PBS로 처리하거나 총 분비 Tluc를 검출하기 위해 세제 Triton X-100으로 처리했습니다(그림 XNUMX). 1c). Tluc 단독과 비교하여, CD63과의 융합은 Tluc가 EV 분율로 현저하게 이동하는 결과를 낳았습니다(그림 XNUMX). 1b). 특히, EV 분획의 Tluc 활성은 멤브레인 용해 시에만 검출되었으며, 이는 Tluc 기질이 EV 멤브레인을 통과할 수 없고 루미날 루시페라아제와 반응할 수 없음을 나타냅니다. 이것은 SEC 분류가 내강 단백질을 정량화하는 데 필요하지 않음을 의미합니다. 이것은 CD63-Tluc-발현 세포의 비분획 배지와 분획 배지의 비교에 의해 추가로 뒷받침되며, 이는 소포내 Tluc의 비율에서 유의미한 차이를 나타내지 않았습니다(도 XNUMXb). 1d). 종합하면, 이러한 데이터는 이 분석이 잠재적인 EV 로딩 스캐폴드를 식별하기 위해 높은 처리량 형식으로 사용될 수 있음을 보여줍니다.
앞으로 244명의 후보를 모두 심사하는 원칙은 위와 같았다. 다운스트림 분석을 위해, 단백질은 주로 세포막 용해 유무에 따라 검출된 Tluc 신호의 차이 또는 그 상대적 백분율에서 파생된 소포내 Tluc의 절대량에 대해 평가되었습니다(그림 XNUMX). 1e). 융합 단백질 발현에 대한 정보는 EV 생산 세포에서 Tluc를 측정하여 얻었습니다. 추가로, 지정된 경우 데이터는 가능한 형질감염 변이를 설명하기 위해 형질감염 혼합물에 스파이킹된 NanoLuc(Nluc) 루시페라아제를 인코딩하는 플라스미드 형태의 형질감염 대조군으로 정규화되었습니다.
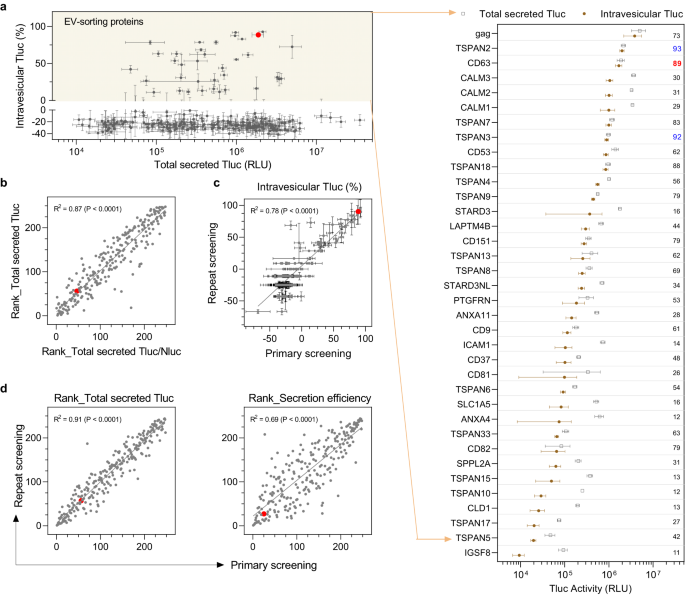
스크리닝은 수십 개의 EV 정렬 단백질을 식별합니다.
HEK-244T 세포에서 293명의 후보를 스크리닝한 결과 수포내 Tluc와 세포 또는 총 분비 Tluc 사이에 명백한 상관관계가 없음이 밝혀졌습니다(보충 그림 XNUMX). 1a, b) 세포 발현이나 전체 분비가 EV 분류 능력을 완전히 예측하지 못함을 나타냅니다. 대부분의 후보자의 경우, 수포내 Tluc의 백분율은 36 미만이었는데, 이는 예상치 못한 일이지만 세제 트리톤의 존재 하에서 감쇠된 효소 활성 및/또는 광자 수명에 기인할 수 있습니다. 그럼에도 불구하고 EV-sorting 능력을 가진 단백질에 대해 합리적이고 실용적인 컷오프를 제공했습니다. 이 정의에 따르면 총 293개의 단백질이 HEK-XNUMXT 세포에서 EV-sorting 능력을 나타내는 것으로 밝혀졌다(도 XNUMX). 2a). 이 중에는 9개의 EV 마커(CD63, CD81, CDXNUMX), 최근 확인된 단백질(PTGFRN)을 포함한 XNUMX개의 알려진 EV 정렬 단백질이 있습니다.32, 및 바이러스 성 당 단백질 개그로 인해 우리의 스크리닝 프로토콜의 유효성을 입증합니다. 우리가 아는 한, 나머지 31개의 단백질이 EV에 내강 화물 적재가 가능한 것으로 보고된 것은 이번이 처음입니다.
a 총 분비 Tluc를 수포내 Tluc의 백분율에 대해 플로팅하는 모든 244개 후보의 개요. EV-정렬 단백질은 XNUMX(노란색 영역) 이상의 소포내 Tluc의 백분율을 갖는 것으로 정의되었으며 그룹화된 도트 플롯에 표시됩니다. 값은 intravesicular Tluc의 백분율을 나타냅니다. 단백질에는 유전자 이름이 표시되어 있습니다. b 총 분비 Tluc에 관한 순위와 총 분비 Tluc/Nluc 비율에 관한 순위 사이의 상관관계. c XNUMX차 및 반복 스크리닝에서 얻은 방광내 Tluc 백분율의 상관관계. d XNUMX차 스크리닝과 반복 스크리닝 사이의 분비된 Tluc 또는 분비 효율에 관한 순위의 상관관계. (a, b)는 63차 스크리닝에서 나온 것이며 XNUMX개의 생물학적 복제의 평균 ± 표준 편차로 표시됩니다. 반복 스크리닝의 데이터는 세 가지 생물학적 복제의 평균 ± 표준 편차로 표시됩니다. 산점도에서 각 점은 하나의 후보를 나타내고 빨간색 점은 벤치마크 CDXNUMX을 나타냅니다. 상관 정도는 선형 회귀로 분석되었으며 적합도(goodness-of-fit)로 표시됩니다(R2) 및 XNUMX이 아닌 기울기(P)의 중요성. 소스 데이터는 소스 데이터 파일로 제공됩니다.
63개의 알려진 비바이러스성 EV 정렬 단백질 중에서 CD89은 총 분비 Tluc의 2%가 전기자동차 내부에 국한되어 소포내 Tluc의 가장 높은 비율을 보였습니다. 특히, TSPAN63는 상대 수포내 Tluc(93% 대 89%)뿐만 아니라 절대량(2.0e6 대 1.7e6, 자세한 내용은 소스 데이터 파일 참조) 측면에서 CD1을 능가했습니다. 그 외에도 2개의 칼모듈린 단백질(CALM3, CALM29, CALM31)은 상당한 양의 Tluc를 EV로 분류했지만 적당한 비율의 수포내 Tluc(XNUMX-XNUMX%)를 포함했습니다.
원치 않는 요인이 Tluc 분비를 방해하는 것을 배제하기 위해 적절한 품질 관리를 실시했습니다. 먼저, 모든 후보는 총 분비 Tluc 및 총 분비 Tluc 대 Nluc의 비율에 따라 순위를 매겼다. Nluc 신호에 대한 정규화는 Tluc 분비에 영향을 미치지 않았습니다(그림 XNUMX). 2b), 이로써 형질 감염 절차의 혼란스러운 역할을 기각합니다. 두 번째로, 스크리닝의 반복은 수포내 Tluc의 백분율에 대해 일관된 결과를 나타냈습니다(그림 XNUMX). 2c)뿐만 아니라 총 분비 Tluc 및 분비 효율의 순위(그림 2d). 마지막으로, 총 분비 Tluc 및 분비 효율의 순위는 두 가지 다른 플라스미드 용량(0.75μg/mL 대 1μg/mL; 1c). 종합하면, 이러한 결과는 우리의 스크리닝 방법으로 얻은 결과의 신뢰성을 입증합니다.
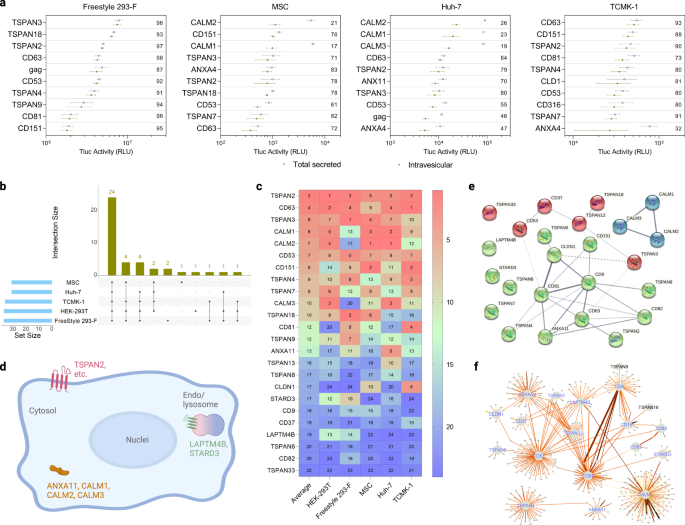
EV 분류 단백질은 다양한 세포 유형에 걸쳐 크게 보존됩니다.
HEK-293T 외에도 다른 세포 유형이 EV 소스로 정기적으로 사용되어 (1) 현탁액에 적응된 HEK 세포(Freestyle 293-F), (2) 인간 제대혈 유래에서 후보자의 EV 정렬 능력을 스크리닝하도록 합니다. 중간엽 줄기 세포(MSC), (3) 인간 간세포 유래 암종 세포(Huh-7) 및 (4) 마우스 신장 상피 세포(TCMK-1). 이를 위해 초기 스크리닝에서 다음 범주 중 하나에서 가능성을 보인 95명의 후보를 위와 같이 스크리닝했습니다.
Freestyle 293-F에서 수포내 Tluc의 백분율 측면에서 EV 분류 능력이 가장 높은 단백질은 TSPAN3이었습니다. MSCs와 Huh-7에서는 CALM2가 가장 높은 순위를 차지했고, TCMK-1에서는 CD63이었다(Fig. 3a). 형질감염 절차가 테스트한 모든 부착 세포에서 Tluc 분비에 실질적으로 영향을 미치는 것으로 밝혀지지 않은 반면, Freestyle 293-F는 변이에 더 취약한 것으로 보였습니다(보충 그림 XNUMX). 2). EV-분류 능력(30보다 큰 수포내 Tluc의 백분율)을 가진 37~XNUMX개의 단백질이 각 세포 유형에 대해 확인되었습니다(그림 XNUMX). 3b). 이 중 24개의 단백질이 XNUMX가지 세포 유형 모두에서 보존되어 다양한 세포 환경에서 강력한 분류 능력을 나타냅니다(전체 목록은 소스 데이터 파일 참조). 보존된 하위 집합의 단백질은 그들의 절대적인 소포내 Tluc 활성에 따라 순위가 매겨졌습니다(그림 XNUMX). 3c). 평균적으로 TSPAN2, CD63 및 TSPAN3은 다양한 세포 유형에서 최고의 정렬 능력을 보여주었습니다.
a 상이한 생산자 세포 유형에서 소포내 Tluc에 관한 상위 XNUMX개의 스캐폴드 단백질. 플롯 내부의 값은 수포내 Tluc의 백분율을 나타냅니다. 결과는 세 가지 생물학적 복제의 평균 ± 표준 편차로 표시됩니다. b 각 생산자 세포 유형에 대해 확인된 EV 분류 단백질의 수와 세포 유형 간에 겹칩니다. c 각 세포 유형에서 방광내 Tluc에 관한 24개의 보존된 EV 분류 단백질의 순위. 값은 각 셀 유형의 순위와 그 평균을 나타냅니다. d 24개의 보존된 EV 분류 단백질의 토폴로지 및 세포내 위치. BioRender.com으로 제작되었습니다. (ef) STRING에서 검색된 24개의 보존된 EV 분류 단백질의 상호작용 네트워크(e) 및 IntAct(f) 데이터베이스. 패널의 선 두께(e, f)는 데이터 지원의 강도를 나타내며 두꺼운 선은 더 강력한 증거를 나타냅니다. 단백질에는 유전자 이름이 표시되어 있습니다. 소스 데이터는 소스 데이터 파일로 제공됩니다.
보존된 하위 집합의 EV 정렬 능력을 제어하는 잠재적 메커니즘에 대한 보다 심층적인 이해를 얻기 위해 생물 정보학 연구가 수행되었습니다. UniProtKB에서 사용할 수 있는 주석에 따르면 11개의 칼모듈린 단백질과 ANXAXNUMX만이 세포질이며, 나머지 단백질은 모두 테트라스파닌 수퍼패밀리의 구성원이며 혈장 또는 엔도좀/리소좀 막에 위치합니다(그림 XNUMX). 3d). 다음으로, 우리는 24개의 EV 분류 단백질 사이의 가능한 상호 작용을 평가했습니다. STRING 데이터베이스에서 사용할 수 있는 실험적이고 예측된 상호작용은 TSPAN2/TSPAN3와 CD63의 상호작용에 대한 약한 증거를 보여주었고, 칼모듈린 단백질은 나머지 단백질과 관계없이 작동하는 것으로 보입니다(그림 XNUMX). 3e). 유사하게, 직접 및 간접 상호작용을 모두 포함하는 IntAct 데이터베이스의 결과는 TSPAN2의 상호작용이 잘 특성화된 9개의 테트라스파닌 CD63/CD81/CDXNUMX의 상호작용과 잘 겹치지 않음을 시사했습니다(그림 XNUMX). 3f). 이러한 예측은 TSPAN2와 TSPAN3이 서로 및 다른 테트라스파닌과 대체로 독립적으로 작동함을 나타냅니다.
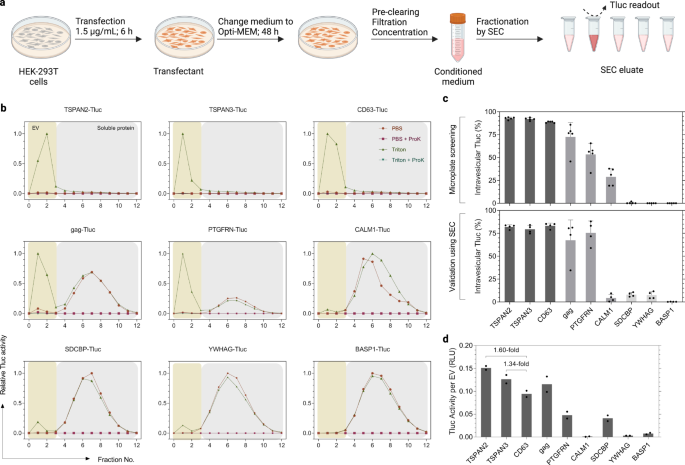
표준화된 전기차 생산으로 전기차 선별 후보 강세 입증
스크리닝에서 HEK-293T 세포를 성장시키고 더 높은 처리량을 위해 96-웰 마이크로플레이트에서 형질감염시켰다. 그러나 이러한 규모는 더 많은 양의 엔지니어링 EV를 생산하려는 미래의 애플리케이션에는 실용적이지 않습니다. 추가로, 스크리닝에서 컨디셔닝된 배지는 정의된 분리 기술 없이 원심분리 직후에 분석되었습니다. 여기에서 우리는 특히 많은 질병에 대한 치료 가능성 때문에 소형 EV(sEV, ≤ 200nm)에 관심이 있었습니다.36,37. 이를 염두에 두고 우리 그룹에서 최근에 수립한 표준화된 프로토콜에 따라 EV를 생산했습니다.38. 초기 스크리닝 프로토콜의 주요 차이점은 (1) 더 높은 용량의 플라스미드 및 더 짧은 형질감염 기간, (2) Opti-MEM에서 후속 유지 관리, (3) 200nm 멤브레인을 통한 조절 배지 여과 후 농축 스텝(도. 4a). 또한, sEV는 Tluc 활성 및 소포 수를 측정하기 전에 SEC에 의해 용해성 단백질에서 분리되었습니다(그림 XNUMX). 4b). 주목할 만하게도, 용출액의 Tluc는 Proteinase K에 의해 완전히 비활성화되었으며 이는 저항성 단백질 응집체가 문제가 되지 않음을 나타냅니다(그림 XNUMX). 4b).
a EV 생산 및 SEC 분류 프로토콜의 워크플로. BioRender.com으로 제작되었습니다. b 형질감염된 HEK-293T 세포로부터의 컨디셔닝된 배지의 SEC 용출 프로파일. EV와 수용성 단백질은 각각 분획 0–3 및 4–12에서 회수되었습니다. 각 분획의 Tluc 활성은 Triton 및 ProK 유무에 관계없이 측정되었으며 신호가 가장 높은 분획으로 정규화되었습니다. c 스크리닝(상단 패널, XNUMX개의 생물학적 복제) 및 표준화된(하단 패널, XNUMX개의 생물학적 복제) 프로토콜을 사용하는 수포내 Tluc의 백분율. 평균 ± 표준편차. d 정제된 EV 준비를 위한 소포당 계산된 Tluc 활동. 결과는 두 번의 생물학적 복제의 평균으로 표시됩니다. 단백질에는 유전자 이름이 표시되어 있습니다. 소스 데이터는 소스 데이터 파일로 제공됩니다. SEC 크기 배제 크로마토그래피.
sEV 분류 능력에 대한 통찰력을 얻기 위해 스크리닝에서의 성능을 기반으로 XNUMX개의 대표 후보를 선정했습니다(그림 XNUMX). 4c). 수포내 Tluc의 백분율은 일반적으로 스크리닝과 일치하여 높은(>80%; TSPAN2, TSPAN3 및 CD63) 및 낮은(<15%; SDCBP, YWHAG, BASP1) sEV 분류 능력을 나타냅니다(그림 XNUMX). 4c). 흥미롭게도, CALM1은 스크리닝에서 3.7%와 비교하여 28.9% Tluc만 sEV로 분류했습니다(P < 0.01, 양면 학생의 t 시험). 소포 수를 고려하여 우리는 TSPAN2 및 TSPAN3이 EV당 Tluc 활동의 측면에서 CD63을 능가한다는 것을 관찰했습니다(각각 1.60배 및 1.34배; 그림 XNUMX). 4d). 전반적으로 이러한 결과는 표준화된 sEV 생산 프로토콜을 따를 때 이들 XNUMX개 후보의 분류 능력이 크게 변하지 않았음을 보여줍니다.
EV-sorting 후보는 다양한화물에 대한 다재다능함을 입증합니다.
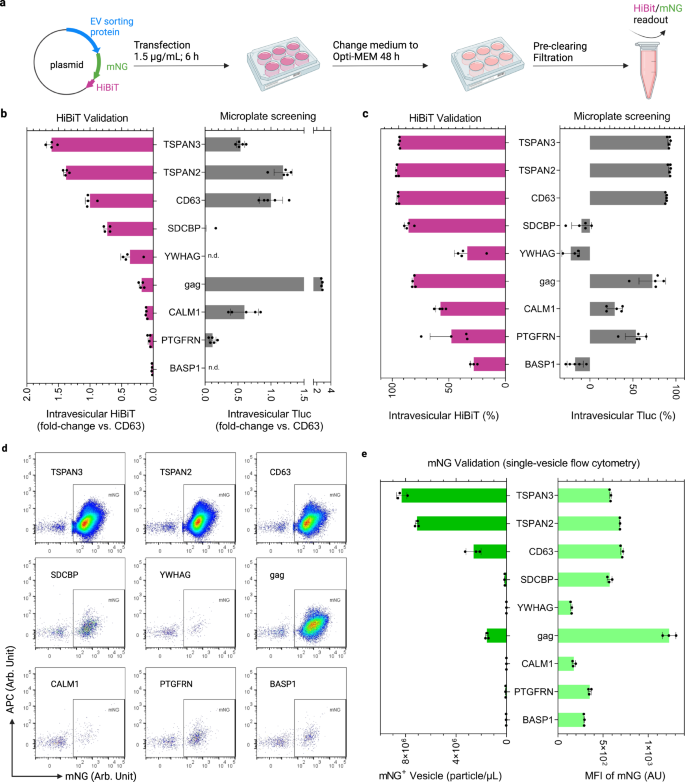
Luciferase는 엔지니어링된 EV를 대량으로 정량화하기 위한 손쉬운 리포터입니다. 그러나 엔지니어링된 EV의 수와 EV당 풍부한 화물 단백질에 대한 자세한 정보를 얻으려면 단일 소포 이미징 유세포 분석법을 선택하는 방법입니다.39,40. 따라서 위에서 탐색한 26.6개의 후보 단백질에 대해 Tluc는 HiBiT에 융합된 형광 단백질 mNeonGreen(mNG; XNUMXkDa)으로 구성된 하이브리드 리포터로 대체되었습니다.41, 스플릿 Nluc 루시퍼라제로부터의 11-mer 펩타이드(도 XNUMXb). 5a).
a EV 생산 및 분석의 워크플로우. BioRender.com으로 제작되었습니다. b 벤치마크 CD63에 대한 방광내 HiBiT. 감지되지 않았습니다. c 혈관내 HiBiT의 백분율. ~ 안에 b, c, 결과는 293개의 생물학적 복제의 평균 ± 표준 편차로 표시됩니다. HEK-XNUMXT 세포의 스크리닝 결과를 참조용으로 다시 그래프로 작성했습니다. d mNG-HiBiT 표지 EV의 단일 소포 유세포 분석 도트 플롯. e mNG 양성 EV의 농도 및 평균 형광 강도(MFI). 결과는 세 가지 생물학적 복제의 평균 ± 표준 편차로 표시됩니다. 단백질에는 유전자 이름이 표시되어 있습니다. 소스 데이터는 소스 데이터 파일로 제공됩니다.
HiBiT와 Tluc의 수포내 루시퍼라제 활성을 비교한 결과 TSPAN3, TSPAN2 및 CD63에 대해 양 측면에서 비슷한 엔지니어링 효율성이 나타났습니다(그림 XNUMX). 5b) 및 백분율(그림. 5c). 단일 소포 수준을 보기 위해 mNG를 사용하여 TSPAN3 및 TSPAN2는 가장 많은 수의 엔지니어링된 EV를 생산하여 CD63을 약 XNUMX배 능가하는 동시에 엔지니어링된 EV당 유사한 수준의 mNG에 도달했습니다(그림 XNUMX). 5d, e). 또한 우리는 mNG가 온전한 융합 단백질을 나타내는 항체 염색 후 EV에서 각각의 분류 단백질과 함께 국소화됨을 보여주었습니다(보충 그림 XNUMX). 3). 놀랍게도, HiBiT 및 Tluc 기반 측정은 gag에 대해 크게 달랐습니다(그림 XNUMX). 5b, c); 그러나 mNG 수준은 그러한 불일치를 나타내지 않았습니다(그림 XNUMX). 5d, e). 이로 인해 우리는 gag-mNG-HiBiT의 입체적 구성이 기능적 루시퍼라제를 형성하기 위해 HiBiT가 파트너 서브유닛과 복합체화하는 것을 금지한다고 가정했습니다. 또한, CALM1은 SEC 검증 실험에서 CALM1-Tluc에 대해 관찰된 경향과 일치하여 낮은 수준의 소낭성 HiBiT 및 mNG를 나타냈습니다(그림 XNUMX). 4c). 이러한 결과는 CALM1이 여과 단계에서 제거되는 더 큰 소포(>200 nm)로 우선적으로 분류됨을 시사합니다(보조 그림 XNUMX). 4).
덜 지루한 전파 절차로 인해 EV 생산을 위한 탁월한 공급원인 Freestyle 293-F 세포에서 이러한 선택된 단백질의 성능을 추가로 평가했습니다. 다시 말하지만, TSPAN3 및 TSPAN2는 방광 내 HiBiT 측면에서 각각 CD63을 82% 및 50% 능가했습니다(보충 그림 XNUMX). 5a). 단일 소포 수준에서 가장 높은 농도의 mNG 양성 소포는 TSPAN3 및 TSPAN2 조작된 Freestyle 293-F 세포에 의해 생성되었습니다(보충 그림 XNUMX). 5b). 종합적으로, mNG-HiBiT 및 Tluc 리포터를 기반으로 한 조정 결과는 스크리닝 프로토콜의 신뢰성을 강화하고 다양한 화물에 대한 후보 단백질의 강력한 EV 분류 능력을 강조합니다.
테트라스파닌으로 조작된 EV 사이의 뚜렷한 분자 서명
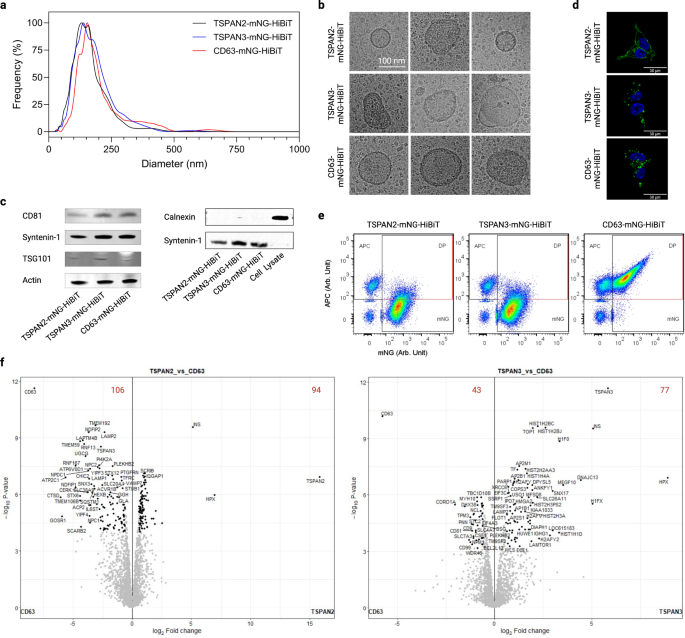
모든 실험에서 TSPAN2와 TSPAN3은 잘 특성화된 테트라스파닌 CD63보다 더 잘 수행되는 것으로 보이는 최고의 EV 정렬 단백질 중 하나로 나타났습니다. 특히, TSPAN2와 TSPAN3의 서로 다른 splice isoform은 HEK293-T 세포에서 EV 분류 능력을 유지하지 못했습니다(보충 그림 XNUMX). 6). 우리가 아는 한 이것은 EV의 내인성 엔지니어링을 위한 이러한 단백질의 첫 번째 보고서이므로 CD2 엔지니어링 EV와 관련하여 TSPAN3 및 TSPAN63 엔지니어링 EV의 물리 화학적 특징을 더 자세히 특성화했습니다.
형질감염된 HEK-293T 세포로부터의 EV 제제의 나노입자 추적 분석은 대략 120 nm의 유체역학적 직경 중앙값을 갖는 좁은 크기 분포를 나타냈다(도 XNUMXb). 6a). 또한, 그들의 형태학적 외관은 멤브레인 구조와 크기로 예시된 EV의 전형적인 모습이었습니다(그림 XNUMX). 6b). 또한 CD81, syntenin-1 및 TSG101과 같은 일반적인 EV 마커는 EV에서 검출되었지만 음성 마커인 Calnexin은 검출되지 않았습니다(그림 XNUMX). 6c). 그 외에도 EV 생물 발생에 대한 통찰력을 얻기 위해 형질감염된 세포에서 세 가지 테트라스파닌 단백질의 위치를 조사했습니다. TSPAN2는 생산자 세포의 원형질막과 세포질 모두에 국한되어 있는 반면, TSPAN3과 CD63은 주로 세포 내부의 점상 신호로 검출되었습니다(그림 XNUMX). 6d). 또한, 모든 유형의 엔지니어링 EV의 생산은 세라마이드 억제에 저항성이 있었습니다(보충 그림 XNUMX). 7a), 이는 인식된 엑소좀 생산 경로의 동인입니다.1,42.
a 형질감염된 HEK-293T 세포의 EV 크기 분포. b 전기 자동차의 대표적인 극저온 전자 현미경 이미지. c EV의 양성 및 음성 마커의 웨스턴 블롯. d 형질감염된 HEK-293T 세포에서 테트라스파닌의 세포 위치. e APC-접합 CD9/CD63/CD81 테트라스파닌 항체로 염색한 후 EV의 단일 소포 유세포 분석 도트 플롯. f EV에서 차별적으로 농축된 단백질을 보여주는 화산 플롯. 빨간색 숫자는 차별적으로 농축된 단백질의 수를 나타냅니다. 결과는 세 가지 생물학적 복제에서 나온 것입니다. 소스 데이터는 소스 데이터 파일로 제공됩니다. 질량 분석 프로테오믹스 데이터는 데이터 세트 식별자 PXD043840과 함께 PRIDE 파트너 저장소를 통해 ProteomeXchange 컨소시엄에 기탁되었습니다.
단백질 서명을 이해하기 위해 전기 자동차를 고전적인 팬 표면 마커 CD9/CD63/CD81로 염색하고 단일 소포 수준에서 분석했습니다. 테트라스파닌의 과발현은 전체 EV의 수율에 다르게 영향을 미쳤습니다(모든 형광 현상으로 정의됨, 보충 그림 XNUMX). 7b) 및 엔지니어링 EV(mNG로 정의됨)+ 이벤트, 보충 그림 7c). 더 흥미롭게도 TSPAN2 및 TSPAN3 엔지니어링 EV의 극히 일부만이 표면에 XNUMX개의 기존 EV 마커를 표시했습니다(그림 XNUMX). 6e). 또한, 다중 비드 기반 유세포 분석법에 의한 39종 단백질의 EV 표면 발현 분석43 TSPAN2 양성 EV의 표면 에피토프 조성이 CD9/CD63/CD81 양성 EV의 표면 에피토프 조성과 다르다는 것이 밝혀졌습니다(보충 그림 XNUMX). 7d). 표면 단백질 외에도 EV의 심층 프로테옴 분석은 CD2 엔지니어링 EV와 비교하여 TSPAN106(94개의 농축 및 3개의 농축) 및 TSPAN43(77개의 농축 및 63개의 농축)에 대해 차등적으로 농축된 단백질의 과다를 보여주었습니다. CD9/CD63/CD81은 단일 소포 및 비드 기반 유세포 분석에서 얻은 결과와 일치하는 TSPAN2/TSPAN3 공학 EV에서 상당히 하향 조절된 단백질 중 하나였습니다. Gene Ontology 분석을 기반으로, HEK293T 세포의 야생형 EV와 비교하여 세 가지 유형의 모든 조작된 EV(CD63, TSPAN2 및 TSPAN3)가 대사산물 상호전환 효소, 단백질 변형 효소 및 RNA 대사 단백질로 풍부해졌습니다(>10%). , 하지만 세포외 기질 단백질이 고갈(>10%)되었습니다(보충 그림 XNUMX). 8). 다음으로 우리는 전체 단백질 구성을 Principal Clustering Analysis 도구와 비교하고 조작된 전기 자동차가 야생형 전기 자동차와 다르며 서로 간에도 그 정도가 적다는 것을 관찰했습니다(보충 그림 XNUMX). 7e). 흥미롭게도 WT EV와 관련하여 TSPAN2의 과발현은 CD63 및 TSPAN3 수준에 부정적인 영향을 미쳤으며 이는 경쟁 관계를 나타낼 수 있습니다. 반면에 TSPAN3 과발현은 양성 조절을 암시하는 CD63 수준의 약간의 증가를 가져왔습니다(보충 그림 XNUMX). 7f). 전반적으로 이러한 결과는 TSPAN2/TSPAN3 기반 엔지니어링이 CD63과 다른 EV 하위 집단을 발생시킨다는 것을 보여줍니다.
배송 방식으로서의 TSPAN2 및 TSPAN3 엔지니어링 EV
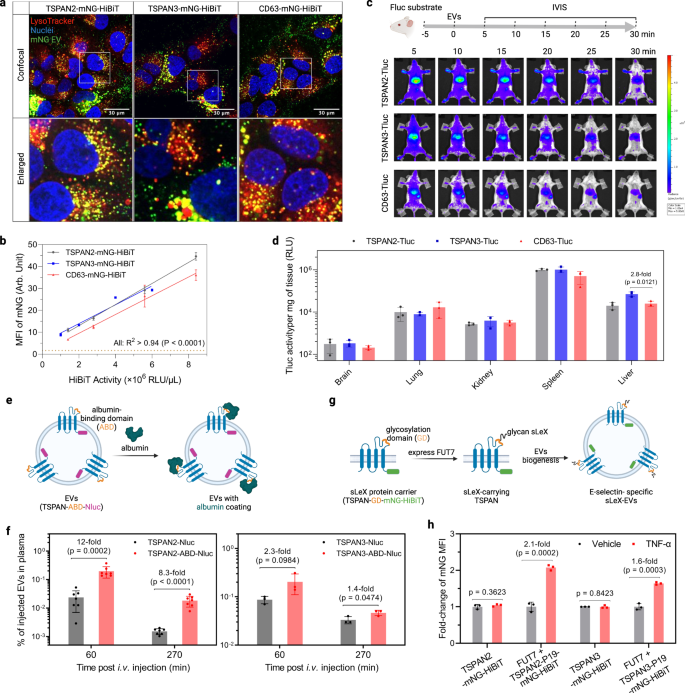
TSPAN2/TSPAN3 엔지니어링 EV가 세포 전달에 적합한지 여부를 알아보기 위해 시험관 내 및 생체 내 전달 가능성을 조사했습니다. 먼저, Huh-7 세포를 mNG 표지된 EV로 처리하여 수혜자 세포에서 세포하 위치를 조사했습니다. 강한 점 모양의 노란색 신호는 효율적인 내재화와 리소좀으로의 트래피킹을 명확하게 나타냅니다(그림 XNUMX). 7a). 유세포 분석법을 사용한 세포 MFI의 정량화는 CD2 공학 전기 자동차와 비교하여 TSPAN3/TSPAN63 공학 전기 자동차에 대해 약간 더 나은 섭취 효율을 나타냈습니다(그림 XNUMX). 7b). 생쥐의 EV 분포 연구를 위해 동일한 양의 조작된 EV(Tluc 활동 기반)를 정맥 내로 투여하고 생체 내 이미징 시스템을 사용하여 실시간으로 추적했습니다(보충 그림 XNUMX). 9a 그리고 그림. 7c). 세 가지 유형의 모든 조작된 EV에 대해 우리는 5분 이내에 간과 비장에 빠르게 분포하는 것을 관찰했습니다(그림 XNUMX). 7c) 및 30분 동안 전신 활동의 눈에 띄는 감소(보충 그림. 9c, P = 0.0006, Kruskal–Wallis 검정). TSPAN2 및 TSPAN3 엔지니어링 EV는 CD63 엔지니어링 EV보다 약간 더 높은 전신 유지력을 부여하는 것으로 보입니다(보충 그림 XNUMX). 9b). 후속 생체 외 측정 결과는 조작된 EV의 우세한 간 및 비장 축적을 지원했습니다(그림 XNUMX). 7d). 종합하면, CD63 공학 EV와 마찬가지로 TSPAN2 및 TSPAN3 공학 전기자동차는 시험관 내 및 생체 내에서 세포에 의해 효율적으로 흡수됩니다.
a Huh-7 세포를 EV로 4시간 동안 처리하고 LysoTracker로 염색하여 리소좀을 시각화했습니다. 전체 웰의 대표 영역에서 공초점 현미경 이미지가 표시됩니다. 실험은 한 번 수행되었습니다. b Huh-7 세포를 EV로 8시간 동안 처리하였다. 세포 mNG MFI는 유세포 분석기를 사용하여 정량화되었습니다. 데이터는 세 가지 생물학적 복제의 평균 ± 표준 편차로 표시됩니다. 상관 정도는 선형 회귀로 분석되었으며 적합도(goodness-of-fit)로 표시됩니다(R2) 및 XNUMX이 아닌 기울기(P)의 중요성. c 생쥐에서 전기 자동차의 생체 분포. NMRI 마우스에 복강내 주사하였다. d-루시페린 기질. XNUMX분 후 마우스에 같은 양의 조작된 EV(Tluc 활동 기반)를 정맥 주사하고 IVIS로 이미지화했습니다. 그 후, 체외 생물 발광 측정을 위해 주요 장기를 수집했습니다. 대표 IVIS 이미지가 표시됩니다. N = 3. d IVIS 후 생체 외 장기에서의 Tluc 활성. 결과는 세 마리 마우스의 평균 ± 표준 편차로 표시됩니다. e 알부민 결합 전기 자동차 생성 계획. 융합 단백질을 안정적으로 발현하는 HEK-293T 세포로부터 EV를 수집하였다. f 알부민 결합 EV를 정맥 주사하고 혈장 농도를 측정했습니다. 데이터는 평균 ± 표준 편차로 표시됩니다. N = 7(TSPAN2 관련) 또는 3(TSPAN3 관련). g 전기 자동차의 sLeX 디스플레이 방식. 구성 요소를 안정적으로 발현하는 HEK-293T 세포에서 EV를 수집했습니다. h HUVEC 세포는 2시간 동안 TNF-α에 의해 활성화되었고 6시간 동안 EV로 처리되었습니다. 세포 mNG MFI는 유동 세포측정법을 사용하여 정량화되었으며 비활성화된 세포에 대한 배수 변화로 표시됩니다. c, e, g BioRender.com으로 제작되었습니다. 데이터는 세 가지 생물학적 복제의 평균 ± 표준 편차로 표시됩니다. 양면 학생의 t 시험. 소스 데이터는 소스 데이터 파일로 제공됩니다.
루미날 화물용 TSPAN2 및 TSPAN3의 적재 및 운송 능력을 광범위하게 보여준 후, 다음으로 EV 표면 디스플레이 애플리케이션에 대한 잠재력을 조사했습니다. 일부 테트라스파닌의 큰 세포외 루프(LEL)는 이미 이러한 응용 분야에 활용되었으며 테트라스파닌 단백질의 위상학적 유사성을 고려하여 TSPAN2 및 TSPAN3의 LEL을 설계하려고 했습니다. CD63, CD9 및 CD81의 LEL에 알부민 결합 도메인(ABD)을 삽입하면 EV의 혈장 순환 시간이 크게 연장되는 것으로 나타났습니다.44. 동일한 전략을 사용하여 정량화를 위해 ABD를 C-말단에 Nluc가 있는 TSPAN2 및 TSPAN3의 LEL에 클로닝했습니다(그림 XNUMX). 7e). EV는 TSPAN-ABD-Nluc 융합 단백질을 안정적으로 발현하는 HEK-293T 세포에서 수집되었습니다(보충 그림 XNUMX). 9c) 및 그들의 알부민-결합 능력에 대해 평가하였다. 예상대로 ABD 표시 EV만 알부민에 결합했습니다(보조 그림 XNUMX). 9d). 다음으로, 이 EV를 마우스에 정맥 주사하고 혈장 내 EV 농도를 다른 시점에서 Nluc를 기준으로 측정했습니다. 야생형 테트라스파닌 조작 전기자동차와 비교하여 ABD 표시 전기자동차는 특히 스캐폴드 단백질로 TSPAN2를 사용할 때 혈장에서 상당히 높은 농도를 보였습니다(그림 XNUMX). 7f).
또 다른 예에서 우리는 글리칸 리간드 시알릴 루이스 X(sLeX)의 표면 디스플레이를 통해 활성화된 내피 세포 특이적 표적화를 달성하는 것을 목표로 했습니다.45. 따라서, 19-mer sLeX 펩티드 캐리어(P19)를 C-말단에서 mNG-HiBiT와 함께 각 테트라스파닌 단백질의 LEL에 삽입하였다. fucosyltransferase VII(FUT7)의 존재 하에서 P19는 sLeX를 표시하기 위해 글리코실화됩니다(그림 XNUMX). 7g). 이러한 근거를 바탕으로 FUT293 및 TSPAN-P7-mNG-HiBiT를 안정적으로 발현하는 HEK-19T 세포에서 sLeX-EV를 생산했습니다(보충 그림 XNUMX). 9c). 이들의 섭취는 sLeX의 주요 수용체인 E-셀렉틴을 발현하는 TNF-α 활성화 내피 세포에서 평가되었습니다. 야생형 테트라스파닌으로 조작된 EV는 비활성 및 활성화된 내피 세포에서 유사하게 흡수되는 반면, TSPAN2 또는 TSPAN3을 스캐폴드로 사용하는 sLeX-EV는 활성화된 내피 세포에 의해 선호되는 흡수를 입증했습니다(그림 XNUMX). 7h). 전반적으로 이것은 표면 디스플레이를 위한 LEL과 내강 화물 적재를 위한 C-말단의 동시 엔지니어링 측면에서 TSPAN2 및 TSPAN3의 가능성을 보여주므로 치료 응용 분야의 잠재력을 강조합니다.
- SEO 기반 콘텐츠 및 PR 배포. 오늘 증폭하십시오.
- PlatoData.Network 수직 생성 Ai. 자신에게 권한을 부여하십시오. 여기에서 액세스하십시오.
- PlatoAiStream. 웹3 인텔리전스. 지식 증폭. 여기에서 액세스하십시오.
- 플라톤ESG. 자동차 / EV, 탄소, 클린테크, 에너지, 환경, 태양광, 폐기물 관리. 여기에서 액세스하십시오.
- BlockOffsets. 환경 오프셋 소유권 현대화. 여기에서 액세스하십시오.
- 출처: https://www.nature.com/articles/s41467-023-40453-0