Einleitung
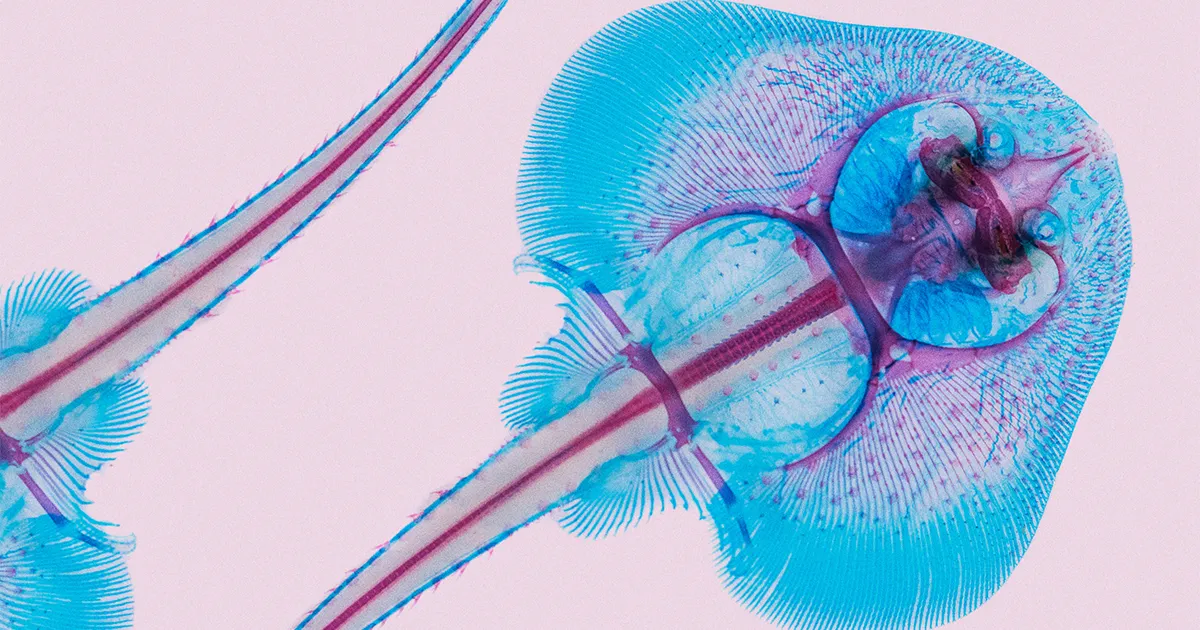
Die Rochen genannten Meeresbewohner gleiten über den Meeresboden und bewegen ihre flügelartigen Brustflossen, um sich fortzubewegen und kleine Lebewesen, die sich im Sand verstecken, aufzuscheuchen. Ihr ungewöhnlich abgeflachter Körperbau macht sie zu einer der seltsamsten Fischfamilien im Meer, und es erscheint noch seltsamer, dass sie sich aus stromlinienförmigen, haiähnlichen Fleischfressern entwickelt haben, die vor etwa 285 Millionen Jahren schwammen.
Jetzt haben Forscher herausgefunden, wie Rochen ihr charakteristisches Profil entwickelten: Neuanordnungen in der DNA-Sequenz des Rochens veränderten die dreidimensionale Struktur seines Genoms und zerstörten alte Verbindungen zwischen wichtigen Entwicklungsgenen und den regulatorischen Sequenzen, die sie steuerten. Diese Veränderungen führten wiederum zu einer Neuformulierung des Körperbauplans des Tieres. Die Wissenschaftler berichteten von ihren Erkenntnissen in Natur im April.
Die Entdeckung löst das Rätsel der evolutionären Transformation der Rochen, indem sie sie auf genetische Mechanismen zurückführt, die die Entwicklung steuern. „Aus den Fossilienfunden geht hervor, dass diese Veränderung stattgefunden hat, aber wie kam es tatsächlich dazu?“ genannt Chris Amemiya, ein Molekulargenetiker an der University of California, Merced, der nicht an der neuen Studie beteiligt war. „Das ist eine klassische Evo-Devo-Frage.“
Um die Ursprünge der neuartigen Körperform der Schlittschuhe aufzudecken, beschloss vor einigen Jahren der Evolutionsgenomiker José Luis Gómez-Skarmeta stellte ein vielfältiges internationales Team aus Genomforschern und evolutionären Entwicklungsbiologen zusammen. Ein Team wurde unter anderem deshalb benötigt, weil der erste Schritt darin bestand, das Genom eines Rochens zu sequenzieren und zusammenzusetzen, und die Zusammenstellung der Genome von Knorpelfischen wie Rochen und Haien äußerst schwierig ist.
„Sie sind wirklich schwer zusammenzusetzen, weil sie riesig sind – oft größer als das menschliche Genom“, sagte er Mélanie Debiais-Thibaud, ein evolutionärer Entwicklungsgenetiker an der Universität Montpellier in Frankreich, der nicht an der Arbeit beteiligt war.
Für ihre Arbeit wählte das Team den kleinen Schlittschuh (Leucoraja erinacea), die leicht entlang der Atlantikküste Nordamerikas gesammelt werden kann. Es kann auch im Labor gezüchtet werden, wodurch im Rahmen des Projekts Entwicklungs- und Funktionsversuche an den Tieren durchgeführt werden konnten.
Durch den Vergleich des Genoms des kleinen Rochens mit dem Genom anderer Wirbeltiere stellten die Forscher fest, dass das Genom des Rochens im Allgemeinen dem seiner Wirbeltier-Vorfahren auf Sequenzebene sehr ähnlich geblieben ist. Es gab jedoch einige bemerkenswerte Umlagerungen, die die 3D-Struktur des Genoms beeinflusst hätten. In der DNA von Individuen können solche Umlagerungen Krankheiten verursachen, indem sie die Genregulation außer Kraft setzen. Die Entdeckung veranlasste die Forscher zu der Frage, ob die Neuanordnungen bei Rochen möglicherweise die ursprünglichen genetischen Anweisungen für ihren Körperbauplan auf ähnliche Weise gestört haben könnten.
Grenzen sprengen
Wenn Sie sich die DNA-Sequenz eines Chromosoms ansehen, können die darin enthaltenen Gene überraschend weit von den kurzen „Enhancer“-Sequenzen entfernt sein, die die Aktivität dieser Gene regulieren. In der Praxis sind sie aufgrund der Art und Weise, wie sich die DNA in einem Zellkern windet, faltet und in sich selbst zurückführt, oft überhaupt nicht weit voneinander entfernt.
Bei Wirbeltieren sind Sätze funktionell verwandter Gene und ihrer Enhancer physisch in drei Dimensionen in Einheiten zusammengefasst, die als topologisch assoziierende Domänen (TADs) bezeichnet werden. Grenzregionen tragen dazu bei, sicherzustellen, dass Enhancer nur auf Gene im selben TAD wirken.
Einleitung
Wenn es jedoch zu größeren Genomumordnungen kommt – wie sie das Team in der DNA des Rochens beobachtete –, können Grenzen verloren gehen und die relativen Positionen von Genen auf den Chromosomen können sich ändern. Infolgedessen „können einige Enhancer Anweisungen an das falsche Gen senden“, erklärt er Dario Lupiáñez, Evolutionsbiologe am Max-Delbrück-Centrum in Berlin und einer der leitenden Autoren der Studie.
Es schien möglich, dass die Veränderungen in der 3D-Architektur des Rochengenoms die alten Genblöcke, die die Rochen von ihren haiähnlichen Vorfahren geerbt hatten, zerstört und die Funktion der Gene beeinträchtigt haben könnten. „Wir haben versucht herauszufinden, ob einige Genomumlagerungen beim kleinen Rochen diese Blockaden tatsächlich durchbrechen“, sagte er Ferdinand Marlétaz, Genomiker am University College London und Co-Erstautor der Studie.
Die Forscher identifizierten Genomumlagerungen beim Kleinen Rochen, die bei keinem anderen Wirbeltier auftraten. Dann konzentrierten sie sich auf die Veränderungen, die sich auf der Grundlage der Genomsequenzen am wahrscheinlichsten auf die Integrität der TADs auswirkten.
Die Bemühungen führten sie zu einer Neuordnung, von der sie vorhersagten, dass sie die Grenze eines TAD beseitigen würde, das ein Entwicklungssystem namens PCP-Weg (Planar Cell Polarity) reguliert. Das hatten sie nicht erwartet: Nichts an den bekannten Funktionen des PCP-Signalwegs deutete sofort darauf hin, dass er die Flossenentwicklung regulieren würde. Meistens legt es die Form und Ausrichtung der Zellen in Embryonen fest.
Eine neue genetische Nachbarschaft
Um die möglichen Auswirkungen der TAD-Änderung auf die Flossenentwicklung zu testen, Tetsuya Nakamura, ein evolutionärer Entwicklungsbiologe an der Rutgers University, setzte kleine Rochenembryonen einem Inhibitor des PCP-Signalwegs aus. Die Vorderkante ihrer Flossen war stark verändert und wuchs nicht wie üblich in den Kopf hinein. Es deutete darauf hin, dass die Störung des angestammten TAD durch die Aktivierung von PCP-Genen in einem neuen Körperteil die charakteristischen Flossen des Rochens hervorgebracht hatte.
„Diese Neuordnung des TAD verändert grundsätzlich die gesamte Umgebung des Gens und bringt neue Enhancer in die Nähe des Gens“, sagte Lupiáñez.
Einleitung
Doch das war nicht die einzige relevante Genomveränderung, die die Forscher fanden. Sie identifizierten auch eine Mutation in einem Enhancer, der die Expression einiger für die Entwicklung wichtiger Gene reguliert hox Gruppe. hox Gene legen den allgemeinen Körperplan aller bilateral symmetrischen Tiere fest. Eine Untergruppe davon, die hoxa Dieser Gencluster wird normalerweise nur in den hinteren (Hinter-)Kanten der sich entwickelnden Flossen und in den Gliedmaßen exprimiert, wo er die Bildung von Fingern bestimmt.
Im kleinen Skate, dem hoxa Gene waren sowohl im hinteren als auch im vorderen Teil der Flosse aktiv. Es sei, als ob die Wachstumszone entlang der Rückseite der Flosse entlang der Vorderseite dupliziert worden wäre, sodass das Tier auf der Vorderseite der Flosse eine neue Reihe von Strukturen bildete, die symmetrisch zu den Strukturen auf der Rückseite waren, sagte Debiais-Tbaud.
Nakamura zeigte, dass der mutierte Verstärker des Schlittschuhs die Ursache für dieses Neue war hoxa Ausdrucksmuster. Er kombinierte den Verstärker des Rochens mit einem Gen für ein fluoreszierendes Protein und fügte diese Genkombination dann in Zebrafischembryonen ein. Die Brustflossen des Fisches wuchsen ungewöhnlich, und sowohl an der Vorder- als auch an der Hinterkante traten Fluoreszenzen auf, was zeigte, dass der Verstärker des Rochens aktiv war hoxa Ausdruck in beiden Teilen der Flosse. Als Nakamura das Experiment mit einem Verstärker eines Hais wiederholte, blieb das Flossenwachstum unverändert und die Fluoreszenz war auf die Rückseite beschränkt.
„Jetzt gehen wir davon aus, dass die genetischen Mutationen speziell im Skate-Enhancer aufgetreten sind und dass dies zu einer einzigartigen Entwicklung führen kann hox Genexpression in Rochenflossen“, sagte Nakamura.
Geformt für neue Lebensweisen
In dem Bild der Rochenentwicklung, das die Forscher rekonstruiert haben, erwarben sie irgendwann nach der Abspaltung der Rochenlinie von den Haien eine Mutation in einem Verstärker, der sie hervorbrachte hoxa Gene, die sowohl auf der Vorder- als auch auf der Rückseite ihrer Brustflossen aktiv sind. Und innerhalb des neuen Gewebes, das entlang der Vorderseite der Flosse wuchs, führten Genomumlagerungen dazu, dass der PCP-Weg durch Enhancer in einem anderen TAD aktiviert wurde, was den weiteren Effekt hatte, dass sich die Flosse nach vorne ausdehnte und mit dem Kopf des Tieres verschmolz.
„Durch die Bildung der flügelartigen Struktur sind [die Rochen] nun in der Lage, eine ganz andere ökologische Nische zu besiedeln, den Meeresboden“, erklärte Amemiya.
Stachelrochen, Mantas und andere Rochen sind eng mit Rochen verwandt (sie werden alle als „Batoid“-Fische klassifiziert), und ihre ähnlich pfannkuchenartige Form ist wahrscheinlich auf die gleichen Genomumlagerungen zurückzuführen. Allerdings haben die Rochen auch ihre flügelartigen Flossen so verändert, dass sie grundsätzlich durch das Wasser fliegen können. „Die Rochen haben diese Wellen der Flosse und bleiben auf dem Grund, aber Mantarochen können an die Oberfläche kommen und sich auf eine ganz andere Art fortbewegen“, sagte Amemiya.
Obwohl evolutionäre Entwicklungsbiologen zuvor spekuliert haben, dass diese Veränderungen in der 3D-Architektur eines Genoms möglich sein könnten, ist dies wahrscheinlich eine der ersten Arbeiten, die sie eindeutig mit ziemlich großen Veränderungen in der Körperform in Verbindung bringt, sagte Marlétaz.
Lupiáñez glaubt auch, dass die Ergebnisse eine Bedeutung haben, die weit über das Verständnis von Schlittschuhen hinausgeht. „Das ist eine völlig neue Art, über Evolution nachzudenken“, sagte er. Strukturelle Veränderungen „können dazu führen, dass ein Gen an einer Stelle aktiviert wird, an der es nicht sein sollte.“ Er fügte hinzu: „Dies kann ein Krankheitsmechanismus sein, aber auch als Treiber der Evolution dienen.“
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoAiStream. Web3-Datenintelligenz. Wissen verstärkt. Hier zugreifen.
- Die Zukunft prägen mit Adryenn Ashley. Hier zugreifen.
- Kaufen und verkaufen Sie Anteile an PRE-IPO-Unternehmen mit PREIPO®. Hier zugreifen.
- Quelle: https://www.quantamagazine.org/how-3d-changes-in-the-genome-turned-sharks-into-skates-20230530/



