Biofilmeigenschaften
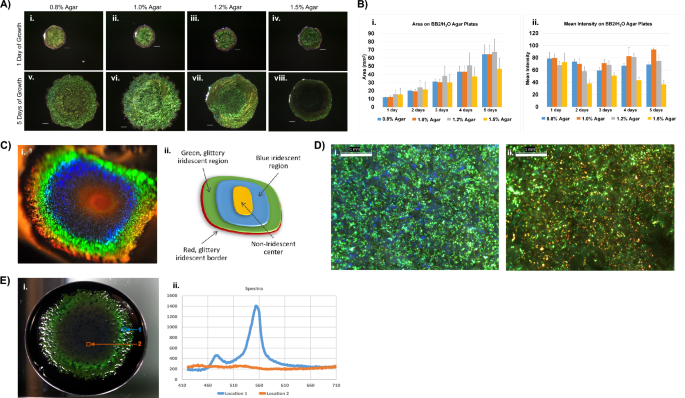
Cellulophaga lytica 7489 Biofilme wuchsen 24 Stunden lang auf BB2/H2O-Medien mit verschiedenen Agarkonzentrationen wurden verglichen (Abb. 1A, B). Die Farbmuster unterschieden sich nach 5 Tagen, wobei das 1.0 %ige Agar die helleren Kolonien unterstützte. Kulturmedien mit mehr als 1.2 % Agar ermöglichten das Wachstum, obwohl die Ausbreitung der Kolonien im Vergleich zu Medien mit 1 % Agar oder weniger eingeschränkt war. Biofilme aus 1.5 % Agar waren kleiner und hatten eine geringere mittlere Pixelintensität. Sofern nicht ausdrücklich angegeben, basierten die übrigen Daten dieser Studie auf Biofilmen von 1 % Agarplatten, die BB2/H enthielten2O. Die fortgesetzte Inkubation auf 1 % Agar führte zu Biofilmen mit konzentrischer Gradientenfärbung (Abb. 1C). Obwohl die relativen Abmessungen und Intensitäten dieser Regionen zwischen den Proben variierten, änderte sich die Reihenfolge der Färbung in reifen Biofilmen nicht. Darüber hinaus verfärbten sich die Biofilmzentren häufig goldorange, möglicherweise aufgrund des Pigments Zeaxanthin, das bekanntermaßen darin enthalten ist C. lytica29. Radial nach außen verlaufend waren die nächsten Farbbänder blau, gefolgt von einem glitzernden Grün und einem schmalen roten Band um den Umfang der Biofilme. Die Vergrößerung zeigte, dass es sich bei den Farben um Mosaike handelte, bei denen die vorherrschende Farbe in diesen Millimeterbereichen die wahrgenommene makroskopische Farbe bestimmte (Abb. 1D). Wichtig ist, dass die Mosaike das Potenzial von zeigen C. lytica Biofilme reflektieren eine Reihe von Farben.
Angesichts besonderer Wachstumsbedingungen C. lytica 7489 bildet intensiv schillernde Biofilme, obwohl zuvor berichtet wurde, dass es ihm an Farbe mangelt. (A) Vertreter C. lytica 7489 Biofilme wurden bei 27 °C auf BB2/H gezüchtet2O-Agarplatten mit 0.8 %, 1.0 %, 1.2 % oder 1.5 % Agar. Biofilme wurden 5 Tage lang jeden Tag abgebildet. Die Agarkonzentration beeinflusst die Farbsättigung und Ausdehnung von DSM 7489 C. lytica Biofilme. Maßstabsbalken = 1 mm. (B) Flächen- (i) und mittlere Intensitätsmessungen (ii) von Biofilmen in A wurden täglich mit ImageJ aufgezeichnet. Die Daten werden als Durchschnittswerte für jeden Zeitpunkt dargestellt, wobei die Standardabweichung als ±Fehler angezeigt wird (n = 10 für jeden Zeitpunkt). (C) C. lytica 7489 ist in der Lage, eine Reihe intensiver Farben zu erzeugen, wie in diesem Foto eines Biofilms aus einem schrägen Betrachtungswinkel (i) und der schematischen Darstellung der konzentrischen Färbung (ii) gezeigt. (D) Optische Bilder, die zeigen, dass Bereiche des Biofilms, die makroskopisch grün (i) und rot (ii) erscheinen, Mosaike aus pointillistischen Farben sind. (Stab = 1 mm) (E) Ein repräsentativer hyperspektraler Datenwürfel zeigt regionalspezifische Variationen der Signalintensität in reifen Biofilmen. (i) Der Biofilm wurde in einer 10-cm-Petrischale auf Nähragar mit schwarzer Tinte gezüchtet. Beachten Sie, dass der Detektor senkrecht zur Oberfläche des Biofilms steht. Seine Position ist der Grund für die Verringerung der Reflexionsintensität im Vergleich zum Biofilm in (C-ich). Äußere Bereiche des Biofilms erzeugen einen besonders scharfen Peak mit einer Mitte bei 550 nm, was auf eine konstruktive und kohärente Reflexion durch den Biofilm hindeutet. (ii, Ort 1) Im Gegensatz dazu bleiben die Reflexionen im mittleren Bereich nahe der Grundlinie. (ii, Standort 2)
Ein Resonon-Tisch-Hyperspektralsystem wurde verwendet, um Datenwürfel zu erzeugen, die die optischen Massenreaktionen von Lebewesen darstellen C. lytica Biofilme (Abb. 1E). Es wurden Spektren gesammelt, die den sichtbaren Bereich abdecken und erhöhte Intensitäten in der Nähe von 550 nm zeigen. Der scharfe Peak deutet darauf hin, dass durch den Biofilm konstruktive und kohärente Reflexionen stattfinden. Im Gegensatz dazu bleiben die mit dem Zentrum des Biofilms verbundenen Intensitäten nahe dem Ausgangsniveau. In anderen Experimenten mit Rückstreugeometrie und variablen Anregungswinkeln wurde eine Abhängigkeit vom Detektionswinkel festgestellt (ergänzende Abbildung). 1).
Zellanordnung, Packung und Morphologie im Inneren C. lytica 7489 Biofilme
Frühere Studien von Flavobacterium Biofilme zeigten, dass Zellabstand und Morphologie die reflektierten Wellenlängen beeinflussen21,30. Um Farbunterschiede zu verstehen C. lytica 7489 Biofilme, komplementäre Mikroskopietechniken wurden angewendet. Die Anordnung von C. lytica innerhalb von Biofilmen wurde mithilfe der konfokalen Mikroskopie von mit SYTO9 gefärbten fixierten Biofilmen sichtbar gemacht (Abb. 2A). Bereiche des Biofilms, die nicht mit Schillern verbunden sind, enthalten zufällig ausgerichtete Zellen, es wurden jedoch auch kleine Ansammlungen ausgerichteter Zellen beobachtet. Auch in dieser Region vorhandene sphärische Strukturen nahmen an Zahl zu, je näher die Abbildungsebene dem Substrat kam (ergänzende Abbildung). 2A). Im Gegensatz dazu waren Zellen in schillernden Regionen dicht gepackt und in planaren, polykristallinen Schichten angeordnet, wie in der schnellen Fourier-Transformation (FFT) des Bildes der grün schillernden Region bestätigt (ergänzende Abbildung). 2B). Die Ordnung blieb über mehrere zehn Mikrometer bestehen, wobei die Korngrenzen durch eine Änderung der Richtung der Zellen angezeigt wurden.
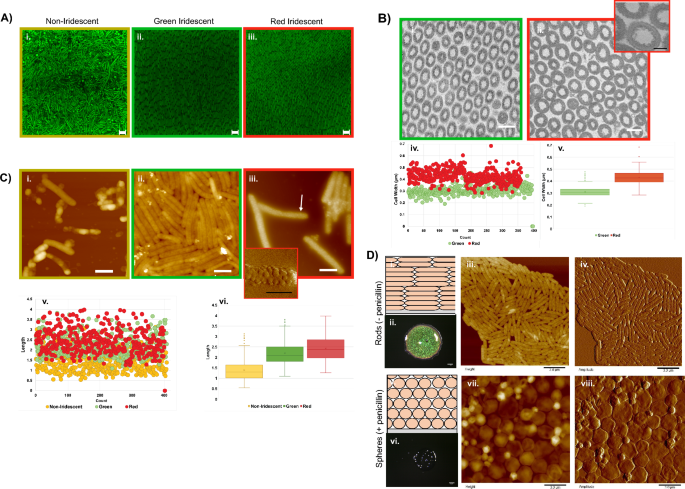
Mikroskopie von Biofilmzellen. (A) Konfokale Bilder von mit SYTO9 gefärbten Biofilmen, die zeigen, dass sich die Zellorganisation zwischen nicht-irisierenden (i) und irisierenden Regionen (ii, iii) unterscheidet (Balken = 2.0 µm). (B) Transmissionselektronenmikroskopische (TEM) Querschnittsbilder von grünen (i) und roten Bereichen (ii). (Balken = 0.5 µm) Einschub (iii) zeigt kleine Vorsprünge rund um die Zellwände (Balken = 200 nm). Auch die Breitenmaße (iv, v) unterscheiden sich je nach Region. (C) Rasterkraftmikroskopie (AFM)-Höhenbilder von nicht irisierenden (i), grün irisierenden (ii) und rot irisierenden (iii) Regionen, die zeigen, dass mit jeder Region unterschiedliche Zellmorphologien verbunden sind (Balken = 1.0 µm). Einschub (iv) ist ein AFM-Amplitudenbild des durch den Pfeil angezeigten Bereichs (Balken = 0.5 µm). Längenmessungen von bestimmten Biofilmregionen (v, vi). (D) 2 Tage alte Biofilme, die unter Umgebungsbedingungen auf BB2/H gewachsen sind2O-Agar (optische Maßstabsbalken = 1 mm; AFM-Balken = 3 µm). Schematische Darstellung der typischen Anordnung von Zellen in schillernden Biofilmen (i). Optisches Bild eines schillernden Biofilms. (ii) AFM-Höhenbilder (iii) und Amplitudenbilder (iv) von Zellen aus irisierendem Biofilm, die die typische stäbchenförmige Morphologie zeigen. Schematische Darstellung der vorhergesagten Anordnung von Zellen in Biofilmen, die unter Zugabe von subletalem Penicillin wachsen (v). Optisches Bild eines Biofilms, das zeigt, dass subletales Penicillin die Strukturfärbung stört. (vi) AFM-Höhenbilder (vii) und Amplitudenbilder (viii) von Zellen bestätigen die Umwandlung in Kugeln aufgrund der Penicillinbehandlung.
Eukaryoten betten Komponenten ein, die zum Schillern in Geweben beitragen und während der Untersuchung gehandhabt und manipuliert werden können. C. lytica Das Schillern entsteht jedoch durch unabhängige, lose verbundene Zellen, die durch mechanische Störungen, einschließlich Turbulenzen aufgrund übermäßiger Flüssigkeitszufuhr, leicht getrennt werden können. Die Vernetzung der Zellen mit Glutaraldehyd bewahrte das Schillern und ermöglichte die Entfernung intakter Biofilme vom Agar zur Charakterisierung durch Transmissionselektronenmikroskopie (TEM). Elektronenmikroskopische Querschnittsaufnahmen von festen C. lytica 7489 Biofilme bestätigten die Periodizität in irisierenden Bereichen (Abb. 2B). Zellen im grünen und roten Bereich hatten eine mittlere Breite von 310 nm bzw. 428 nm, was darauf hindeutet, dass Änderungen in der Zellbreite zu Farbvariationen beitrugen. Außerdem zeigten TEM-Bilder mit höherer Vergrößerung von Zellen aus dem roten Bereich kleine Vorsprünge rund um die Zellwände (Abb. 2B-iii). Seitliche Bilder von Biofilmen, die mithilfe der Rasterelektronenmikroskopie (REM) aufgenommen wurden, zeigen, dass die Ordnung über die gesamte Dicke der Biofilme erfolgt, die zwischen 15 und 60 µm liegt (ergänzende Abbildung). 2C).
Angesichts der in den TEM-Daten beobachteten Breitenunterschiede und der Assoziation mit bestimmten Regionen des Biofilms versuchten wir, die Morphologien von Zellen mithilfe der Rasterkraftmikroskopie (AFM) zu vergleichen (Abb. 2C). Zellen aus der nicht schillernden Region waren unregelmäßig, mit kugelförmigen Vorsprüngen verbunden und wirkten oft entleert. Im Gegensatz dazu behielten Zellen sowohl aus den rot als auch grün schillernden Regionen regelmäßige Morphologien und Abmessungen bei, wie es bei gesunden stäbchenförmigen Bakterien zu erwarten war. Trotz wiederholter Versuche, Aggregate aufzubrechen, blieben Zellen aus grün schillernden Regionen eng verbunden, was darauf hindeutet, dass die Zelloberflächeneigenschaften auch je nach Region unterschiedlich waren (Abb. 2C-ii). Im krassen Gegensatz dazu waren Zellen aus der roten Region oft mit Membranvesikeln bedeckt (Abb. 2C-iii und iv und ergänzende Abb. 3). Gramnegative Bakterien einschließlich C. lytica Es ist bekannt, dass sie Vesikel der äußeren Membran erzeugen31,32. Auffällig war jedoch die vollständige Oberflächenbedeckung durch die Vesikel. Die besser definierten AFM-Bilder deuteten darauf hin, dass es sich bei den in den TEM-Querschnitten beobachteten Membranvorsprüngen um Vesikel handelte. Ein Vergleich der Längen der Zellen aus den verschiedenen Regionen ergab, dass nicht-irisierende Zellen mit Mittelwerten von 1.39 µm, 2.20 µm bzw. 2.42 µm kürzer sind als diejenigen in den grünen oder roten Regionen (Abb. 2Lebenslauf, vi). Zusammengenommen zeigten die Bilddaten je nach Position der Zellen im Biofilm unterschiedliche Größen- und Oberflächentopologien.
Peptidoglycan in gramnegativen Bakterien ist ein käfigartiges Polymer, das für die mechanische Stabilität der Zelle sorgt. Zwischen der Zytoplasmamembran und der Außenmembran gelegen, bestimmt seine Form die Morphologie der Bakterien. Es ist allgemein bekannt, dass Lysozym- und Beta-Lactam-Antibiotika das Peptidoglycan zerstören und zur Zelllyse führen. Bei subletalen Dosen können jedoch auch gramnegative Bakterien vorkommen E. coli überleben die Behandlung, werden aber von Stäbchen in Kugeln umgewandelt33,34,35. Um festzustellen, ob für die Färbung intaktes Peptidoglycan erforderlich ist, wurden den Agarplatten vor der Inokulation 30 µg/ml Penicillin zugesetzt C. lytica (Feige. 2D). Nach 48 Stunden fehlte den behandelten Biofilmen aufgrund der Umwandlung von Irideszenz C. lytica in Kugeln, was auf die Bedeutung des Peptidoglycans für das Schillern hinweist. Diese Ergebnisse zeigten auch, dass exogene formmodifizierende Reagenzien verwendet werden können, um die optischen Eigenschaften von Biofilmen zu beeinflussen.
Skalierbarkeit und Abstimmbarkeit von Biofilmen für die Herstellung
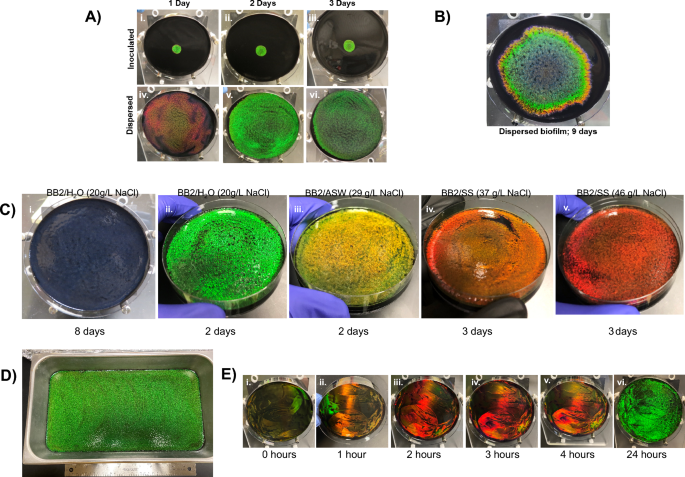
Cellulophaga lytica Biofilme dehnten sich vom Inokulationspunkt aus radial aus und zeigten gebänderte Farben (Abb. 1A). Diese Musterung war wahrscheinlich eine Folge zeitlicher Unterschiede in der Zellmorphologie, die durch Veränderungen in der lokalen Umgebung (z. B. Nährstoffverfügbarkeit, pH-Wert, Metaboliten usw.) während des Zellwachstums hervorgerufen wurden. Da monochrome Biofilme konsistente Morphologien anzeigen würden, gingen wir davon aus, dass die gleichzeitige Zugabe von ausreichend Zellen zur gesamten Agaroberfläche alle Zellen gleichzeitig derselben Umgebung aussetzen und die reflektierte Farbe synchronisieren würde. Diese Hypothese wurde getestet, indem Biofilme, die mit einem lokalisierten 100-µL-Inokulum initiiert wurden, mit denen verglichen wurden, bei denen das gleiche Inokulumvolumen mithilfe eines Zellverteilers über dem Agar verteilt wurde. (Feige. 3A) Repräsentative Fotografien zeigen, dass inokulierte Biofilme nach einem Tag Wachstum unter Umgebungsbedingungen ein hellgrünes Schillern um die Mitte der Platte herum reflektierten, während verteilte Biofilme auf der Plattenoberfläche diffus rot waren. Nach zwei Tagen Wachstum zeigten beide Präparate ein hellgrünes Schillern, obwohl verteilte Biofilme die gesamte Oberfläche des Agars bedeckten. Die Irisierung in dispergierten Biofilmen ließ nach 1 Tagen deutlich nach. Mit zunehmender Zeit dehnten sich die beimpften Biofilme aus und bedeckten den größten Teil der Agaroberfläche (Abb. 3B). Daher verkürzte die Verteilung der Zellen sowohl die Zeit bis zum optimalen Schillern als auch die Fläche der Platte, die mit geordneten monochromatischen Bakterien bedeckt war.
Da Kientz et al. zeigten, dass der Salzgehalt die Färbung von CECT 8139-Biofilmen beeinflusst, DSM 7489-Biofilme wurden in ähnlicher Weise getestet27 (Feige. 3C). Die Medien wurden entweder mit dem Meersalzanalogon Instant Ocean (BB2/ASW) oder Lake Products Sea Salt ASTM D1141-98 (BB2/SS) angereichert. Im Vergleich zu den verteilten Biofilmen auf BB2/H2O, das Wachstum auf BB2/ASW und BB2/SS erzeugte nahezu monochrome Kolonien mit Rotverschiebungen, die mit der Menge des dem Medium zugesetzten Meersalzanalogons korrelierten. Da sich die Analoga hauptsächlich in der NaCl-Konzentration unterscheiden, haben wir getestet, ob eine Erhöhung der NaCl-Konzentration ausreicht, um die rotverschobenen Farben durch das Wachstum von Biofilmen auf BB2/H zu erzeugen2O-Platten, ergänzt mit unterschiedlichen Mengen NaCl (ergänzende Abb. 4A). Steigende NaCl-Konzentrationen in lokalisierten Platten führten zu rotverschobenen Farben und ermöglichten so eine exogene Manipulation der Eigenschaften des Biofilms. Die in Abb. 1 Reflektiere das Angebot von Farben, die erzeugt werden können C. lytica Biofilme. Hier zeigen wir, dass es sich um Rot handelt, eine frühe Farbe auf BB2/H2O-Agarplatten wurden durch Erhöhung des Salzgehalts des Wachstumsmediums erzeugt, während Blau durch Verlängerung der Wachstumsperiode erzeugt wurde. Zusammenfassend kommen wir zu dem Schluss, dass der zeitliche Aspekt der Färbung von zellulären Reaktionen auf die lokale Umgebung abhängt.
Monochrome Biofilme. (A) Ein Vergleich von inokulierten (i–iii) und dispergierten (iv–vi) Biofilmen bei Umgebungstemperatur. Dispergierte Biofilme erreichen ihren Höhepunkt in monochromer Farbe und füllen die Platte nach 2 Tagen (v). (B) Inokulierte Biofilme hingegen entwickeln eine Streifenfärbung und benötigen deutlich mehr Zeit, um die Oberfläche zu bedecken. (C) Fotos, die das Zerstreuen zeigen C. lytica Zellen führt zu monochromen Biofilmen verschiedener Farben, vermutlich dadurch, dass alle Zellen gleichzeitig homogenen Wachstumsbedingungen (Nährstoffen, Metaboliten usw.) ausgesetzt werden. Auf die Farbpalette kann durch eine Verlängerung der Wachstumsperiode (i) oder eine Änderung des Salzgehalts des Mediums (ii – v) unter Verwendung von Meerwassersimulanzien zugegriffen werden. Wirksames NaCl im Rezept in Klammern. Die Platten wurden für die angegebene Zeit unter Umgebungsbedingungen gezüchtet. (D) Ein großer grüner Biofilm wurde innerhalb von 3 Tagen unter Umgebungsbedingungen erzeugt, indem ein proportionales Inokulum auf der Oberfläche einer 41 x 23 cm großen Pfanne verteilt wurde. (E) Die aufeinanderfolgende Anwendung und Verteilung von 50-fach konzentrierten Aliquots der Kultur reduziert die Bildung monochromer Biofilme auf 24 Stunden oder weniger, was darauf hindeutet, dass die Zellen sofort mit der Organisation beginnen und dass die Zelldichte ein wichtiger Gesichtspunkt für industrielle Fertigungsanwendungen sein wird. Zwischen den Zellanwendungen wurden die Platten bei 27 °C inkubiert. Weitere Versuche sind in der ergänzenden Abbildung dargestellt 4E,F.
Das Verteilen eines proportional größeren Inokulums auf einer 41 cm × 23 cm großen Agaroberfläche erzeugte nach dreitägiger Inkubation bei Raumtemperatur einen oberflächenfüllenden monochromen Biofilm, wohingegen ein lokalisiertes Inokulum zu einem begrenzten schillernden Bereich führte (Abb. 3D, Ergänzung 4B). Um die Zeit für die Erzeugung großflächiger monochromer Biofilme weiter zu verkürzen, haben wir getestet, ob eine Erhöhung der Zellen im Inokulum zu einer schnelleren Irisierung führt. Insbesondere wurden Übernachtkulturen konzentriert, bevor die Zellen auf dem Agar verteilt wurden. Die Geschwindigkeit, mit der das Schillern auftrat, korrelierte mit der Konzentration des über die Oberfläche verteilten Inokulums (ergänzende Abbildung). 4C). Eine Schichtungsstrategie beschleunigte die Irisbildung weiter, indem 50-fach konzentrierte Zellen nacheinander auf die Agarplatten aufgetragen wurden (Abb. 3E, Ergänzende Abbildungen. 4E, 4F, 5, 6) Bemerkenswerterweise traten früh leuchtende gelbe und rote Reflexe auf, was mit der Farbsequenz in den beimpften Biofilmen übereinstimmt, bei der vorübergehend Rot am Rand der beimpften Platte zu sehen ist, gefolgt von Grün. Nach 24 Stunden spiegelte sich die gesamte Platte grün. Zusammengenommen zeigen diese Ergebnisse, dass Zellen sich schnell zu photonischen Strukturen organisieren können und dass die Zellzahl ein limitierender Faktor für die Bildung schillernder Biofilme ist.
Einbindung von Biofilmen in Materialien
Das Wachstum auf porösen Substraten, darunter qualitatives Filterpapier (Whatman, Grad 2), Polyester-Track-Etch-Membranen (Sterlitech), Baumwollgewebe und Seide auf Nähragar, wurde getestet. Medienretention und Nährstoffdiffusion ermöglichten das Wachstum und die Ausbreitung von Biofilmen auf diesen Substraten. Wichtig ist, dass die reflektierten Farbmuster denen von Biofilmen ähnelten, die direkt auf den Agarplatten gewachsen waren (Abb. 4). Von den getesteten Substraten wurde Filterpapier aufgrund der Qualität des schillernden Biofilms, der geringen Substratkosten und der Flexibilität für weitere Untersuchungen ausgewählt. Nach dem Wachstum wurden papierassoziierte Biofilme (PABs) zur Fixierung auf Glutaraldehyd enthaltenden Agar übertragen, um das Schillern zu bewahren. Das Papier erleichterte die Handhabung des Biofilms während der Charakterisierung und der anschließenden Verarbeitung. Das Schillern der PABs ging nach dem Trocknen verloren, wurde jedoch durch die Zugabe von Wasser schnell wiederhergestellt (Abb. 4C). PABs überstanden mehrere Trocknungs- und Rehydrierungszyklen mit minimalem Verlust der Schillerung. AFM-Aufnahmen der fixierten Papierbiofilme bestätigten die kristalline Anordnung der Zellen (ergänzende Abbildung). 7B).
Das Wachstum schillernder Biofilme auf porösen Substraten, einschließlich Papier, erleichtert die Handhabung zur Charakterisierung und Weiterverarbeitung. (A) C. lytica Biofilme wurden unter Umgebungsbedingungen auf verschiedenen porösen Substraten gezüchtet. (B) Auf Nähragar platziertes Whatman-2-Filterpapier ist eines von mehreren porösen Substraten, die dies ermöglichen C. lytica um schillernde Kolonien zu bilden. Wie auf Agarplatten sind lebende papierassoziierte Biofilme (PABs) nach drei Tagen Wachstum auf BB3/H grün2O-Agar (Ai) und rotverschoben, wenn der Salzgehalt zunimmt, wie bei BB2/SS (A-ii). (C) PABs behalten ihr Schillern nach der Entfernung vom Agar und der Fixierung mit Glutaraldehyd (Bi). Das Trocknen der fixierten PABs mit Stickstoff führt dazu, dass sie ihr Schillern verlieren (B-ii). Allerdings wird die Strukturfarbe bei Rehydrierung wiederhergestellt (B-iii). (D) Lebende PABs behalten ihre Fähigkeit, auf Umweltreize zu reagieren. PABs von BB2/H2O-Agar reflektieren größtenteils grün, bis sie auf BB2/SS-Platten verschoben werden, wo die Reflexionen rot verschoben werden (Ci bzw. C-ii). Ebenso sind PABs, die von BB2/SS-Agarplatten stammen, rot, wechseln aber zu Grün, wenn sie auf BB2/H platziert werden2O (C-iv bzw. Cv). In beiden Fällen können Biofilme wieder ihre ursprüngliche Farbe annehmen, wenn sie in den ursprünglichen Medienzustand zurückversetzt werden (C-iii und C-vi). Feste Biofilme zeigen dieses dynamische Verhalten nicht (C-vii und C-viii).
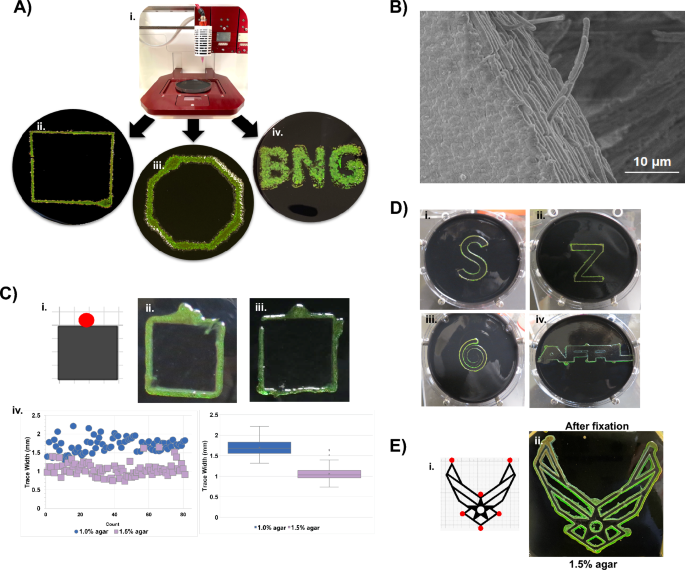
C. lytica kann als schillernder Bioink verwendet werden. (A) 3D-gedruckte Designs enthalten C. lytica wurden auf Agar mit einem Allevi 3 Bioprinter-Setup (Ai bis A-iv) erzeugt. Wie bereits für verteilte Biofilme gezeigt, führt ein erhöhter Salzgehalt zu einer Rotverschiebung C. lytica Tintenreflexion. (Ergänzende Abb. 9) (B) REM-Aufnahme der Kante des 3D-gedruckten Biofilms, die geordnete Zellen des gedruckten Biofilms zeigt. (C, D) C. lytica Zeichnen Sie die Kanten einer Papiervorlage nach (z. B. Schaltplan in Ci). Der rote Kreis auf dem Schablonendesign zeigt die Impfstelle an. Zellen verhalten sich wie ein selbstdruckender Bioink, der unter Umgebungsbedingungen verschiedene Muster schreibt. (B) Eine Erhöhung der Agarkonzentration von 1.0 % (C-ii) auf 1.5 % (C-iii) verringert die Breite der Spur, wie in Keyence-Messungen (C-iv) gezeigt. Dieses Ergebnis legt nahe, dass die Gleitmotilität so moduliert wird, dass die Zellen näher an der Matrize auf dem Agar mit höherer Konzentration gehalten werden. (D) Zusätzliche Nachzeichnungen zeigen, dass BACTracing mit Formen unterschiedlicher Komplexität, Winkel und Verbindungen verwendet werden kann. Die Agarkonzentration kann verwendet werden, um die Spuren einzugrenzen, wenn der Abstand zwischen den Merkmalen klein ist, wie es bei komplizierten Mustern wie dem Air Force-Symbol der Fall ist (ergänzende Abbildung). 6C). (E) Vorlage eines komplexen Musters (i) und seines BACTraced-Gegenstücks (ii) nach der Fixierung, was zeigt, dass das schillernde Muster erhalten bleiben kann.
Lebende PABs (dh ohne Fixierung) behielten ihre Fähigkeit, auf Umweltreize zu reagieren. Zum Beispiel PABs auf BB2/H2O-Agarplatten reflektierten größtenteils grün, bis sie auf BB2/SS-Platten verschoben wurden, wo die Reflexion rot verschoben wurde und umgekehrt (Abb. 4D). In beiden Fällen nahmen die Biofilme wieder ihre ursprüngliche Farbe an, als sie in den ursprünglichen Medienzustand zurückversetzt wurden (ergänzende Abbildung). 8A). Diese Umkehrung trat nicht auf, wenn die Zellen mit Glutaraldehyd fixiert wurden, was bestätigt, dass die Fähigkeit der lebenden Zellen, wahrzunehmen und darauf zu reagieren, für die Farbveränderungen erforderlich war. Wie bei den lokalisierten und verteilten Biofilmen können exogene Reagenzien wie Penicillin und Lysozym über das Papiersubstrat an den Biofilm abgegeben werden, um die Biofilmeigenschaften zu steuern (ergänzende Abbildung). 8B).
Cellulophaga lytica Biofilme als schillernde Tinten
Ich versuche, geordnete Bakterientinten zu entwickeln, die darauf basieren C. lyticaEin Allevi 3™-Biodrucker wurde verwendet, um die Zellen in vorprogrammierten Mustern abzulegen, und Google SketchUp wurde verwendet, um STL-Designdateien zu erstellen, die von Formen bis zu Buchstaben reichen. Gedruckte Kulturen behielten die gewünschten Muster auf BB2/H bei2O-Platten nach Inkubation und Wachstum bei 27 °C (Abb. 5A). Die Muster wurden auch auf BB2/ASW-Agarplatten gedruckt, wo ein erhöhter Salzgehalt wiederum die Farbe rot verschob. (Ergänzende Abb. 9A) Nachfolgende SEM-Bilder der vernetzten Biofilme zeigten, dass die Bakterien dicht gepackt und in den gedruckten Formen geordnet waren (Abb. 5B).
Die Beweglichkeit von Bakteriodeten ist für die Erzeugung schillernder Biofilme erforderlich20,30. Konfokale Bilder aus dieser Studie zeigen die Ausrichtung zwischen Zellen, die wahrscheinlich auf einen gerichteten Zellfluss auf der Agaroberfläche in Kombination mit Grenzflächeninteraktionen zurückzuführen ist. Wir stellten die Hypothese auf, dass Hindernisse auf dem Weg gleitender Zellen die Richtung des Zellflusses ändern würden und dass diese behindernde Steuerung zu einer Art „selbstdruckender“ Bakterientinte führen könnte. Um diese Idee zu testen, wurden Papierschablonen auf Nähragarplatten gelegt, bevor neben dem Papier ein Inokulum hinzugefügt wurde (Abb. 5C, ergänzende Abb. 9B) Während der Inkubation erzeugten die Zellen durch einen Prozess, den wir bakterielle autonome kollektive Verfolgung (auch bekannt als „BACTracing“) nennen, schillernde Spuren entlang der Ränder der Schablonen. BACTracing trat sowohl auf 1 %- als auch auf 1.5 %-Agarplatten auf, die höhere Agarkonzentration führte jedoch zu schmaleren Spuren. Die Temperatur beeinflusst auch die Qualität der mit BACTracing generierten Muster (ergänzende Abbildung). 10). Immer komplexere Muster wurden unter Verwendung einer kleinen Anzahl von Impfstellen gedruckt, was darauf hindeutet, dass BACTracing ein einfacher Ansatz für das fortschrittliche Drucken von lebendem Material sein kann (Abb. 5E).
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoData.Network Vertikale generative KI. Motiviere dich selbst. Hier zugreifen.
- PlatoAiStream. Web3-Intelligenz. Wissen verstärkt. Hier zugreifen.
- PlatoESG. Automobil / Elektrofahrzeuge, Kohlenstoff, CleanTech, Energie, Umwelt, Solar, Abfallwirtschaft. Hier zugreifen.
- PlatoHealth. Informationen zu Biotechnologie und klinischen Studien. Hier zugreifen.
- ChartPrime. Verbessern Sie Ihr Handelsspiel mit ChartPrime. Hier zugreifen.
- BlockOffsets. Modernisierung des Eigentums an Umweltkompensationen. Hier zugreifen.
- Quelle: https://www.nature.com/articles/s41598-023-38797-0