17. Januar 2024
(Nanowerk-Neuigkeiten) Forscher des Nano Life Science Institute (WPI-NanoLSI) der Universität Kanazawa berichten in Nano-Buchstaben („Strukturelle Dynamik der E6AP-E3-Ligase-HECT-Domäne und Beteiligung der flexiblen Scharnierschleife am Ubiquitin-Kettensynthesemechanismus“) wie die Flexibilität eines Proteinscharniers eine entscheidende Rolle beim Transfer von Proteinen in wichtigen Zellprozessen spielt.
Auffälliges Bild: Echtzeitbeobachtung und Simulation von Konformationsänderungen der E6AP-HECT-Domäne.
Die HECT-Domäne wiederholt sphärische und elliptische Konformationen durch die flexible Region. Computersimulationsergebnisse zeigen, dass die Kugelform der katalytischen Struktur und die ovale Form der L-förmigen Struktur entspricht. Die Bildungseffizienz des Ubiquitin-Dimers (Ub2) ändert sich erheblich in Abhängigkeit vom Konformationszustand der flexiblen Gelenkregion. Ubiquitinierung – die Zugabe des Proteins Ubiquitin – ist ein Schlüsselschritt in vielen Zellprozessen, wie Proteinabbau, DNA-Reparaturen und Signaltransduktion. Mithilfe von Hochgeschwindigkeits-Rasterkraftmikroskopie (HS-AFM) und molekularer Modellierung haben Forscher unter der Leitung von Hiroki Konno und Holger Flechsig am WPI-NanoLSI der Kanazawa-Universität herausgefunden, wie die Beweglichkeit eines mit der Ubiquitinierung verbundenen Enzymscharniers die Ubiquitinierung ermöglicht. Frühere Studien haben eine Reihe von Enzymen identifiziert, die die Ubiquitinierung erleichtern, darunter ein Enzym, das Ubiquitin aktiviert (E1), ein Enzym, das es konjugiert (E2), und ein Enzym, das die Bindung von Ubiquitin-Protein an das Zielprotein katalysiert (d. h. eine Ligase, E3) ( Abb. 1).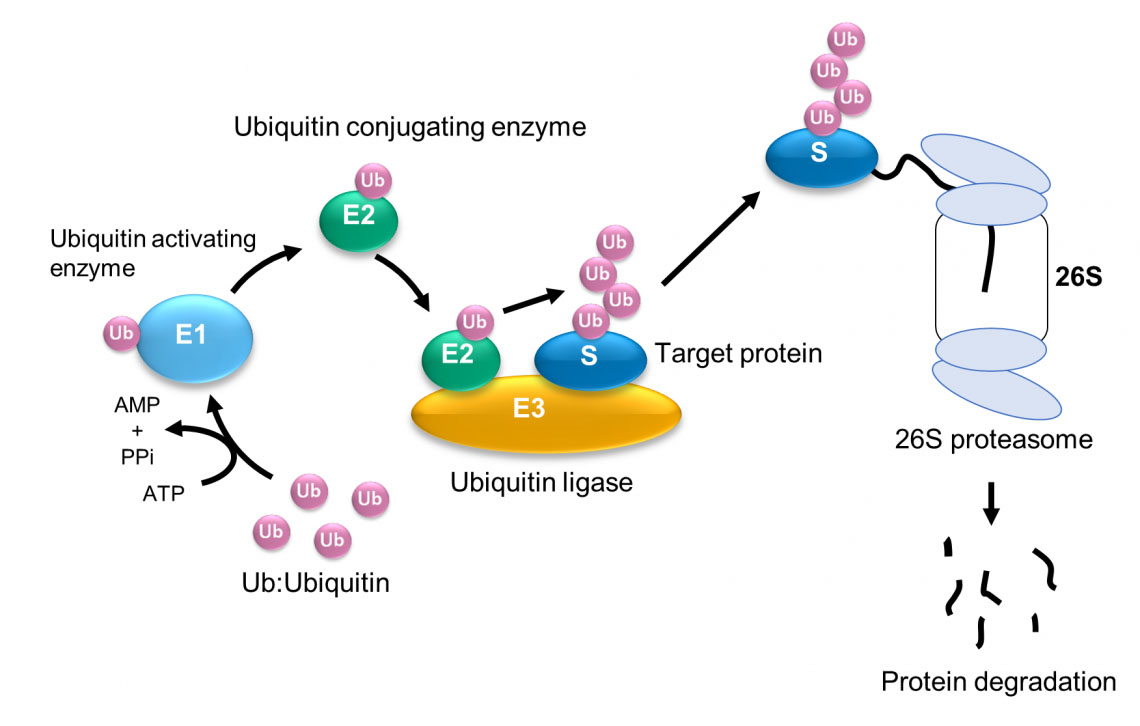 Abb. 1: Ubiquitinierung und Abbau von Proteinen durch das Ubiquitin-Proteasom-System. (© 2023 Takeda)
Die E3-Ligase vom HECT-Typ ist durch eine HECT-Domäne gekennzeichnet, die einen N-Lappen mit der E2-Bindungsstelle und einen C-Lappen mit einem katalytischen Cys-Rest umfasst. Ein flexibles Gelenk verbindet die beiden Lappen, was zu der Hypothese führt, dass die Ubiquitinierung durch erleichtert wird die Neuordnung des Proteins um dieses Scharnier. Konno und ihre Mitarbeiter setzten ihr Hochgeschwindigkeits-Rasterkraftmikroskop ein, um nach Beweisen dafür zu suchen, dass dies der Fall war.
Die Forscher stellten fest, dass die HECT-Domäne beim Kristallisieren mit einer Art E2-Enzym eine L-Form bildete, sodass der Abstand zwischen dem katalytischen Cys-Rest der HECT-Domäne und dem katalytischen Cys des E2-Enzyms 41 Å betrug – zu weit für die Übertragung von Ubiquitin. Allerdings hat die HECT-Domäne in ihrer katalytischen Konformation eine andere Form, bei der der Abstand zwischen den beiden katalytischen Cys-Resten viel geringer ist – nur 8 Å –, sodass man davon ausgeht, dass es sich hierbei um eine „katalytische Konformation“ handelt.
Die Analyse von HS-AFM-Bildern einer Wildtyp-HECT-Domäne von E6AP ergab zwei Konformationen – eine davon sah kugelförmig und die andere oval aus (Abb. 2). Mithilfe von AFM-Simulationen führten sie die ovalen Formen auf die L-Konformation zurück, und die sphärischen Formen sind entweder die katalytische Konformation oder die sogenannte invertierte T-Konformation, die in einer anderen Art von HECT-Domäne beobachtet wurde, bei der der Abstand zwischen den Cys-Resten 16 Å beträgt ( Abb. 2). Um die räumlich-zeitlichen Auflösungsbeschränkungen der Bildgebung zu überwinden, wurden die Experimente durch molekulare Modellierung ergänzt, um Konformationsbewegungen der HECT-Domäne auf atomarer Ebene zu visualisieren. Mithilfe von Simulations-AFM wurde ein entsprechender Pseudo-AFM-Film erstellt, der den Wechsel von der sphärischen zur ovalen Topographie deutlich zeigte (Abb. 2).
Abb. 1: Ubiquitinierung und Abbau von Proteinen durch das Ubiquitin-Proteasom-System. (© 2023 Takeda)
Die E3-Ligase vom HECT-Typ ist durch eine HECT-Domäne gekennzeichnet, die einen N-Lappen mit der E2-Bindungsstelle und einen C-Lappen mit einem katalytischen Cys-Rest umfasst. Ein flexibles Gelenk verbindet die beiden Lappen, was zu der Hypothese führt, dass die Ubiquitinierung durch erleichtert wird die Neuordnung des Proteins um dieses Scharnier. Konno und ihre Mitarbeiter setzten ihr Hochgeschwindigkeits-Rasterkraftmikroskop ein, um nach Beweisen dafür zu suchen, dass dies der Fall war.
Die Forscher stellten fest, dass die HECT-Domäne beim Kristallisieren mit einer Art E2-Enzym eine L-Form bildete, sodass der Abstand zwischen dem katalytischen Cys-Rest der HECT-Domäne und dem katalytischen Cys des E2-Enzyms 41 Å betrug – zu weit für die Übertragung von Ubiquitin. Allerdings hat die HECT-Domäne in ihrer katalytischen Konformation eine andere Form, bei der der Abstand zwischen den beiden katalytischen Cys-Resten viel geringer ist – nur 8 Å –, sodass man davon ausgeht, dass es sich hierbei um eine „katalytische Konformation“ handelt.
Die Analyse von HS-AFM-Bildern einer Wildtyp-HECT-Domäne von E6AP ergab zwei Konformationen – eine davon sah kugelförmig und die andere oval aus (Abb. 2). Mithilfe von AFM-Simulationen führten sie die ovalen Formen auf die L-Konformation zurück, und die sphärischen Formen sind entweder die katalytische Konformation oder die sogenannte invertierte T-Konformation, die in einer anderen Art von HECT-Domäne beobachtet wurde, bei der der Abstand zwischen den Cys-Resten 16 Å beträgt ( Abb. 2). Um die räumlich-zeitlichen Auflösungsbeschränkungen der Bildgebung zu überwinden, wurden die Experimente durch molekulare Modellierung ergänzt, um Konformationsbewegungen der HECT-Domäne auf atomarer Ebene zu visualisieren. Mithilfe von Simulations-AFM wurde ein entsprechender Pseudo-AFM-Film erstellt, der den Wechsel von der sphärischen zur ovalen Topographie deutlich zeigte (Abb. 2).
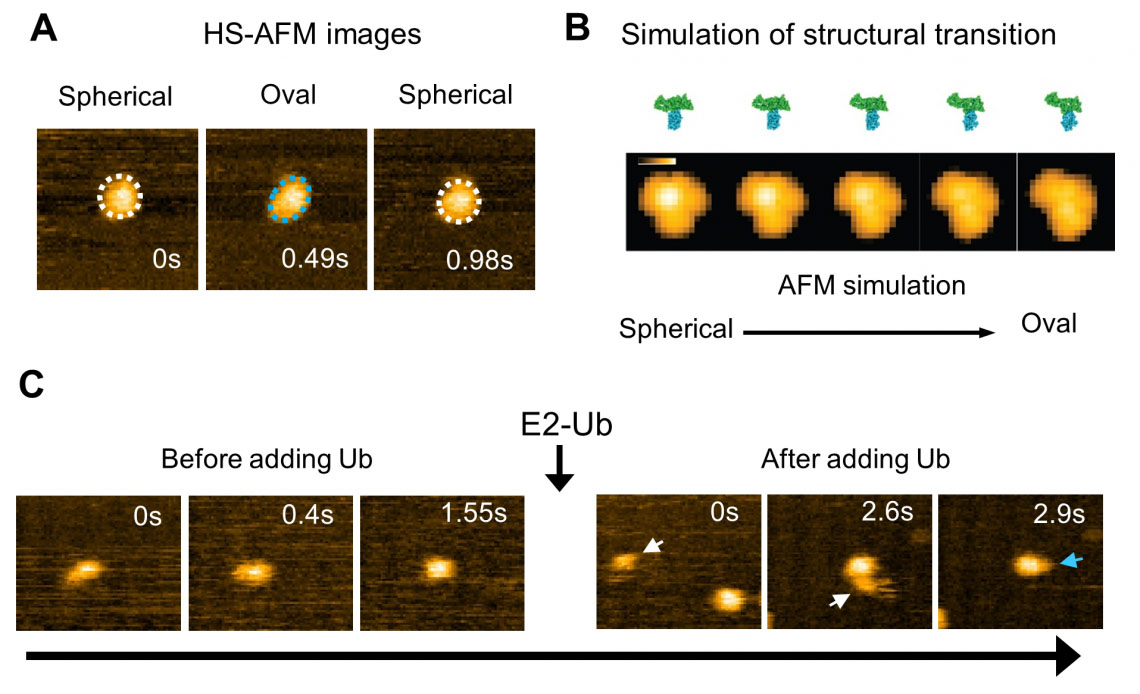 Abb. 2: Hochgeschwindigkeits-AFM-Beobachtung und Simulation der Strukturdynamik der HECT-Domäne von E6AP. (A) HS-AFM-Bild der HECT-Domäne. Es wurden sphärische (weiße gepunktete Linie) und ovale (blaue gepunktete Linie) Konformationszustände beobachtet. (B) Simulierter Übergangsprozess des Strukturzustands der HECT-Domäne und ihres Pseudo-AFM-Bildes. (C) Ubiquitin (Ub) wird von E2 auf E3 (HECT-Domäne) übertragen. Nach der Zugabe von Ubiquitin-haltigem E2 (E2-Ub) bindet E2-Ub (weißer Pfeil) an die HECT-Domäne, und nachdem E2 dissoziiert, wird ein kleines Partikel (blauer Pfeil), das Ubiquitin zu sein scheint, an die HECT-Domäne hinzugefügt . (© 2023 Takeda)
„Allerdings erlauben uns experimentelle Einschränkungen nicht, die Zwischenkonformationen aufzulösen“, erklären die Forscher in ihrem Arbeitsbericht. „Die durchgeführte Modellierung liefert Beweise dafür, dass die unter HS-AFM beobachteten Übergänge zwischen sphärischen und ovalen HECT-Domänenformen funktionellen Konformationsbewegungen entsprechen, bei denen sich der C-Lappen relativ zum N-Lappen dreht und dadurch den Wechsel zwischen katalytischer und L-Form ermöglicht.“ HECT-Konformationen.“
Weitere Experimente mit mutierten HECT-Domänen mit geringerer Flexibilität im Gelenk ergaben keinen Wechsel zwischen Konformationen – die mutierten HECT-Domänen waren in der katalytischen Konformation fixiert. Sie fanden auch heraus, dass diese mutierten HECT-Domänen zwar zwei Ubiquitin-Proteine bilden konnten, die effizienter als der Wildtyp miteinander verbunden waren.
E6AP, in dieser Studie das E3 vom HECT-Typ, interagiert mit dem E6-Protein, das vom humanen Papillomavirus (HPV) stammt, und ubiquitiniert p53, ein Tumorsuppressorprotein. Es ist auch bekannt, dass die Ubiquitinierung von p53 durch E6AP und E6 eine Hauptursache für Gebärmutterhalskrebs ist. Der Mechanismus der p53-Ubiquitinierung durch die Interaktion von E6AP- und E6-Proteinen bleibt jedoch unklar. In Zukunft werden wir die Strukturdynamik von E6AP/E6 und des E6AP/E6/p53-Komplexes mit HS-AFM aufklären und klären, wie E6 die Aktivität der p53-Ubiquitinierung durch E6AP erhöht.
Abb. 2: Hochgeschwindigkeits-AFM-Beobachtung und Simulation der Strukturdynamik der HECT-Domäne von E6AP. (A) HS-AFM-Bild der HECT-Domäne. Es wurden sphärische (weiße gepunktete Linie) und ovale (blaue gepunktete Linie) Konformationszustände beobachtet. (B) Simulierter Übergangsprozess des Strukturzustands der HECT-Domäne und ihres Pseudo-AFM-Bildes. (C) Ubiquitin (Ub) wird von E2 auf E3 (HECT-Domäne) übertragen. Nach der Zugabe von Ubiquitin-haltigem E2 (E2-Ub) bindet E2-Ub (weißer Pfeil) an die HECT-Domäne, und nachdem E2 dissoziiert, wird ein kleines Partikel (blauer Pfeil), das Ubiquitin zu sein scheint, an die HECT-Domäne hinzugefügt . (© 2023 Takeda)
„Allerdings erlauben uns experimentelle Einschränkungen nicht, die Zwischenkonformationen aufzulösen“, erklären die Forscher in ihrem Arbeitsbericht. „Die durchgeführte Modellierung liefert Beweise dafür, dass die unter HS-AFM beobachteten Übergänge zwischen sphärischen und ovalen HECT-Domänenformen funktionellen Konformationsbewegungen entsprechen, bei denen sich der C-Lappen relativ zum N-Lappen dreht und dadurch den Wechsel zwischen katalytischer und L-Form ermöglicht.“ HECT-Konformationen.“
Weitere Experimente mit mutierten HECT-Domänen mit geringerer Flexibilität im Gelenk ergaben keinen Wechsel zwischen Konformationen – die mutierten HECT-Domänen waren in der katalytischen Konformation fixiert. Sie fanden auch heraus, dass diese mutierten HECT-Domänen zwar zwei Ubiquitin-Proteine bilden konnten, die effizienter als der Wildtyp miteinander verbunden waren.
E6AP, in dieser Studie das E3 vom HECT-Typ, interagiert mit dem E6-Protein, das vom humanen Papillomavirus (HPV) stammt, und ubiquitiniert p53, ein Tumorsuppressorprotein. Es ist auch bekannt, dass die Ubiquitinierung von p53 durch E6AP und E6 eine Hauptursache für Gebärmutterhalskrebs ist. Der Mechanismus der p53-Ubiquitinierung durch die Interaktion von E6AP- und E6-Proteinen bleibt jedoch unklar. In Zukunft werden wir die Strukturdynamik von E6AP/E6 und des E6AP/E6/p53-Komplexes mit HS-AFM aufklären und klären, wie E6 die Aktivität der p53-Ubiquitinierung durch E6AP erhöht.
Die HECT-Domäne wiederholt sphärische und elliptische Konformationen durch die flexible Region. Computersimulationsergebnisse zeigen, dass die Kugelform der katalytischen Struktur und die ovale Form der L-förmigen Struktur entspricht. Die Bildungseffizienz des Ubiquitin-Dimers (Ub2) ändert sich erheblich in Abhängigkeit vom Konformationszustand der flexiblen Gelenkregion. Ubiquitinierung – die Zugabe des Proteins Ubiquitin – ist ein Schlüsselschritt in vielen Zellprozessen, wie Proteinabbau, DNA-Reparaturen und Signaltransduktion. Mithilfe von Hochgeschwindigkeits-Rasterkraftmikroskopie (HS-AFM) und molekularer Modellierung haben Forscher unter der Leitung von Hiroki Konno und Holger Flechsig am WPI-NanoLSI der Kanazawa-Universität herausgefunden, wie die Beweglichkeit eines mit der Ubiquitinierung verbundenen Enzymscharniers die Ubiquitinierung ermöglicht. Frühere Studien haben eine Reihe von Enzymen identifiziert, die die Ubiquitinierung erleichtern, darunter ein Enzym, das Ubiquitin aktiviert (E1), ein Enzym, das es konjugiert (E2), und ein Enzym, das die Bindung von Ubiquitin-Protein an das Zielprotein katalysiert (d. h. eine Ligase, E3) ( Abb. 1).
 Abb. 1: Ubiquitinierung und Abbau von Proteinen durch das Ubiquitin-Proteasom-System. (© 2023 Takeda)
Die E3-Ligase vom HECT-Typ ist durch eine HECT-Domäne gekennzeichnet, die einen N-Lappen mit der E2-Bindungsstelle und einen C-Lappen mit einem katalytischen Cys-Rest umfasst. Ein flexibles Gelenk verbindet die beiden Lappen, was zu der Hypothese führt, dass die Ubiquitinierung durch erleichtert wird die Neuordnung des Proteins um dieses Scharnier. Konno und ihre Mitarbeiter setzten ihr Hochgeschwindigkeits-Rasterkraftmikroskop ein, um nach Beweisen dafür zu suchen, dass dies der Fall war.
Die Forscher stellten fest, dass die HECT-Domäne beim Kristallisieren mit einer Art E2-Enzym eine L-Form bildete, sodass der Abstand zwischen dem katalytischen Cys-Rest der HECT-Domäne und dem katalytischen Cys des E2-Enzyms 41 Å betrug – zu weit für die Übertragung von Ubiquitin. Allerdings hat die HECT-Domäne in ihrer katalytischen Konformation eine andere Form, bei der der Abstand zwischen den beiden katalytischen Cys-Resten viel geringer ist – nur 8 Å –, sodass man davon ausgeht, dass es sich hierbei um eine „katalytische Konformation“ handelt.
Die Analyse von HS-AFM-Bildern einer Wildtyp-HECT-Domäne von E6AP ergab zwei Konformationen – eine davon sah kugelförmig und die andere oval aus (Abb. 2). Mithilfe von AFM-Simulationen führten sie die ovalen Formen auf die L-Konformation zurück, und die sphärischen Formen sind entweder die katalytische Konformation oder die sogenannte invertierte T-Konformation, die in einer anderen Art von HECT-Domäne beobachtet wurde, bei der der Abstand zwischen den Cys-Resten 16 Å beträgt ( Abb. 2). Um die räumlich-zeitlichen Auflösungsbeschränkungen der Bildgebung zu überwinden, wurden die Experimente durch molekulare Modellierung ergänzt, um Konformationsbewegungen der HECT-Domäne auf atomarer Ebene zu visualisieren. Mithilfe von Simulations-AFM wurde ein entsprechender Pseudo-AFM-Film erstellt, der den Wechsel von der sphärischen zur ovalen Topographie deutlich zeigte (Abb. 2).
Abb. 1: Ubiquitinierung und Abbau von Proteinen durch das Ubiquitin-Proteasom-System. (© 2023 Takeda)
Die E3-Ligase vom HECT-Typ ist durch eine HECT-Domäne gekennzeichnet, die einen N-Lappen mit der E2-Bindungsstelle und einen C-Lappen mit einem katalytischen Cys-Rest umfasst. Ein flexibles Gelenk verbindet die beiden Lappen, was zu der Hypothese führt, dass die Ubiquitinierung durch erleichtert wird die Neuordnung des Proteins um dieses Scharnier. Konno und ihre Mitarbeiter setzten ihr Hochgeschwindigkeits-Rasterkraftmikroskop ein, um nach Beweisen dafür zu suchen, dass dies der Fall war.
Die Forscher stellten fest, dass die HECT-Domäne beim Kristallisieren mit einer Art E2-Enzym eine L-Form bildete, sodass der Abstand zwischen dem katalytischen Cys-Rest der HECT-Domäne und dem katalytischen Cys des E2-Enzyms 41 Å betrug – zu weit für die Übertragung von Ubiquitin. Allerdings hat die HECT-Domäne in ihrer katalytischen Konformation eine andere Form, bei der der Abstand zwischen den beiden katalytischen Cys-Resten viel geringer ist – nur 8 Å –, sodass man davon ausgeht, dass es sich hierbei um eine „katalytische Konformation“ handelt.
Die Analyse von HS-AFM-Bildern einer Wildtyp-HECT-Domäne von E6AP ergab zwei Konformationen – eine davon sah kugelförmig und die andere oval aus (Abb. 2). Mithilfe von AFM-Simulationen führten sie die ovalen Formen auf die L-Konformation zurück, und die sphärischen Formen sind entweder die katalytische Konformation oder die sogenannte invertierte T-Konformation, die in einer anderen Art von HECT-Domäne beobachtet wurde, bei der der Abstand zwischen den Cys-Resten 16 Å beträgt ( Abb. 2). Um die räumlich-zeitlichen Auflösungsbeschränkungen der Bildgebung zu überwinden, wurden die Experimente durch molekulare Modellierung ergänzt, um Konformationsbewegungen der HECT-Domäne auf atomarer Ebene zu visualisieren. Mithilfe von Simulations-AFM wurde ein entsprechender Pseudo-AFM-Film erstellt, der den Wechsel von der sphärischen zur ovalen Topographie deutlich zeigte (Abb. 2).
 Abb. 2: Hochgeschwindigkeits-AFM-Beobachtung und Simulation der Strukturdynamik der HECT-Domäne von E6AP. (A) HS-AFM-Bild der HECT-Domäne. Es wurden sphärische (weiße gepunktete Linie) und ovale (blaue gepunktete Linie) Konformationszustände beobachtet. (B) Simulierter Übergangsprozess des Strukturzustands der HECT-Domäne und ihres Pseudo-AFM-Bildes. (C) Ubiquitin (Ub) wird von E2 auf E3 (HECT-Domäne) übertragen. Nach der Zugabe von Ubiquitin-haltigem E2 (E2-Ub) bindet E2-Ub (weißer Pfeil) an die HECT-Domäne, und nachdem E2 dissoziiert, wird ein kleines Partikel (blauer Pfeil), das Ubiquitin zu sein scheint, an die HECT-Domäne hinzugefügt . (© 2023 Takeda)
„Allerdings erlauben uns experimentelle Einschränkungen nicht, die Zwischenkonformationen aufzulösen“, erklären die Forscher in ihrem Arbeitsbericht. „Die durchgeführte Modellierung liefert Beweise dafür, dass die unter HS-AFM beobachteten Übergänge zwischen sphärischen und ovalen HECT-Domänenformen funktionellen Konformationsbewegungen entsprechen, bei denen sich der C-Lappen relativ zum N-Lappen dreht und dadurch den Wechsel zwischen katalytischer und L-Form ermöglicht.“ HECT-Konformationen.“
Weitere Experimente mit mutierten HECT-Domänen mit geringerer Flexibilität im Gelenk ergaben keinen Wechsel zwischen Konformationen – die mutierten HECT-Domänen waren in der katalytischen Konformation fixiert. Sie fanden auch heraus, dass diese mutierten HECT-Domänen zwar zwei Ubiquitin-Proteine bilden konnten, die effizienter als der Wildtyp miteinander verbunden waren.
E6AP, in dieser Studie das E3 vom HECT-Typ, interagiert mit dem E6-Protein, das vom humanen Papillomavirus (HPV) stammt, und ubiquitiniert p53, ein Tumorsuppressorprotein. Es ist auch bekannt, dass die Ubiquitinierung von p53 durch E6AP und E6 eine Hauptursache für Gebärmutterhalskrebs ist. Der Mechanismus der p53-Ubiquitinierung durch die Interaktion von E6AP- und E6-Proteinen bleibt jedoch unklar. In Zukunft werden wir die Strukturdynamik von E6AP/E6 und des E6AP/E6/p53-Komplexes mit HS-AFM aufklären und klären, wie E6 die Aktivität der p53-Ubiquitinierung durch E6AP erhöht.
Abb. 2: Hochgeschwindigkeits-AFM-Beobachtung und Simulation der Strukturdynamik der HECT-Domäne von E6AP. (A) HS-AFM-Bild der HECT-Domäne. Es wurden sphärische (weiße gepunktete Linie) und ovale (blaue gepunktete Linie) Konformationszustände beobachtet. (B) Simulierter Übergangsprozess des Strukturzustands der HECT-Domäne und ihres Pseudo-AFM-Bildes. (C) Ubiquitin (Ub) wird von E2 auf E3 (HECT-Domäne) übertragen. Nach der Zugabe von Ubiquitin-haltigem E2 (E2-Ub) bindet E2-Ub (weißer Pfeil) an die HECT-Domäne, und nachdem E2 dissoziiert, wird ein kleines Partikel (blauer Pfeil), das Ubiquitin zu sein scheint, an die HECT-Domäne hinzugefügt . (© 2023 Takeda)
„Allerdings erlauben uns experimentelle Einschränkungen nicht, die Zwischenkonformationen aufzulösen“, erklären die Forscher in ihrem Arbeitsbericht. „Die durchgeführte Modellierung liefert Beweise dafür, dass die unter HS-AFM beobachteten Übergänge zwischen sphärischen und ovalen HECT-Domänenformen funktionellen Konformationsbewegungen entsprechen, bei denen sich der C-Lappen relativ zum N-Lappen dreht und dadurch den Wechsel zwischen katalytischer und L-Form ermöglicht.“ HECT-Konformationen.“
Weitere Experimente mit mutierten HECT-Domänen mit geringerer Flexibilität im Gelenk ergaben keinen Wechsel zwischen Konformationen – die mutierten HECT-Domänen waren in der katalytischen Konformation fixiert. Sie fanden auch heraus, dass diese mutierten HECT-Domänen zwar zwei Ubiquitin-Proteine bilden konnten, die effizienter als der Wildtyp miteinander verbunden waren.
E6AP, in dieser Studie das E3 vom HECT-Typ, interagiert mit dem E6-Protein, das vom humanen Papillomavirus (HPV) stammt, und ubiquitiniert p53, ein Tumorsuppressorprotein. Es ist auch bekannt, dass die Ubiquitinierung von p53 durch E6AP und E6 eine Hauptursache für Gebärmutterhalskrebs ist. Der Mechanismus der p53-Ubiquitinierung durch die Interaktion von E6AP- und E6-Proteinen bleibt jedoch unklar. In Zukunft werden wir die Strukturdynamik von E6AP/E6 und des E6AP/E6/p53-Komplexes mit HS-AFM aufklären und klären, wie E6 die Aktivität der p53-Ubiquitinierung durch E6AP erhöht.
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoData.Network Vertikale generative KI. Motiviere dich selbst. Hier zugreifen.
- PlatoAiStream. Web3-Intelligenz. Wissen verstärkt. Hier zugreifen.
- PlatoESG. Kohlenstoff, CleanTech, Energie, Umwelt, Solar, Abfallwirtschaft. Hier zugreifen.
- PlatoHealth. Informationen zu Biotechnologie und klinischen Studien. Hier zugreifen.
- Quelle: https://www.nanowerk.com/news2/biotech/newsid=64429.php



