تم تصميم الأدوية النانوية القائمة على البوليمر لتوصيل ثلاثة عقاقير مختلفة للأورام بطريقة القياس ، وبالتالي سد الترابط في المختبر في الجسم الحي وإنتاج فعالية علاجية تآزرية في نماذج الفئران المايلوما المتعددة.
يعتمد الجيل الحالي من لقاحات mRNA ضد COVID-19 على مزيج من جسيمتين نانويتين من الدهون (LNP) تحتويان على جزيئين من mRNA ، يتم تناولهما معًا في جرعة واحدة. يقوم أحد الرنا المرسال بتشفير البروتين الشائك الفيروسي الأصلي لـ SARS CoV-2 ، والآخر للبروتين الشائك لمتغير Omicron BA.1 (أو مؤخرًا ، متغير BA.4-5). تقلل هذه اللقاحات ثنائية التكافؤ التي تدار بشكل مشترك من هروب الأجسام المضادة وتوسع الحماية ضد COVID-19 (المرجع. 1). سيكون من الممكن من حيث المبدأ صياغة اثنين من mRNAs في LNP واحد ، بدلاً من المشاركة في إدارة اثنين من LNP محملين بمفرده مع mRNA واحد ، ولكن هذا على الأرجح لا يضيف قيمة كبيرة في إعدادات التطعيم. عندما يتعلق الأمر بإنتاج البروتينات في وقت واحد على مستوى الخلية المفردة ، فقد ثبت أن `` معًا أفضل '' ، خاصةً عندما تهدف إلى التحكم في التعبير عن البروتين بطريقة القياس.2. علاوة على ذلك ، تعد المشاركة في صياغة اثنين من الحمض النووي الريبي في LNP واحدًا أمرًا بالغ الأهمية لتحرير الجينات الفعال المستند إلى تقنية CRISPR. كما يتضح من علاج الداء النشواني ترانستريتين (TTR) في الفئران والمرضى ، يجب صياغة دليل واحد من الحمض النووي الريبي ضد ترميز TTR و mRNA لـ Cas9 في LNP واحد ، من أجل ضمان التوافر المشترك الزماني والمكاني لكلا المكونين من آلات تحرير الجينات3,4.
إن التغليف المشترك للعديد من الأدوية في تركيبة طب نانوي واحد ليس جديدًا ، كما أنه لا يشارك في إدارة العديد من العقاقير النانوية في جرعة واحدة. مثال رئيسي على الأول هو Vyxeos (CPX-351) ، وهو جسيم شحمي متعدد الصفائح يحتوي على سيتارابين وداونوروبيسين بنسبة "راتيومترية" ثابتة تبلغ 5: 1. بالمقارنة مع السيتارابين التقليدي 7 + 3 بالإضافة إلى تركيبة الداونوروبيسين المجانية ، ينتج الدواء المزدوج الشحمي بقاءًا عامًا أطول بشكل ملحوظ في المرضى الذين يعانون من ابيضاض الدم النخاعي الحاد الثانوي.5. مثال نموذجي لهذا الأخير - إلى جانب لقاحات COVID-19 ثنائية التكافؤ - هو Copaxone (glatiramer acetate). كوباكسون وبديله العام Glatopa عبارة عن خليط إحصائي من 5-9 كيلو دالتون بولي ببتيدات ، على أساس الأحماض الأمينية ، حمض الجلوتاميك ، ليسين ، ألانين ، وتيروزين ، بلمرة مشتركة في نطاقات كسور مولارية ثابتة. هذا المثال الكلاسيكي لعقار معقد غير بيولوجي (NBCD (المرجع. 6)) يحاكي أجزاء من بروتين المايلين الأساسي ويثبط تلف الأعصاب الناتج عن الخلايا المناعية من خلال تعزيز التسامح الذاتي. بسبب التعقيد التركيبي ، من المستحيل توصيف البولي ببتيدات الفردية في كوباكسون وجلاتوبا. ومع ذلك ، فإن هذا لم يمنع هذه التركيبات النانوية متعددة الأدوية من أن تصبح أدوية مفيدة لإدارة التصلب المتعدد7.
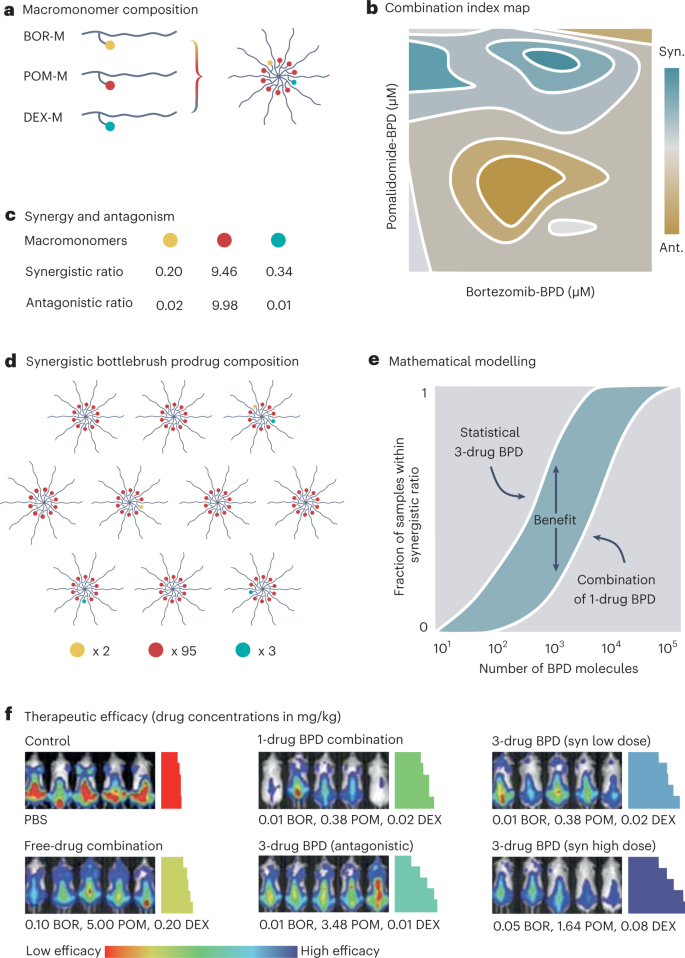
في هذا العدد من طبيعة التكنولوجيا النانويةو ديتابي ونغوين وزملاؤهم ينتقلون بالطب النانوي متعدد الأدوية إلى المستوى التالي8. باستخدام البلمرة التحويلية ثنائية الفتح الحلقة ، قاموا بتصنيع عقاقير أولية من البوليمر لفرشاة الزجاجة (BPD) للأدوية المضادة للورم النخاعي المتعدد (MM) بورتيزوميب ، بوماليدوميد وديكساميثازون (الشكل. 1a). من وجهة نظر سريرية ، هذا المزيج له أهمية إستراتيجية ، لأن بوماليدوميد أقوى من الليناليدوميد ويساعد على التغلب على مقاومة العلاج الثلاثي للخط الأمامي باستخدام بورتيزوميب ، ليناليدوميد ، وديكساميثازون. من وجهة نظر التصنيع ، يمكن بسهولة صياغة الـ BPD الثلاثة بشكل مشترك بكميات قياس نسبية ، مما ينتج عنه خلائط إحصائية من الجسيمات النانوية الفردية والمزدوجة والثلاثية التي تحتوي على دواء والتي عند تطبيقها معًا تكون قادرة على إنتاج فعالية تآزرية ضد MM في المختبر وفي فيفو.
a، رسم تخطيطي لعقار واحد (M) ، يحتوي على بورتيزوميب (بور) ، بوماليدوميد (بوم) أو ديكساميثازون (ديكس). يمكن بلمرة الكواكب الكبيرة إلى جزيئات متعددة العقاقير بحجم 10 نانومتر مع مزيج إحصائي من الأدوية الثلاثة. b، تقييم تآزر 3 أدوية عن طريق تحليل مؤشر الجمع لتركيزات مختلفة من بورتيزوميب-بي بي دي وبوماليدوميد-بي بي دي بتركيز ديكساميثازون-بي بي دي ثابت. c، تحديد نسب الأدوية التآزرية والمضادة. d، رسم تخطيطي للمزيج الإحصائي التآزري للصياغة المشتركة لـ 3 أدوية BPD. e، نمذجة مونت كارلو التي توضح تفوق التركيبة التآزرية المكونة من 3 أدوية BPD على مزيج من 1 دواء BPD تدار بنفس النسبة. f، تصوير النشاط المضاد للأورام المحسّن (صور التلألؤ الحيوي) والبقاء (مؤامرات كابلان ماير المرمزة بالألوان) للصيغ المشتركة المكونة من 3 عقاقير BPD التآزرية مقارنة بالتركيبات المضادة لـ 3 أدوية BPD ، والإدارة المشتركة لـ BPD ، والإدارة المشتركة للأدوية المجانية. اللوحات b, eو f مقتبس من المرجع. 8.
كشف التقييم في المختبر للأدوية المجانية وتركيبات BPD المدمجة نسبيًا عن نسب عقاقير أولية مع نشاط تآزري ومضاد (الشكل XNUMX ب). 1b-ج). في حالة السرطان ، على عكس إعدادات التطعيم ، فإن التوصيل المشترك للأدوية في نفس الخلية أمر بالغ الأهمية لإنتاج التآزر. بالنظر إلى أن BPD واحد بحجم 10 نانومتر يحتوي على 10 جزيئات دوائية ، وأن نسبة التآزر التي تحفز موت خلايا MM بكفاءة هي 0.2 و 9.46 و 0.34 لبورتيزوميب ، بوماليدوميد ، وديكساميثازون ، على التوالي ، يمكن أن تكون نسبة الدواء المرغوبة فقط يتحقق عند إعطاء مزيج إحصائي من 1 و 2 و 3 أدوية BPD. البقاء على اتصال معنا. 1d، لمزيج من 10 مجموعات نانوية من BPD ، والتي تشارك معًا في توصيل 100 جزيء دوائي إلى خلية أو حجرة ورمية وقادرة على القيام بذلك بنسبة ضمن نافذة التآزر.
السؤال الرئيسي هو كيف يقارن المزيج الإحصائي لـ BPD ثلاثي الأدوية مع BPD المصنوع فرديًا والذي يتم إدارته بشكل مشترك عند النسبة التآزرية المرغوبة. تناول المؤلفون هذا السؤال رياضيًا وتجريبيًا. باستخدام محاكاة مونت كارلو ، أظهروا أن الصيغة المشتركة لـ BPD المكونة من 3 أدوية تتفوق على مجموعات من عقار BPD واحد بترتيب واحد من حيث الحجم من حيث احتمالية تحقيق نسبة تآزرية (الشكل. 1e). تخيل أن عددًا مثاليًا من 100 تجميعات نانوية BPD تصل إلى الخلية أو المقصورة المستهدفة ، فإن فرص 1,000 دواء تم تسليمها لتكون ضمن نافذة التآزر تزداد من 20٪ تقريبًا لمزيج من BPD واحد ، إلى ~ 1٪ لتركيبة 80 أدوية BPD. علاوة على ذلك ، توضح النمذجة أن القيمة المضافة يتم إنشاؤها فقط عن طريق الصياغة المشتركة للأدوية المتعددة إذا كان العدد الإجمالي للأدوية لكل خلية أو جزء أقل من 3. تظهر عملية حسابية بسيطة أن هذا الرقم يقع في نطاق مناسب لحالة ما قبل السريرية. بافتراض أن (10,000) 1 × 1012 –1 × 1013 تُحقن الجسيمات النانوية عادةً في الفئران عندما تهدف إلى تحقيق دوران طويل وتراكم جيد للورم9، (1) أن 1٪ من الجرعة المحقونة تصل إلى ورم ، وأن (XNUMX) XNUMX سم3 يحتوي الورم على 109 خلايا بحجم 1,000 ميكرومتر3 لكل منها عدد الجسيمات النانوية لكل خلية ورمية في حدود 10-100 ، وعدد جزيئات الدواء ذات الصلة هو 100-1,000. في المرضى ، 1 × 1015 - 1 × 1016 تدار الجسيمات النانوية9، 1٪ ورم متراكم متشابه ، والأورام عادة 1-100 سم3، وبالتالي تحتوي على 109-1011 الخلايا. ينتج عن هذا عدد من الجسيمات النانوية لكل خلية بين 100 و 100,000 ، وهو ما يعادل 1,000 و 1,000,000 جزيء دوائي. علاوة على ذلك ، مع الأخذ في الاعتبار أن توزيع الأدوية في الأورام بعيد كل البعد عن التجانس ، وأن جزءًا كبيرًا من الخلايا السرطانية سيشهد عددًا قليلاً نسبيًا من الجسيمات النانوية وجزيئات الدواء تتراكم ، يصبح من الواضح بشكل متزايد أنه قد يكون هناك بالفعل قيمة كبيرة في استغلال قدرة الطب النانوي على المشاركة في تقديم العديد من الأدوية لخلق التآزر.
تم إجراء التقييم في الجسم الحي في نموذجين متعددين لطعم أجنبي للمايلوما ، بمقارنة ست مجموعات علاج مختلفة: مجموعة التحكم ، مجموعة الأدوية المجانية ، مزيج BPD 1 ، خليط إحصائي مضاد من 3 أدوية BPD ، خليط تآزري منخفض الجرعة من 3 أدوية BPD ، ومزيج تآزري عالي الجرعة من 3 أدوية BPD. تفوقت كلتا الصيغتين التآزريتين لـ BPD على جميع مجموعات العلاج الأخرى ، من حيث تثبيط نمو الورم والبقاء على قيد الحياة (الشكل. 1f). من اللافت للنظر ، مقارنة بالعقاقير الثلاثة المجانية مجتمعة ، أن تركيبة BPD التآزرية منخفضة الجرعة المكونة من 3 أدوية كانت أكثر فاعلية على الرغم من أن تركيزات الأدوية المستخدمة كانت أقل بمقدار رتبة واحدة. وتجدر الإشارة ، مع ذلك ، إلى أن طريقة الإدارة كانت مختلفة لكلا المجموعتين. ومع ذلك ، توضح المقارنة إمكانات هذا النهج: استخدام جرعات دوائية أصغر بشكل ملحوظ ، مدمجة بشكل متكافئ ومشتركة بشكل صحيح في جسيم نانوي مع استدار ورم لائق ، لتحسين النتائج العلاجية بشكل ملحوظ.
يُعد عمل ديتاب ونغوين وزملائه خطوة كبيرة إلى الأمام في مجالات الطب النانوي للسرطان و NBCD. إنه يوضح أن تصنيع دواء نانوي ثلاثي الأدوية مع نسبة مركب نشطة محددة إحصائيًا أمر ممكن ويتيح نقل الفعالية التآزرية في المختبر إلى الفعالية التآزرية في الجسم الحي. يُنتظر بفارغ الصبر إجراء تجارب متابعة تؤكد إمكانات النهج وتحديد موضع تسليم الأدوية المتعددة في مشهد الطب النانوي للسرطان قبل السريري. من بين أشياء أخرى ، يمكن أن تشمل التحقيقات المستقبلية: (XNUMX) تقييم طرق بديلة للإدارة ، بما في ذلك الحقن تحت الجلد من أجل BPD متعدد الأدوية. (XNUMX) استكشاف معدلات إطلاق العقاقير البديلة ، التي يمكن ضبطها بشكل فردي لكل عامل نشط ؛ (XNUMX) دمج عوامل نشطة أخرى ومجموعات عوامل نشطة ، والتي يمكن تصور العديد من الخيارات الجذابة لها ؛ (XNUMX) تحليل أنظمة التوصيل الأخرى التي تسمح بإيصال الأدوية المتعددة بقياس النسب ؛ وأخيرًا وليس آخرًا ، (XNUMX) تقييم الجوانب التنظيمية ومصالح الصناعة وقبول المستخدم النهائي ، والتي يجب إجراؤها بشكل متوازٍ بشكل مثالي10. إجمالاً ، تمهد النتائج المبلغ عنها والتقدم المفاهيمي الذي تم إحرازه لتوسيع نطاق الطب النانوي متعدد الأدوية من المايلوما المتعددة إلى أمراض أخرى متعددة.
- محتوى مدعوم من تحسين محركات البحث وتوزيع العلاقات العامة. تضخيم اليوم.
- بلاتوبلوكشين. Web3 Metaverse Intelligence. تضخيم المعرفة. الوصول هنا.
- المصدر https://www.nature.com/articles/s41565-022-01265-3