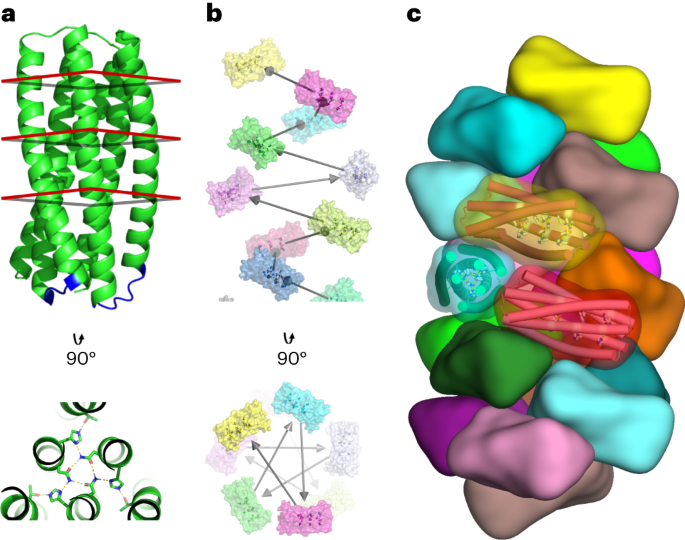
استراتيجية التصميم الحسابي
تم تصميم حلقات قصيرة لربط حلزونات pRO-2.3 في سلسلة واحدة باستخدام قاعدة بيانات شاملة لعينات العمود الفقري المكونة من أجزاء تمتد لمنطقتين حلزونيتين كما حددها DSSP في الهياكل البلورية عالية الدقة (كما هو موضح سابقًا)14). تم تحديد الحلقات في قاعدة البيانات هذه من خلال المحاذاة الصارمة للمخلفات الطرفية للجزء والهدف باستخدام خوارزمية التراكب المُحسّنة15. تمت محاذاة المرشحين الذين حققوا تسامحًا للمحاذاة قدره 0.35 Å RMSD مع العمود الفقري المستهدف عبر إحداثيات الالتواء والفضاء وقيود الإحداثيات الناعمة لإحداثيات الذرة الثقيلة العمود الفقري للمرشح المتوافق. تم بعد ذلك تصميم تسلسلات حلقة المرشح وفقًا لقيود ملف تعريف التسلسل التي تم إنشاؤها عبر محاذاة العمود الفقري للحلقة مع قاعدة بيانات البنية المصدر. تم اختيار المرشحين الحاصلين على أقل الدرجات لتصميم الحلقة النهائية.
الالتحام الحلزوني وطرق التصميم7 تم تطبيقها على pRO-2.3 المرتبط لإنشاء نماذج تصميم خيوط حلزونية. قامت المعايير التالية بتصفية مسارات التصميم الفردية: تناقض يتجاوز .15.0 وحدات طاقة رشيد بين الحالات المرتبطة (البوليمرية) وغير المرتبطة (المونومرية)، ومساحة سطح الواجهة تتجاوز 700 Å2، تكامل شكل رشيد يتجاوز 0.62 وعدد المخلفات القطبية غير المرضية أقل من 5. خضعت التصميمات التي تستوفي هذه المعايير لتحسين يدوي، بما في ذلك عمليات عكس نقطة واحدة للطفرات التي تعتبر غير مساهمة في تثبيت الحالة المقيدة للواجهة. تم بعد ذلك دمج التصميم الحاصل على أعلى الدرجات لكل تكوين مُرسى في مجموعة البروتين النهائية للتحقق من صحتها تجريبيًا.
تعبير البروتين وتنقيته
تم تحسين الجينات الاصطناعية لما مجموعه 18 تصميمًا للتعبير عنها كولاي وتم الحصول عليها من IDT، ثم تم إدراجها في موقع الاستنساخ المتعدد لناقل pET29b+ بين مواقع تقييد NdeI وXhoI. تم إدخال هذه التركيبات في BL21* (DE3) E. كولاي الخلايا المختصة. تمت زراعة المواد المحولة في وسط مرق رائع سعة 50 مل مضاف إليه 200 مجم لتر-1 كاناميسين. استمر التعبير، تحت سيطرة مروج T7، لمدة 24 ساعة عند 37 درجة مئوية باستخدام الحث الذاتي Studier16 حتى تم حصاد الثقافات بواسطة الطرد المركزي. تمت إعادة تعليق كريات الخلايا في محلول ملحي Tris (TBS) وتم غسلها باستخدام منظف Bugbuster. الجزء القابل للذوبان، الذي تم توضيحه بواسطة الطرد المركزي، خضع للتنقية عبر Ni2+ تحليل كروماتوجرافي متقارب للمعادن باستخدام راتنج Ni-NTA Superflow. تم غسل الراتينج ذو المحللة الخلوية المرتبطة بعشرة أحجام أعمدة من 40 ملي مولار إيميدازول و 500 ملي مول كلوريد الصوديوم ، يليه شطف بـ 400 ملي مولار إيميدازول و 75 ملي مول كلوريد الصوديوم. تم إخضاع الأجزاء القابلة للذوبان وغير القابلة للذوبان للتحليل الكهربائي للهلام بولي أكريلاميد SDS. تم اختيار العينات التي تظهر أشرطة البروتين بالوزن الجزيئي الصحيح لفحصها بالمجهر الإلكتروني. تمت زيادة حجم التصميمات المختارة إلى 0.5 لتر لمزيد من التوصيف، مع استمرار التعبير مرة أخرى لمدة 24 ساعة عند 37 درجة مئوية باستخدام الحث الذاتي Studier16 قبل الحصاد بواسطة الطرد المركزي. تمت إعادة تعليق كريات الخلايا في TBS وتم إفسادها بواسطة الموائع الدقيقة، تليها التنقية كما هو موضح أعلاه.
وصمة عار سلبية EM
تم تركيز الأجزاء القابلة للذوبان في TBS (25 ملي مولار تريس ، 75 ملي مول كلوريد الصوديوم ، الرقم الهيدروجيني 8) لفحص المجهر الإلكتروني. تم تطبيق قطرة 6 ميكرولتر (عينة 1 ميكرولتر مخففة على الفور مع 5 ميكرولتر من المخزن المؤقت) على شبكات نحاسية ذات 200 شبكة متوهجة ومغلفة بالكربون، وغسلها بماء Milli-Q وملطخة باستخدام فورمات اليورانيل بنسبة 0.75٪ (درجة الحموضة 4.0). ) أو Nano-W (الرقم الهيدروجيني 6.8) الذي تم شراؤه من Nanoprobes, Inc. كما هو موضح سابقًا17. تم إجراء الفحص باستخدام المجهر الإلكتروني للإرسال Morgagni M100 بقوة 268 كيلو فولت (FEI) أو المجهر الإلكتروني للإرسال Talos L120C بقوة 120 كيلو فولت (ThermoFisher). تم التقاط الصور باستخدام نظام كاميرا Teitz CMOS 4k المثبت في الأسفل وتمت معالجتها لتحسين التباين باستخدام برنامج Fiji (الإصدار: 2.14.0/1.54f)18 للتوضيح.
تم قياس كمية أطوال الألياف باستخدام خوارزمية تتبع الألياف في cryoSPARC8. تحدد هذه الطريقة الألياف عن طريق الارتباط المتبادل بفئة القالب وتتبع الألياف المتجاورة من الجسيمات المحددة. تم استخدام فئة القالب التي تم إنشاؤها من DpHF19 لجميع الألياف المقاسة. تم ترشيح الألياف وفقًا لمتوسط الانحناء (<0.0005 Å-1) ومتوسط الارتباط المتبادل الطبيعي (> 0.5) عبر كل ليف. بالنسبة إلى DpHF18، استخدمنا 5 و2 و3 و20 و28 و21 صورة للأس الهيدروجيني 3 و3.5 و4.2 و5 و8 و3 إلى 8 على التوالي. بالنسبة إلى DpHF19، استخدمنا 7 و8 و8 و28 و4 و5 صور للأس الهيدروجيني 3 و3.5 و4.2 و5 و8 و3 إلى 8 على التوالي. بالنسبة إلى DpHF19_9his، استخدمنا 6 و6 و8 و14 و15 و8 و4 صور للأس الهيدروجيني 3 و3.5 و4.2 و5 و6 و8 ومن 3 إلى 8 على التوالي.
البرد-EM
تم تحضير عينات Cryo-EM من خلال تطبيق البروتين على شبكات الكربون المثقوب CFLAT، وإزالة السائل وإغراق الشبكات في الإيثان السائل باستخدام Vitrobot (ThermoFisher). بالنسبة إلى DpHF19، تم الحصول على مقاطع فيديو باستخدام مجهر Glacios (ThermoFisher) المجهز بكاميرا K-2 Summit Direct Detect (شركة Gatan Inc.) التي تعمل في وضع العد، بحجم بكسل يبلغ 1.16 Å لكل بكسل، و50 إطارًا وجرعة إلكترون إجمالية من 65 أنجستروم-2. بالنسبة إلى DpHF18 وDpHF7، تم الحصول على مقاطع الفيديو على Titan Krios (ThermoFisher) المجهز بكاميرا K-2 Summit Direct Detect (شركة Gatan Inc.) التي تعمل في وضع الدقة الفائقة، بحجم بكسل يبلغ 0.525 Å لكل بكسل، و50 إطارًا و جرعة إلكترون إجمالية قدرها 90 Å-2. تم إجراء جمع البيانات الآلي باستخدام Leginon19 الإصدار 3.4. تم إجراء معالجة البيانات باستخدام cryoSPARC8، ويتم تلخيص سير العمل في التين التكميلية. 10-12. تمت محاذاة مقاطع الفيديو عن طريق تصحيح حركة التصحيح، مع تجميع مقاطع الفيديو فائقة الدقة بحجم بكسل يبلغ 1.05 Å. تم تقدير معلمات دالة نقل التباين (CTF) باستخدام تصحيح CTF. تم إجراء تتبع الشعيرة بدون قالب على مجموعة فرعية من الصور، وتم إخضاع الجزيئات الناتجة لتصنيف ثنائي الأبعاد. تم بعد ذلك استخدام فئات ثنائية الأبعاد محددة كقوالب لتتبع الخيوط المستندة إلى القالب على مجموعات البيانات الكاملة. بعد جولات متعددة من التصنيف ثنائي الأبعاد، تم إخضاع الجسيمات المحددة لتحسين ثلاثي الأبعاد مع فرض التماثل الحلزوني وتمكين التحسين غير الموحد. بالنسبة إلى DpHF2، فرضنا تناظرًا حلزونيًا ذو بداية واحدة يتعلق بوحدات فرعية فردية غير ملامسة، بدلاً من معلمات التناظر الحلزوني ذات البداية المزدوجة. بالنسبة إلى DpHF2 وDpHF2، تم أيضًا تحسين إلغاء الضبط البؤري لكل جسيم وإمالة الشعاع والانحراف الكروي. تم إجراء تعديل الكثافة باستخدام ResolveCryoEM في Phenix20,21 الإصدار فينيكس-1.20.1. تم تنقيح النماذج الذرية لـ DpHF18 وDpHF19 في خرائط cryo-EM باستخدام ISOLDE22، متبوعًا بتحسين المساحة الحقيقية في Phenix، مع تعطيل قيود rotamer وRamachandran ومع القيود المرجعية التي يفرضها نموذج بدء الإدخال. استخدم توضيح نموذج DpHF7 بروتوكول بناء نموذج de novo على كثافة الوحدة غير المتماثلة cryo-EM المجزأة23. تم تحقيق دمج البقايا اللاحقة وتحسينها باستخدام RosettaCM24 الإصدار 2019.31، مع الاستفادة من التماثل عبر خريطة cryo-EM غير المقسمة للحصول على واجهات ملائمة للكثافة والخيوط الداخلية. تم إجراء جولة أخيرة من تحسين الفضاء الحقيقي في Phenix، كما هو موضح أعلاه لـ DpHF18 وDpHF19. تم تلخيص جمع بيانات Cryo-EM وإحصائيات التنقيح والتحقق من الصحة في الجدول التكميلي 1.
تيرفم
تجميع الألياف
لتصوير نواة البذور المستجيبة للأس الهيدروجيني، تمت تسمية ألياف DpHF18 باثنين من الفلوروفورات المختلفة المترافقة مع الماليميد، Oregon488 وsulfo-Cy5. تمت تسمية الألياف بفائض مولي 10 ×، في PBS + 1 مم TCEP لمدة 4 ساعات عند درجة حرارة الغرفة، قبل تبادل المخزن المؤقت إلى TBS (25 ملي مولار تريس، 100 ملي كلوريد الصوديوم، الرقم الهيدروجيني 8.0) على عمود دوران زيبا والتركيز على 30 ميكرومتر. . تم تفكيك الألياف الخضراء عند 30 ميكرومتر من خلال إضافة 1 م سيترات (0.6 ميكرولتر من السيترات إلى 20 ميكرولتر من الألياف) لتقليل الرقم الهيدروجيني إلى 3.0. تم تحضين المحلول لمدة 5 دقائق قبل إضافة Tris (3.6 ميكرولتر من مخزون 1 M) لإعادة الرقم الهيدروجيني إلى 8.0 ؛ تمت إضافة 1 ميكرولتر من ألياف DpHF18 – Cy5 المجمعة عند 30 ميكرومتر إلى المحلول. تم تحضين المحلول بعد ذلك في درجة حرارة الغرفة قبل الطرد المركزي عند 13,000 g لمدة 2 دقيقة في جهاز للطرد المركزي الفوق. تم تعليق الألياف في TBS وتصويرها بواسطة TIRFM.
تفكيك الألياف
تم إجراء تصوير سريع TIRFM للألياف التي يتم تفكيكها عند درجة حموضة منخفضة على نظام TIRF مصمم خصيصًا استنادًا إلى حامل Nikon Ti المجهز بنظام تركيز مثالي إلى جانب عدسة سريعة. Z مرحلة بيزو (ASI)، وإضاءة TIRF السمتية (iLas2، Roper France) مع مجال رؤية ممتد مخصص (Cairn) وهدف PLAN Apo 1.45 NA ×100. تم الحصول على الصور باستخدام كاميرا sCMOS ذات الإضاءة الخلفية Photometrics Prime 95B والتي يتم تشغيلها في وضع الغالق العالمي الزائف، والذي يتزامن مع الإضاءة السمتية. تم تشغيل النظام بواسطة Metamorph 7.10.1.161. تم تصوير الألياف التي تحمل علامة ماليميدي Sulfo-Cy5 باستخدام ليزر 630 نانومتر (150 ميجاوات متماسك OBIS مثبت في إطلاق ليزر Cairn) وتم تصويرها باستخدام مرشح Chroma ET655lp المثبت في عجلة Cairn Optospin بمعدل إطار واحد كل 1 مللي ثانية.
تم تصوير الألياف في المخزن المؤقت للتصوير (25 ملي مولار تريس pH 8.0، 100 ملي كلوريد الصوديوم) في خلية تدفق إبيدي مثبتة على أغطية ساترة من فئة الغرفة النظيفة (مخصص، 25 × 75 مم)2، Nexterion) ، وتم تخميله باستخدام PLL-PEG (0.1 مجم مل-1 في 20 ملي هيبس، ودرجة الحموضة 7.6؛ 5 دقائق). تم السماح للألياف بالترسب على ساترة لمدة 5 دقائق قبل إزالة الألياف غير المرتبطة باستخدام المخزن المؤقت للتصوير. أثناء الاكتساب السريع، تم تقليل الرقم الهيدروجيني عن طريق التدفق في المخزن المؤقت منخفض الرقم الهيدروجيني (25 مللي مولار تريس، 100 مللي مول كلوريد الصوديوم، الرقم الهيدروجيني 3.0).
لقياس تفكيك الألياف في المحلول السائب، تم استبدال الألياف المشكلة مسبقًا في أنابيب إيبندورف سعة 1.5 مل إلى محاليل سيترات عند درجة حموضة أقل لتحفيز التفكيك. تمت إزالة جزء من كل تفاعل للأس الهيدروجيني في نقاط زمنية مختلفة وإضافته إلى لوحة بئر 96 ولمدة 10 دقائق للسماح للألياف بالاستقرار والالتصاق بالركيزة الزجاجية. لكل حالة ونقطة زمنية، تم الحصول على تسعة مجالات رؤية على مجهر IN Cell Analyzer 2500HS (الأجهزة الجزيئية) باستخدام هدف هوائي من نيكون ×60 PLAN Apo 0.95 NA ومصدر إثارة LED بطول 631 نانومتر، ووقت تعريض قدره 150 مللي ثانية مع جمع الانبعاثات من خلال مرشح تمرير النطاق 684 ± 24 نانومتر. تم قياس كمية الصور باستخدام برنامج نصي CellProfiler مخصص لتقسيم الألياف باستخدام خوارزمية عتبة Otsu25. تم تعديل الحدود العلوية والسفلية للعتبة، وكذلك النافذة التكيفية لمعرف الكائن، حتى تم تحديد الألياف بشكل صحيح بالنسبة لإشارة الخلفية. تم رسم طول المحور الرئيسي للكائنات التي تم تحديدها باستخدام خط أنابيب CellProfiler مقابل وقت الحضانة لكل حالة من حالات الرقم الهيدروجيني.
المرحلة السائلة AFM
إعداد عينة
قمنا باحتضان 10 ميكرولتر من محلول بولي ليسين بنسبة 0.01٪ بالوزن على سطح ميكا من المسكوفيت المشقوق حديثًا (12 مم، Ted Pella Inc.) لمدة دقيقتين. تمت إزالة المحلول الزائد وشطف السطح بالماء وتجفيفه باستخدام N2 الغاز7. ثم تم تحضين 30 ميكرولتر من محلول البروتين 10 ميكرومتر في المخزن المؤقت للتصوير (25 ملي مولار تريس-حمض الهيدروكلوريك، 400 ملي مول كلوريد الصوديوم عند الرقم الهيدروجيني 8) على الميكا المطلية بالبولي ليسين لمدة 30 دقيقة وغسلها باستخدام المخزن المؤقت للصورة لإزالة البروتين الزائد. تم ضبط الرقم الهيدروجيني لمخزن التفكيك (25 ملي مولار تريس-حمض الهيدروكلوريك، 400 ملي مول كلوريد الصوديوم، الرقم الهيدروجيني 4.1، 4.4، 4، 5 أو 4.7) باستخدام 10 مولار NaOH أو 1 مولار من حمض الستريك وتم ترشيحه باستخدام مرشح PVDF بحجم مسام 0.1 ميكرومتر قبل الاستخدام. . بالنسبة لتجارب الحموضة الضوئية، تم تحضين محلول البروتين 10 ميكرومتر في 25 ملي مولار Tris-HCl pH 8 على الميكا العارية لمدة 30 دقيقة وغسله باستخدام 25 ملي مولار Tris-HCl pH 5.5؛ تم تنفيذ خطوة ترسيب وشطف إضافية إذا كانت كثافة عدد الألياف على السطح منخفضة. قمنا أيضًا بإعداد 1 ملي مولار 2-نيتروبنزالدهيد (سيجما ألدريتش) في 25 ملي مولار من حمض الهيدروكلوريك تريس-حمض الهيدروكلوريك 5.5 واستخدمناه على الفور دون التعرض للضوء في أي مرحلة26. أشارت القياسات الطيفية وقياسات الأس الهيدروجيني إلى أن 2-نيتروبنزالدهيد قابل للتنشيط بين الأطوال الموجية 200 و405 نانومتر ويخفض الأس الهيدروجيني من 5.5 إلى 2.7، وأن كثافة الليزر الأعلى تؤدي إلى استهلاك وتحمض أسرع.
التصوير
بالنسبة للدراسة الحركية بتركيبة ثابتة، تم وضع ركائز الميكا بولي ليسين المغلفة بالبروتين تحت الخلية السائلة AFM (Bruker Multimode8). تم التقاط الصور في المخزن المؤقت للتصوير باستخدام ناتئ نيتريد السيليكون النظيف (Bruker، SNL-10، ثابت الربيع: 0.12 N · m-1، الأشعة فوق البنفسجية بالأوزون لمدة 5 دقائق) في وضع التنصت في درجة حرارة الغرفة (25 درجة مئوية). قبل تدفق المخزن المؤقت للتفكيك، تم تصوير الألياف بشكل مستمر لمدة 10 دقائق لتحسين المعلمات (256 خط مسح، ومعدل مسح 1.5 هرتز، وكسب متكامل عالي (3-4) وسعة حرة 50-100 مللي فولت). بعد التأكد من عدم حدوث أي ضرر ناجم عن الكابولي، تم حقن المخزن المؤقت للتفكيك بشكل مستمر عند 25 ميكرولتر دقيقة-1. تم تحسين إعداد التدفق من خلال توفير وقت إقامة ضئيل وتبديل سريع لدرجة الحموضة10.
بالنسبة لدراسة الحمض الضوئي، تم وضع الميكا المغلفة بالبروتين مع 25 ملي مولار من حمض Tris-HCl pH 5.5 تحت الخلية السائلة لـ Cypher VRS AFM (أبحاث اللجوء) المجهزة بليزر BlueDrive (مرشح كثافة × 0.3، طول موجة 405 نانومتر) مع صمام التنفيس فتح وتشغيل في وضع التنصت. بعد التأكد من التغطية السطحية العالية للألياف، تم استبدال المخزن المؤقت للتصوير بـ 1 مم 2-نيتروبنزالدهيد في 25 مم Tris-HCl pH 5.5، وتم تشغيله دون التعرض لضوء الخلفية المرئي وتم تصويره مرة أخرى. تم بعد ذلك سحب الكابولي، وتم تشغيل BlueDrive وتنقيطه عبر مناطق محددة مسبقًا بشكل متكرر باستخدام المجهر الضوئي المزود بمحرك لـ AFM. لم يكن إجمالي وقت التعرض للأشعة فوق البنفسجية أثناء النقطية/المسكن لأنماط البقع والخطوط أكثر من 10 دقائق، وبعد ذلك تم نقل الكابولي مرة أخرى إلى المناطق المكشوفة وتصويره. بالنسبة للتغيرات العالمية في درجة الحموضة، تم تعريض نافذة الكوارتز للخلية السائلة AFM المتلامسة مع محلول الحمض الضوئي لمصباح الأشعة فوق البنفسجية المحمول (الطول الموجي 364 نانومتر) لمدة 7 دقائق، ثم تم تصويرها.
تمت معالجة الصور باستخدام برنامج تحليل البيانات Gwyddion SPM v2.62 وتم تحليلها باستخدام برنامج Fiji v1.53s18. بالنسبة للحركية، تم قياس إجمالي طول الألياف، وتم استبعاد أي أجزاء تعتبر مفككة بالفعل من قياس الطول. لقياس معدل التفكيك عند كل طرف من الألياف الفردية (الشكل التكميلي 1). 8) ، تم تعيين مركز الألياف (نصف الطول الأولي) باعتباره الطرف الثاني لقياس الطول، بينما بالنسبة لشظايا الألياف، تم قياس مركز الجزء باعتباره الطرف الثاني.
- محتوى مدعوم من تحسين محركات البحث وتوزيع العلاقات العامة. تضخيم اليوم.
- PlatoData.Network Vertical Generative Ai. تمكين نفسك. الوصول هنا.
- أفلاطونايستريم. ذكاء Web3. تضخيم المعرفة. الوصول هنا.
- أفلاطون كربون، كلينتك ، الطاقة، بيئة، شمسي، إدارة المخلفات. الوصول هنا.
- أفلاطون هيلث. التكنولوجيا الحيوية وذكاء التجارب السريرية. الوصول هنا.
- المصدر https://www.nature.com/articles/s41565-024-01641-1



