يؤدي استنزاف الصفائح الدموية الحاد إلى تجنيد الخلايا الجذعية السرطانية الهادئة بسرعة في الانتشار
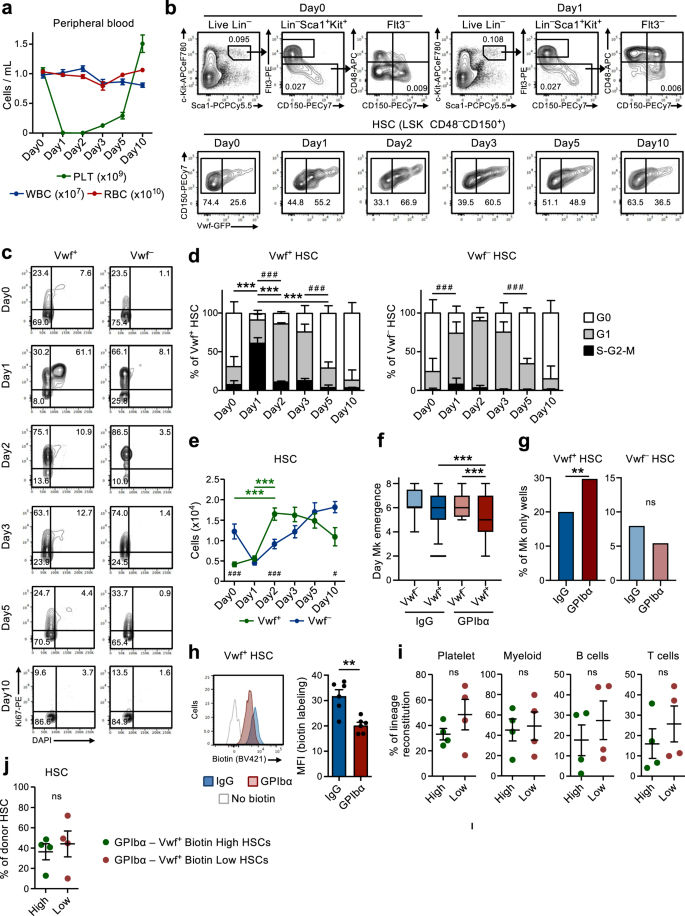
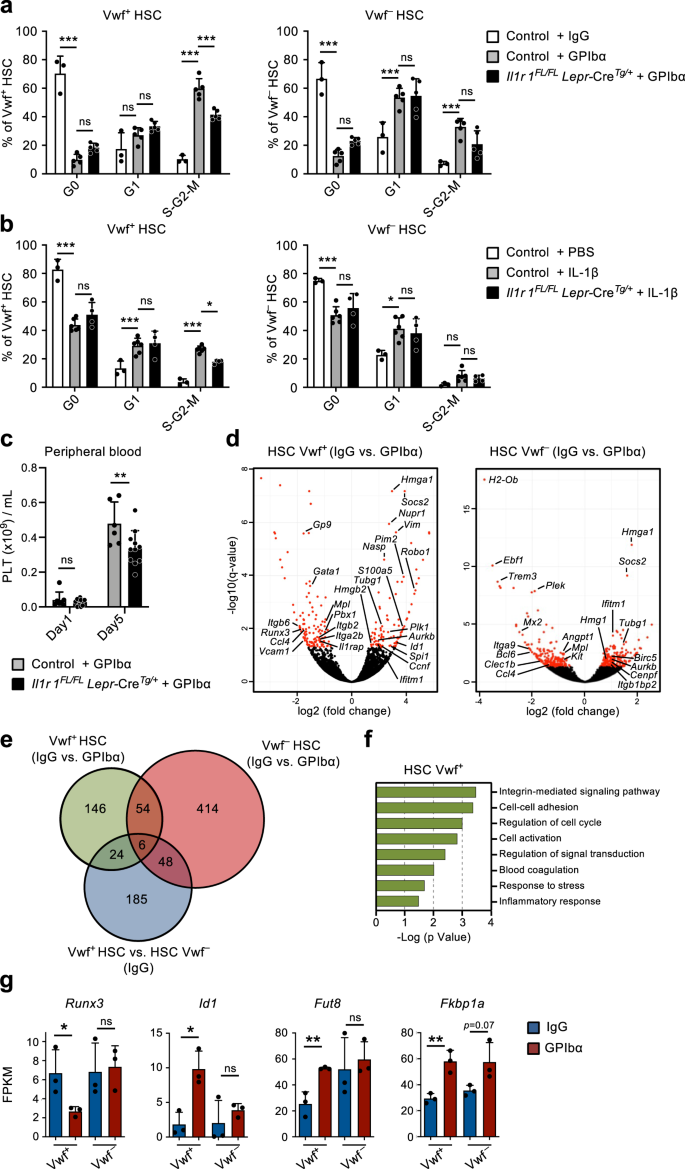
تمشيا مع الدراسات السابقة9، إعطاء جرعة واحدة من الأجسام المضادة لـGPIbα فولكس فاجن- الفئران GFP، لتقليد نقص الصفيحات الذي لوحظ في المرضى الذين يعانون من فرفرية نقص الصفيحات المناعية (ITP)، الصفائح الدموية المستنفدة بسرعة وكفاءة خلال يوم واحد دون التأثير بشكل كبير على سلالات خلايا الدم الأخرى (الشكل 1 أ). 1a). وكان ذلك مصحوبًا بتنشيط دورة الخلية السريعة (خلال يوم واحد) للين-SCA1+ج- كيت+ (LSK) فليت 3-CD48-CD150+ HSCs. وقد لوحظ بشكل تفضيلي التجنيد في دورة الخلية النشطة داخل فولكس فاجن-GFP+ (فف+) حجرة HSC (الشكل XNUMX). 1 ب - د) ، والتي يتم إثراؤها في الخلايا الجذعية السرطانية المتحيزة للصفائح الدموية ولكنها تحتوي في الغالب على الخلايا الجذعية السرطانية التي تعيد تكوين خطوط متعددة9,18. بينما أكثر من 60% من Vwf+ LSKFlt3-CD48-CD150+ دخلت الخلايا الجذعية السرطانية مرحلة S-G2-M من دورة الخلية، ولم يكن هناك سوى جزء صغير من فولكس فاجن-GFP- (فف-) دخلت HSCs S-G2-M. ومع ذلك، فإن معظم VWF- انتقلت الخلايا الجذعية السرطانية من مرحلة هادئة (G0) إلى مرحلة G1 أكثر تنشيطًا (الشكل XNUMX أ). 1c ، د).
(تتعلق بالتين التكميلية. 1 و 2). a التحليل الحركي لمعلمات خلايا الدم المحيطية بعد إعطاء الجسم المضاد لـ GPIbα. تم علاج الفئران في اليوم 0 باستخدام الأجسام المضادة للتحكم في نظير IgG. تمثل البيانات متوسط ± SEM لفئران 10 (Day0) و13 (Day1) و10 (Day2) و9 (Day3) و8 (Day5) و7 (Day10) من 14 تجربة مستقلة. الصفائح الدموية PLT، خلايا الدم البيضاء WBC، خلايا الدم الحمراء RBC. b ملامح ممثل FACS واستراتيجية النابضة فولكس فاجن-GFP+ (فف+) و فولكس فاجن-GFP- (فف-) LSKFlt3-CD150+CD48- HSCs في النقاط الزمنية المشار إليها بعد نضوب الصفائح الدموية. تشير الأرقام الموجودة في البوابات/الأرباع إلى تكرار (متوسط جميع الفئران التي تم تحليلها) لمجموعة الخلايا المسورة بين إجمالي الخلايا الحية (الألواح العلوية) أو بين الخلايا الجذعية السرطانية (الألواح السفلية). c, d تحليل دورة الخلية لـ Vwf+ و فف- LSKFlt3-CD150+CD48- HSCs في النقاط الزمنية المشار إليها بعد نضوب الصفائح الدموية. c ملامح دورة الخلية التمثيلية FACS من Vwf+ (يسار) وVwf- (يمين) HSCs في G0 (DAPI-كي 67-) G1 (دابي-كي 67+) أو S-G2-M (DAPI+كي 67+) مراحل دورة الخلية. تمثل الأرقام الموجودة في البوابات الترددات (متوسط جميع الفئران التي تم تحليلها) لمجموع الخلايا الجذعية السرطانية. d يعني ± SD توزيع مرحلة دورة الخلية من Vwf+ (يسار) وVwf- (يمين) HSCs. بيانات من 5 (Day0)، 5 (Day1)، 3 (Day2)، 5 (Day3)، 5 (Day5) و 4 (Day10) الفئران من 6 تجارب مستقلة. ***p <0.001 ؛ **p < 0.01 لجزء دورة الخلية S-G2-M؛ # # #p <0.001 لجزء دورة الخلية G1 (كلاهما يستخدم ANOVA ثنائي الاتجاه مع مقارنات Tukey المتعددة)؛ e الأعداد المطلقة لـ Vwf+ و فف- HSCs (لكل ساقين، راجع الطرق). متوسط بيانات ± SEM لفئران 2 (Day8) و 0 (Day8) و 1 (Day7) و 2 (Day5) و 3 (Day6) و 5 (Day5) من 10 تجارب مستقلة. ***p <0.001 لـ Vwf+ HSC (ANOVA ثنائي الاتجاه مع مقارنات توكي المتعددة)؛ #p <0.05 و # # #p <0.001 للمقارنة بين Vwf+ مقابل فولكس فاجن- HSCs (ANOVA ثنائي الاتجاه مع مقارنات Sidak المتعددة). وقت ظهور أول عضو الكنيست (f) وتواتر المستعمرات مع خلايا Mk فقط (g) في Vwf واحد مثقف-أو فولكس فاجن+ تم عزل الخلايا الجذعية السرطانية من الفئران بعد 16 ساعة من علاج IgG أو GPIbα. تم تحليل البيانات من 138 و364 و147 و451 مستعمرة مشتقة من خلية واحدة، على التوالي، من 5 مكررات بيولوجية في 4 تجارب مستقلة. f يمثل الخط الأوسط الوسيط، وتمثل حدود المربع النسب المئوية 25-75، والشعيرات تشير إلى النسب المئوية 5-95. يتم وضع علامة على الخلايا الواقعة خارج النسب المئوية 5-95 على أنها قيم متطرفة. P القيم المحسوبة باستخدام اختبار كروسكال واليس ومقارنات دن المتعددة. g P القيمة المحسوبة باستخدام اختبار فيشر الدقيق على الوجهين. ***p <0.001 ؛ **p <0.01 ؛ *p <0.05؛ نانوثانية، غير هامة (p > 0.05). h تحليل انتشار البيوتين فولكس فاجن-GFP+ HSCs بعد يومين من علاج IgG أو GPIbα. مؤامرة تمثيلية (يسار) ويعني ± SD MFI (تم تطبيعه من أجل MFI بدون التحكم في وضع العلامات على البيوتين ؛ يمين) من 2 فئران لكل مجموعة في 6 تجارب مستقلة. **p <0.01؛ محسوبة باختبار t على الوجهين. إعادة تكوين طويلة المدى (16 أسبوعًا) لسلالات الصفائح الدموية والنخاع الشوكي والخلايا اللمفاوية في الدم (i) ومقصورة BM HSC (j) بواسطة البيوتين العالي والبيوتين المنخفض فولكس فاجن-GFP+ كسور HSC بعد يومين من نفاد الصفائح الدموية. 2 خلية مزروعة لكل فأر. تمثل البيانات متوسط ± SEM لأربعة مانحين في تجربتين مستقلتين. تمثل كل نقطة متوسط الفئران المتلقية المزروعة لكل جهة مانحة. نانوثانية، غير هامة (p > 0.05)؛ محسوبة باختبارات t على الوجهين. انظر أيضًا التين التكميلي. 1 و 2.
سعينا بعد ذلك إلى مواصلة استكشاف الأساس الميكانيكي لتنشيط الخلايا الجذعية السرطانية التي لوحظت بعد استنفاد الصفائح الدموية. يرتبط الجسم المضاد لـGPIbα بـGPIbα (CD42b)، وهو مستقبل الثرومبين وVWF19مما يؤدي إلى تنشيط الصفائح الدموية وإزالة التحلل والتصفية اللاحقة بطريقة مستقلة عن مستقبلات Fc20. يتم التعبير عن GPIbα على وجه التحديد في سلالات الصفائح الدموية كبيرة النواة (Mk)، بما في ذلك MkPs، ولكن الأهم بالنسبة لدراساتنا وكما ذكر آخرون سابقًا21، تعبير GPIbα غير قابل للاكتشاف فعليًا على HSCs (الشكل التكميلي SXNUMX). 1a). بعد النضوب الأولي للصفائح الدموية، تعافت أعداد الصفائح الدموية ببطء، مع إعادة إنشاء تعداد الصفائح الدموية الطبيعي بين اليوم 5 و 10 بعد النضوب (الشكل XNUMX أ). 1a). والجدير بالذكر أن استنزاف الصفائح الدموية أدى إلى زيادة عدد VWF بمقدار 4 أضعاف+ LSKFlt3-CD48-CD150+ HSCs بيومين، بينما Vwf- زادت الخلايا الجذعية السرطانية مع حركية أبطأ بعد التخفيض الأولي (الشكل XNUMX أ). 1e). بعد ذلك، Vwf+/ففف- عادت نسبة HSC والأرقام المطلقة تدريجيًا إلى وضعها الطبيعي، بالتزامن مع تطبيع عدد الصفائح الدموية (الشكل XNUMX أ). 1أ، ه). الزيادة في Vwf+ كانت HSCs مصحوبة أيضًا بزيادة انتقائية في أعداد LSK Flt3-CD48+CD150+ مجموعة فرعية من MPPs (الشكل XNUMX). 1b والشكل التكميلي. 1b) يظهر أنه متحيز لـ Mk22. علاوة على ذلك، أعضاء الكنيست23 كما تم زيادة كبيرة بعد أيام قليلة من الزيادة في VWF+ HSCs ، في حين لم تتأثر أسلاف الكريات الحمر (Pre-CFU-E) والنخاع النخاعي (GMP) بشكل كبير (الشكل التكميلي SXNUMX). 1c ، د). تجدر الإشارة إلى أنه على الرغم من تعبير GPIbα القوي الخاص بهم وبالتوافق مع الآلية المستقلة عن Fc والتي يؤدي من خلالها الجسم المضاد إلى استنفاد الصفائح الدموية20، تم تخفيض MkPs في البداية بشكل طفيف (على الرغم من أنه ليس بشكل كبير) بينما لم يتم استنفاد Mks في BM عن طريق إعطاء الأجسام المضادة (الشكل التكميلي SXNUMX). 1 يوم-ز). بعد التنشيط الأولي السريع ، عادت الخلايا الجذعية السرطانية بسرعة إلى حالة السكون مع ملاحظة توزيع طور دورة الخلية الطبيعي بالفعل بعد 5 أيام من استنفاد الصفائح الدموية (الشكل XNUMX أ). 1c ، د). جسم مضاد أحادي النسيلة بديل (NIT E)20 الصفائح الدموية المستنفدة وتنشيط Vwf+ و فف- دورة الخلية HSC بطريقة مماثلة للجسم المضاد لـ GPIbα (الشكل التكميلي SXNUMX). 2a ، ب). كان علاج الأجسام المضادة لـ GPIbα مصحوبًا بتضخم الطحال الخفيف والعابر مع زيادة أعداد Vwf+ ولكن ليس VWF- الخلايا الجذعية السرطانية في الطحال (الشكل التكميلي XNUMX). 2c ، د).
تجنيد LSKFlt3 الهادئ-CD48-CD150+ تشير خلايا BM إلى التكاثر عند تنشيط الصفائح الدموية ونضوبها الحاد إلى وجود آلية ردود فعل يتم من خلالها تجنيد الخلايا الجذعية السرطانية الهادئة لإعادة إنشاء Mk وتوازن الصفائح الدموية. من أجل التحقق مما إذا كانت الخلايا الجذعية السرطانية من الفئران المستنفدة للصفائح الدموية أكثر كفاءة في توليد Mks، استخدمنا خلية واحدة Mk/GM في اختبار التمايز في المختبر. استنساخ Vwf واحد+ أو فولكس فاجن- LSKFlt3-CD48-CD150+ كانت الخلايا الجذعية السرطانية المعزولة من الفئران في التوازن (IgG) أو بعد نضوب الصفائح الدموية (GPIbα) مماثلة (حوالي 80٪؛ الشكل التكميلي SXNUMX). 2e). ومع ذلك، VWF واحد+ تمايزت الخلايا الجذعية السرطانية المعزولة من الفئران المستنفدة للصفائح الدموية بشكل أسرع في Mks مقارنة بـ Vwf- HSCs من الفئران المستنفدة للصفائح الدموية أو Vwf+ الخلايا الجذعية السرطانية المعزولة من الفئران في حالة التوازن (الشكل XNUMX أ). 1f) وأنتج أيضًا عددًا أكبر من المستعمرات التي تتكون حصريًا من Mks (الشكل XNUMX أ). 1g والشكل التكميلي. 2 و ، ز). لقد ثبت سابقًا أن السلفيات الملتزمة بـ Mk والتي تشبه الجذع والتي تشبه ظاهريًا الخلايا الجذعية السرطانية تتكاثر استجابةً لنقص الصفيحات الناجم عن بولي (I: C)24. لذلك، لإثبات أن LSKFlt3-CD48-CD150+ تشتمل خلايا BM المستحثة على التكاثر استجابةً لاستنزاف الصفائح الدموية الناجم عن مضاد GPIbα على الخلايا الجذعية السرطانية المعاد تعدادها على المدى الطويل، وقد استخدمنا فئران H2B-mCherry المحفزة للدوكسيسيكلين (tet-ON)6,25. في هذا النظام، تؤدي نبضة من العلاج بالدوكسيسيكلين إلى دمج الهستونات الموسومة بـ mCherry في النيوكليوزومات، والتي تنقسم بالتساوي بين الخلايا الوليدة عندما تتكاثر الخلايا. بالاتفاق مع تحليل دورة الخلية (الشكل XNUMX). 1c ، د) ، أدى استنزاف الصفائح الدموية المستحث بـ GPIbα إلى زيادة انتشار الخلايا الجذعية السرطانية ، كما يتضح من زيادة التخفيف من وضع العلامات mCherry بعد 3 أيام (الشكل التكميلي SXNUMX). 2h). الأهم من ذلك، FACS فرزها mCherrylo (التكاثري) LSKFlt3-CD48-CD150+ كان للخلايا التي تم فرزها من الفئران المستنفدة للصفائح الدموية إمكانية إعادة تكوين متعدد السلالات على المدى الطويل (LT ؛ 16 أسبوعًا) (الشكل التكميلي SXNUMX). 2i) ، مما يدل على أن استنزاف الصفائح الدموية الناجم عن مضادات GPIbα يجند LT-HSCs القوية في الانتشار. لمقارنة Vwf بشكل مباشر أكثر+ الخلايا الجذعية السرطانية التي يتم تنشيطها أو التي تظل في حالة غير متكاثرة بعد استنفاد الصفائح الدموية، استخدمنا طريقة وضع العلامات غير الغازية استنادًا إلى حقن مشتق البيوتين N-هيدروكسيل سلفوسوكسينيميد (البيوتين)، والذي يقوم بتسمية بروتينات الغشاء لجميع خلايا BM بكفاءة26. عندما تنقسم الخلايا، يتم توزيع بروتينات الغشاء المسمى بالتساوي بين الخلايا الوليدة مما يسمح بتحليل تاريخ انقسام الخلايا في الجسم الحي. وبالمثل، بالنسبة لنموذج H2B-mCherry، أدى استنفاد الصفائح الدموية إلى انخفاض وضع العلامات على البيوتين لـ Vwf+ HSCs (الشكل . 1h) وأيضا من Vwf- HSCs (الشكل التكميلي XNUMX). 2j). الاختلافات التي لوحظت في دورة الخلية وتحليلات انتشار Vwf- من المحتمل أن تعكس HSCs العلاقة الهرمية الموصوفة مسبقًا بين Vwf+ و فف- HSCs9. وهكذا، تكاثر Vwf+ قد تتمايز HSCs إلى Vwf- HCS، والتي تحمل تاريخ تخفيف تسمية البيوتين. الأهم من ذلك، FACS فرز VWF+Biotinlo (التكاثري) LSKFlt3-CD48-CD150+ الخلايا المصنفة من الفئران المستنفدة للصفائح الدموية (الشكل التكميلي SXNUMX). 2 ك ، ل) كان في الجسم الحي على المدى الطويل (LT ؛ 16 أسبوعًا) إمكانية إعادة تكوين السلالات المتعددة (الشكل XNUMX أ). 1i) ، مما يدل على أن استنزاف الصفائح الدموية الناجم عن مضادات GPIbα يجند LT-HSCs القوية في الانتشار. في حين أن تجديد الصفائح الدموية بشكل فعال، لم يلاحظ أي تحيز كبير في الصفائح الدموية لـ Vwf+ تتكاثر الخلايا الجذعية السرطانية استجابة لنضوب الصفائح الدموية، مقارنة بالخلايا غير التكاثرية (البيوتينHi) فف+ HSCs (الشكل . 1i). بغض النظر، كلا جزأي البيوتين من Vwf+ أظهرت HSCs إعادة تشكيل LT-HSC مماثلة (الشكل XNUMXA). 1j) وكانت فعالة بشكل عام بنفس القدر في إنشاء Vwf+ و فف- مقصورات HSC (الشكل التكميلي XNUMX). 2m). وهذا يتماشى مع تجنيد LT-HSCs المحددة وظيفيًا في الانتشار ومع حقيقة أن النسب النسبية لـ Vwf+ و فف- تعود الخلايا الجذعية السرطانية إلى وضعها الطبيعي إلى حد كبير بمجرد إعادة التوازن (الشكل XNUMX أ). 1 ب، ه).
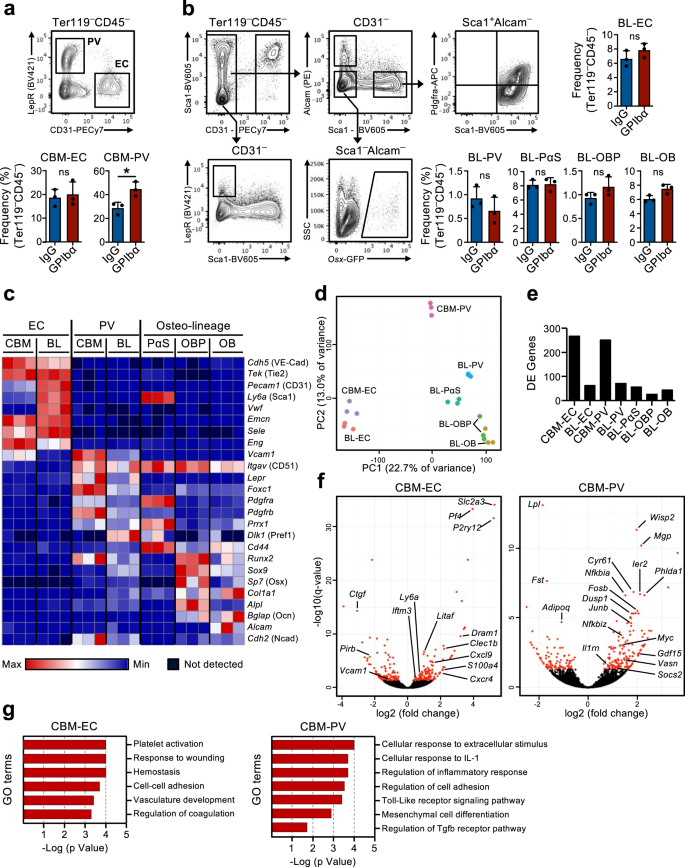
إعادة البرمجة النسخية لمكانة HSC استجابةً لنضوب الصفائح الدموية الحاد
إن وجود آلية ردود الفعل التي يتم من خلالها تجنيد الخلايا الجذعية السرطانية الهادئة في الانتشار استجابةً لنضوب الصفائح الدموية يعني أن الخلايا الجذعية السرطانية الموجودة في BM يجب أن تكون قادرة على استشعار الطلب على إنتاج الصفائح الدموية. لقد افترضنا أن الخلايا المتخصصة اللحمية في نخاع العظم قد تكون متورطة في هذه العملية. في الواقع، تم اقتراح تغييرات في مجال BM بعد نضوب الصفائح الدموية مسبقًا16,17 لكن تورط خلايا متخصصة محددة في تنظيم وظيفة HSC في هذا السياق لم يتم إثباته بشكل مباشر. لذلك، استخدمنا تحليل تسلسل الحمض النووي الريبي (RNA) العالمي لمجموعات الخلايا المتخصصة BM التي تم وصفها مسبقًا وكذلك الخلايا الجذعية السرطانية للتحقيق في التفاعلات الجزيئية المحتملة بين هذه الخلايا، المشاركة في استجابة HSC لاستنفاد الصفائح الدموية. لهذا، تم عزل الخلايا غير المكونة للدم من اثنين من الموصوفة27,28,29 مناطق تشريحية متميزة في BM: خلايا BM المركزية (CBM) وخلايا بطانة العظام (BL) (الشكل التكميلي XNUMX). 3a). داخل CD45-تير119- الخلايا غير المكونة للدم في كل من كسور BL وCBM، يتم تعريف مجموعات الخلايا المتخصصة المميزة على أنها CD31Hi الخلايا البطانية (EC) وCD31-الجذام+ الخلايا المحيطة بالأوعية الدموية (PV). في الكسر BL قمنا بتعريف CD31 بشكل أكبر-الكام-Pdgfrα+SCA1+ (PαS) أسلاف اللحمة المتوسطة، وكذلك CD31-الكام-SCA1-OSX-GFP+ أسلاف الخلايا العظمية (OBP) وCD31-الكام+SCA1- الخلايا العظمية (OB) (الشكل XNUMX). 2a ، ب). لم يكشف تحليل التدفق الخلوي لهذه الخلايا المعزولة من الفئران في التوازن وبعد يوم واحد من استنفاد الصفائح الدموية عن تغييرات كبيرة في التركيب الخلوي، إلى جانب زيادة صغيرة ولكن مهمة في خلايا CBM-PV (الشكل 1 أ). 2a ، ب). أظهر تحليل تسلسل الحمض النووي الريبي (RNA) مجموعات متميزة من مجموعات مختلفة من الخلايا البطانية واللحمة المتوسطة وخلايا HSC (الشكل التكميلي SXNUMX). 3b). التعبير عن العلامات المعروفة التي تحدد مجموعات الخلايا المتخصصة المتميزة (الشكل XNUMX أ). 2c والبيانات التكميلية 1) ومن منظمات المكونة للدم المختلفة متجمعة حسب نمط التعبير الجيني (الشكل التكميلي XNUMX). 3c والبيانات التكميلية 1) ، وأكد كذلك هوياتهم الخلوية المتميزة. بالإضافة إلى ذلك، أظهر تحليل المكون الرئيسي (PCA) لمجموعات الخلايا المتخصصة فصل خلايا النسب البطانية واللحمة الوسيطة على طول محور المكون الرئيسي (PC) 1، وفصل إضافي لمجموعات الخلايا الوسيطة على طول محور PC2 بناءً على مرحلة التمايز (الشكل XNUMX أ). 2d). أظهر تحليل التعبير الجيني التفاضلي، بمقارنة الخلايا المتخصصة المعزولة من الفئران في التوازن واستنفاد الصفائح الدموية بعد يوم واحد، عددًا كبيرًا من الجينات المعبر عنها تفاضليًا (DE) في خلايا CBM-EC (1 جينًا) وخلايا CBM-PV (266 جينًا) (الشكل . 2 هـ ، ص والبيانات التكميلية 2, 3). في المقابل، تم اكتشاف عدد أقل بكثير من جينات DE في مجموعات متخصصة أخرى، بما في ذلك BL-EC وBL-PV المرتبطة بالعظام (الشكل XNUMX أ). 2 هـ ، صالشكل التكميلي 3d ، ه والبيانات التكميلية 2-4) ، مما يشير إلى مشاركة تفضيلية متخصصة في تدابير بناء الثقة في الاستجابة لنقص الصفيحات. سلط تحليل علم الجينات (GO) الذي تم إجراؤه على جينات DE من CBM-EC الضوء على العمليات البيولوجية المرتبطة بتنشيط / تخثر الصفائح الدموية (بف4, Clec1b, P2ry12)، الاستجابة للتوتر (إفتم3، لطاف، S100a4) والتصاق الخلايا (Vcam1، كتجف) (تين. 2g والبيانات التكميلية 5). كشف تحليل GO على جينات CBM-PV DE عن العمليات البيولوجية المرتبطة بالالتهاب وخاصة مع الاستجابة الخلوية للإنترلوكين -1 المؤيد للالتهابات (IL-1) (الشكل XNUMX أ). 2g والبيانات التكميلية 5). العمليات البيولوجية الأخرى التي تم تسليط الضوء عليها في خلايا CBM-PV هي إشارات مستقبلات Toll-like (TLR) -4، حيث تتم مشاركة مسارات الإشارات في اتجاه مجرى المستقبل جزئيًا مع إشارات IL-1، وكذلك التمايز الوسيطي وإشارات TGFβ (فاسن، FST، Wisp2، Cyr61) (تين. 2 و ، ز).
(تتعلق بالشكل التكميلي XNUMX). 3). تحليل FACS واستراتيجيات النابضة لفرز الخلايا البطانية والسدوية في نخاع العظم المركزي (CBM؛ a) وبطانة العظام (BL؛ b) حجرات الخلايا في الفئران بعد يوم واحد من استنفاد الصفائح الدموية (علاج الأجسام المضادة GPIbα). تلقت فئران التحكم الأجسام المضادة للتحكم في النظير (IgG). تمثل المخططات الشريطية متوسط ترددات ± SD (٪) لكل مجموعة من الخلايا بين إجمالي CD1 غير المكون للدم-تير119- الخلايا. البيانات مأخوذة من 3 فئران لكل مجموعة في 3 (a) و شنومكس (b) تجارب مستقلة. *p <0.05؛ نانوثانية غير هامة (p > 0.05)؛ يتم تقييمها بواسطة اختبار t على الوجهين. c-g تحليل تسلسل الحمض النووي الريبي (RNA) لمقصورات الخلايا البطانية / اللحمية لدى الفئران بعد يوم واحد من استنفاد الصفائح الدموية. c التعبير (FPKM) للجينات التي تميز مجموعات الخلايا المتخصصة المختلفة. d تحليل المكون الرئيسي للتعبير الجيني الطبيعي لمجموعات الخلايا المختلفة التي تم فحصها. e عدد الجينات المعبر عنها تفاضليًا (DE) بين الفئران المعالجة بـ IgG وGPIbα (المعدلة p القيمة (q) <0.05)، في كل مجموعة من الخلايا المتخصصة التي تم فحصها. f مؤامرات بركان و g مصطلحات علم الجينات (GO) تحليل الجينات المعبر عنها تفاضليًا في الخلايا البطانية CBM (EC) و Lepr+ الخلايا المحيطة بالأوعية الدموية (PV). في fتشير النقاط الحمراء إلى جينات DE بشكل ملحوظ (q <0.05. بالنسبة لجميع اللوحات، تمثل البيانات متوسط ± SD FPKM لثلاث مكررات بيولوجية من تجربتين مستقلتين. الخلايا العظمية OB، أسلاف الخلايا العظمية OBP، PαS Pdfgrα+SCA1+ أسلاف اللحمة المتوسطة. انظر أيضًا الشكل التكميلي. 3.
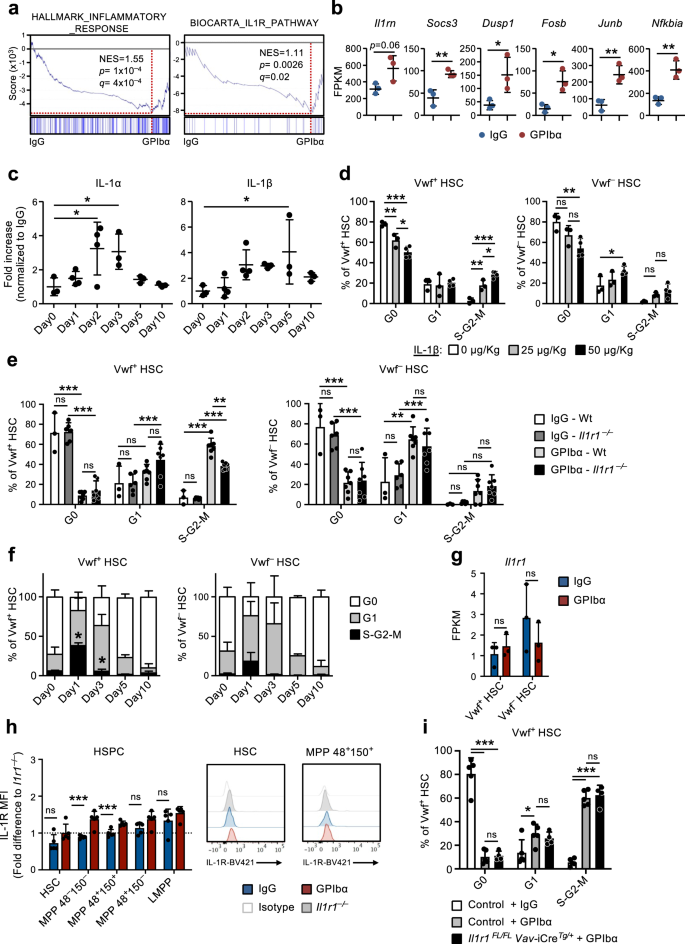
تعد إشارات IL-1 في الخلايا غير المكونة للدم أمرًا بالغ الأهمية لاستجابة HSC لاستنفاد الصفائح الدموية
أكد تحليل إثراء مجموعة الجينات (GSEA) إثراء الجينات المرتبطة بالاستجابة الالتهابية وإشارات مستقبل IL-1 التي لوحظت في خلايا CBM-PV المعزولة من الفئران المعالجة بـ GPIbα (الشكل XNUMXA). 3a). وشملت هذه الجينات Il1rn (الجين المستهدف IL-1 ومضاد مسار الإشارة IL-1)، Soc3 و Dusp1 (المنظمون لمسار الإشارة IL-1) و Fosb, جنب و نفكبيا (مكونات المسارات التي يتم تنشيطها في اتجاه مجرى سلسلة إشارات IL-1) (الشكل XNUMX أ). 3b). لمزيد من التحقيق في دور الالتهاب المعقم في هذه العملية، قمنا بتحليل مستويات السيتوكينات المختلفة المؤيدة للالتهابات في السائل خارج الخلية BM للفئران المعالجة بـ GPIbα. كشف هذا التحليل عن زيادة كبيرة في مستويات كل من IL-1α و IL-1β بعد نضوب الصفائح الدموية (الشكل XNUMXA). 3c) ، مع حركية توازي التوسع والتطبيع اللاحق لـ Vwf+ إتش إس سي (الشكل . 1e). كما شوهدت زيادة أولية مماثلة في TNFα على الرغم من استمرارها بعد الوقت الذي تم فيه Vwf+ تم تطبيع حالة دورة الخلية HSC (الشكل التكميلي SXNUMX). 4a). لم تتغير السيتوكينات الالتهابية الأخرى إلى حد كبير (IL-6 و IL-12) أو انخفضت في المراحل اللاحقة (INFγ) بعد نضوب الصفائح الدموية (الشكل التكميلي SXNUMX). 4a). في الحالة المستقرة، تبين أن IL-1 يتم إنتاجه بشكل أساسي عن طريق الخلايا التائية المنتشرة (IL-1α) والخلايا المحببة (IL-1β)30. في مجموعات البيانات لدينا يتم تحليل تعبير IL-1 على حد سواء Il1a و إيل1ب كانت غير قابلة للاكتشاف في الغالب في مجموعات الخلايا المتخصصة المختلفة وكذلك في الخلايا الجذعية السرطانية (الشكل التكميلي SXNUMX). 4b) ، في حين أن Mks الأساسي (الشكل التكميلي SXNUMX). 4c ، د) أظهر تعبيرًا عاليًا، على وجه الخصوص Il1a (الشكل التكميلي. 4b).
(تتعلق بالشكل التكميلي XNUMX). 5). a تحليل إثراء مجموعة الجينات (GSEA) لبيانات التعبير الجيني العالمية من خلايا CBM-PV لمجموعات الجينات المشار إليها. NES، درجة الإثراء الطبيعية (أو النتيجة المقاسة). b التعبير عن الجينات التابعة لمسار الإشارة IL-1 في خلايا CBM-PV بعد يوم واحد من استنفاد الصفائح الدموية. تمثل البيانات متوسط ± SD FPKM لثلاث مكررات بيولوجية من تجربتين مستقلتين. **p <0.01 ؛ *p <0.05 (اختبار t على الوجهين). c متوسط مستويات ± SD لـ IL-1α و IL-1β في السائل خارج الخلية لنخاع العظم المعزول من الفئران في النقاط الزمنية المحددة بعد استنفاد الصفائح الدموية (علاج الأجسام المضادة GPIbα). تلقت فئران التحكم (اليوم 0) الأجسام المضادة للتحكم في النظير (IgG). البيانات مأخوذة من 3 (Day0)، 4 (Day1)، 4 (Day2)، 3 (Day3)، 3 (Day5) و 3 (Day10) الفئران من 4 تجارب مستقلة. *p <0.05 (ANOVA أحادي الاتجاه مع مقارنات Dunnett المتعددة). d تحليل دورة الخلية لـ Vwf+ (يسار) وVwf- (يمين) الخلايا الجذعية السرطانية المأخوذة من الفئران بعد يوم واحد من إعطائها عن طريق الوريد للكميات المشار إليها من IL-1β. تمثل البيانات متوسط ± SD لثلاثة فئران تستقبل 1 أو 3 ميكروجرام/كجم، و0 فئران تستقبل 25 ميكروجرام/كجم IL-4β، في تجربتين مستقلتين. تحليل دورة الخلية لـ Vwf+ (يسار) وVwf- (يمين) HSCs من وزن و ايل1ر1- / - الفئران 1 يوم (e) أو لـ HSCs من ايل1ر1- / - الفئران في النقاط الزمنية المحددة (f) بعد نضوب الصفائح الدموية. e يعني ± بيانات SD من 3 (IgG-Wt)، 6 (IgG-ايل1ر1- / -) 7 (GPIbα -Wt) و7 (GPIbα –ايل1ر1- / -) الفئران من 5 تجارب مستقلة. f متوسط ترددات ± SD من الفئران 6 (Day0) و 7 (Day1) و 3 (Day3) و 3 (Day5) و 3 (Day10) في 4 تجارب مستقلة. *p <0.05 (مقارنة بنفس التحليل لـ Wt Vwf+ و فف- HSCs في الشكل. 1d). g, h ايل1ر1تحليل التعبير / IL-1R (h) على مستوى الحمض النووي الريبي (RNA) عن طريق تسلسل الحمض النووي الريبي (FPKM) في Vwf+ و فف- HSCs و (i) على مستوى البروتين عن طريق قياس التدفق الخلوي في مجموعات فرعية من HSPCs، معزولة عن الفئران في التوازن أو استنزاف الصفائح الدموية بعد يوم واحد. h يعني ± بيانات SD FPKM من 3 مكررات بيولوجية لكل حالة. i يعني ± بيانات SD لمتوسط شدة التألق (MFI) الذي تم تطبيعه إلى MFI من سكان الخلية المكافئين في ايل1ر1- / - الفئران التي تم تحليلها ضمن نفس التجربة. البيانات مأخوذة من 5 فئران لكل حالة، في تجربتين مستقلتين. i تحليل دورة الخلية فولكس فاجن-tdTomato+ HSCs من الفئران مع الحذف المشروط لـ ايل1ر1 في جميع الخلايا المكونة للدم (ايل1ر1فلوريدا/فلوريدا فاف-لجنة المساواة العرقيةتيراغرام/+) يوم واحد بعد نفاد الصفائح الدموية. تشمل الضوابط فولكس فاجن-tdTomato+ HSCs من ايل1ر1فلوريدا/+ فاف-لجنة المساواة العرقيةتيراغرام/+, ايل1ر1+ / + فاف-لجنة المساواة العرقيةتيراغرام/+ و فاف-Cre+ / + الفئران (تمثل الأنماط الجينية دون فقدان وظيفة IL-1R). تمثل البيانات متوسط ترددات ± SD البالغة 5 (التحكم-IgG)، و5 (التحكم-GPIbα) و4 (ايل1ر1فلوريدا/فلوريدا فاف-لجنة المساواة العرقيةتيراغرام/+-GPIbα) الفئران من 3 تجارب مستقلة. ***p <0.001 ؛ **p <0.01 ؛ *p <0.05؛ نانوثانية غير هامة (p > 0.05)؛ باستخدام اختبار t على الوجهين (b, g, h) أو ANOVA ثنائي الاتجاه مع مقارنات Tukey المتعددة (d-f, i). انظر أيضًا الشكل التكميلي. 4.
أدت إدارة IL-1 المؤتلف إلى الفئران إلى تنشيط دورة الخلية لـ Vwf+ و فف- HSCs (الشكل . 3d)، مع Vwf+ يتم تجنيد الخلايا الجذعية السرطانية بدرجة أعلى في مرحلة S-G2-M من دورة الخلية (الشكل التكميلي SXNUMX). 4e) ، متوافق مع IL-1 الذي يتوسط في تنشيط HSC استجابةً لنقص الصفيحات الناجم عن مضاد GPIbα. للتحقيق في هذه الفرضية بشكل أكثر تحديدًا، قمنا بتحريض استنزاف الصفائح الدموية في الفئران التي تعاني من نقص IL-1R (ايل1ر1-/-)، والتي تحتوي على مقصورة HSC عادية30 وأعداد الصفائح الدموية الطبيعية. الأهم من ذلك، ايل1ر1-/- أظهرت الفئران انخفاضًا كبيرًا في وتيرة ركوب الدراجات بنشاط (S-G2-M) Vwf+ HSCs بعد نضوب الصفائح الدموية (الشكل XNUMX أ). 3 هـ ، ص) ، بالمقارنة مع الفئران من النوع البري (Wt) المعالجة بـ GPIbα. حقيقة ان ايل1ر1 لم يلغي النقص تمامًا تنشيط دورة الخلية للخلايا الجذعية السرطانية استجابةً لعلاج GPIbα مما يشير إلى وجود آليات أخرى (مستقلة عن IL-1). بالاتفاق مع هذا، أظهرنا سابقًا زيادة في مستويات THPO في المصل بعد يوم واحد من استنفاد الصفائح الدموية9. لتحديد الإشارات الأخرى التي يحتمل أن تتآزر مع IL-1 في تنشيط HSCs بعد استنفاد الصفائح الدموية، قمنا بتحليل التعبير عن منظمات HSC المعروفة، بما في ذلك Tgfb1 و بف4، المتورط سابقًا في هدوء HSC31,32، و FGF1، المرتبطة سابقًا بانتشار HSC32. كشف تحليل تسلسل الحمض النووي الريبي (RNA) لمجموعات الخلايا المتخصصة المتميزة عن تنظيم يزيد عن 20 ضعفًا بف4 في CBM-EC (الشكل التكميلي XNUMX). 4f)، في حين لم يتغير في التعبير عن Tgfb1 و FGF1 وقد لوحظ. قمنا أيضًا بالتحقيق في مستويات البروتين لهؤلاء المنظمين في استنفاد الصفائح الدموية بعد السائل خارج الخلية. تمشيا مع تحليل التعبير الجيني ، لم يتم تغيير مستويات TGFβ1 و FGF1 ، ولكن تمت زيادة PF4 بشكل ملحوظ بعد يوم واحد من استنفاد الصفائح الدموية بوساطة GPIbα (الشكل التكميلي S1). 4g). بالنظر إلى الدور الموصوف مسبقًا لـ PF4 في إحداث هدوء HSC31,33، من غير المرجح أن تفسر المستويات المتزايدة الملحوظة من PF4 في السائل خارج الخلية BM تنشيط انتشار HSC بعد استنفاد الصفائح الدموية.
كشف تسلسل الحمض النووي الريبي (RNA) عن مستويات منخفضة جدًا (≈1 FPKM) من ايل1ر1 النصوص في HSCs (الشكل XNUMX أ). 3g). أظهر تحليل التدفق الخلوي مستويات غير قابلة للاكتشاف من بروتين IL-1R على الخلايا الجذعية السرطانية ومستويات منخفضة في عدة مجموعات فرعية من MPP (الشكل XNUMX أ). 3h والشكل التكميلي. 5a). بالإضافة إلى عدم وجود تعبير IL-1R يمكن اكتشافه، لم يتم العثور على أي من الجينات المرتبطة بإشارات IL-1 المنتظمة في CBM-PV ليتم تنظيمها في Vwf+ أو فولكس فاجن- HSC بعد علاج GPIbα (الشكل التكميلي XNUMX). 5b). على الرغم من أننا لم نلاحظ تعبير IL-1R القابل للاكتشاف في الخلايا الجذعية السرطانية المحددة ظاهريًا، فقد تم اقتراح IL-1 مسبقًا لتنشيط الخلايا الجذعية السرطانية30. لذلك، لمعرفة ما إذا كان IL-1 قد يتوسط بشكل مباشر في تنشيط الخلايا الجذعية السرطانية بعد نقص الصفيحات الناجم عن مضاد GPIbα، فقد تسببنا في استنفاد الصفائح الدموية في ايل1ر1فلوريدا/فلوريدا فاف-iCreتيراغرام/+ الفئران التي تستهدف حذف ايل1ر1 لجميع الخلايا المكونة للدم، بما في ذلك الخلايا الجذعية السرطانية. تحليل القطرات الرقمية PCR لـ Vwf+ و فف- أكدت HSCs> كفاءة الحذف بنسبة 99٪ لـ ايل1ر1 الأليلات المفلطحة بواسطة Vav-iCre في كل من Vwf+ و فف- مجموعات فرعية HSC (الشكل التكميلي XNUMX). 5c). على عكس ما لاحظناه في السلالة الجرثومية ايل1ر1-/- الفئران (الشكل. 3 هـ ، ص), ايل1ر1فلوريدا/فلوريدا فاف-iCreتيراغرام/+ أظهرت الفئران تنشيط دورة الخلية الناجم عن GPIbα بكفاءة متساوية لـ Vwf+ HSC كما هو الحال في الفئران بالوزن (الشكل XNUMXA). 3i). توضح هذه النتائج معًا أن إشارات IL-1R المباشرة من خلال الخلايا الجذعية السرطانية أو الخلايا الأخرى المكونة للدم لا تشارك في تنشيط دورة الخلية المتميزة للخلايا الجذعية السرطانية استجابةً لاستنفاد الصفائح الدموية، بل تشير إلى دور إشارات IL-1 غير المكونة للدم في هذه العملية.
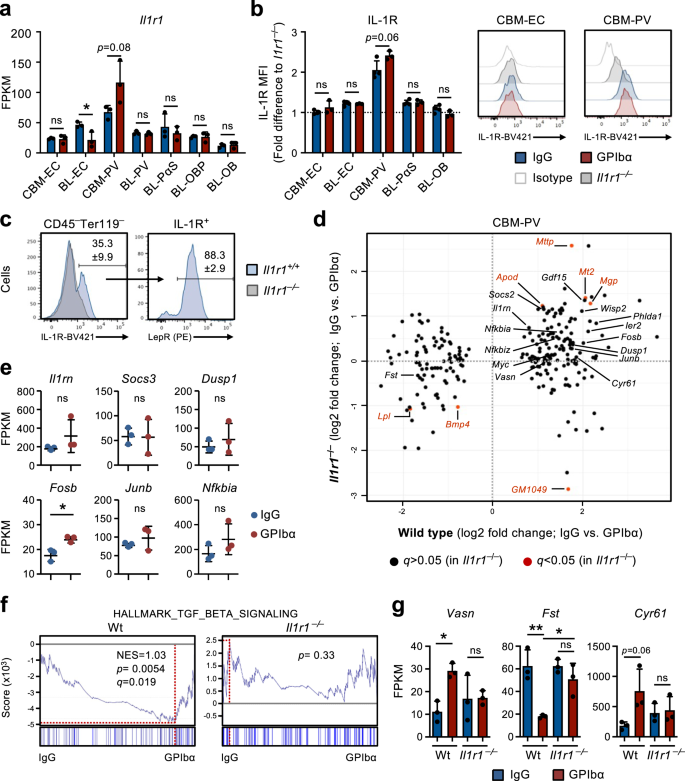
يؤدي استنزاف الصفائح الدموية إلى تنشيط إشارات IL-1 في الخلايا المحيطة بالأوعية الدموية
دراساتنا في ايل1ر1فلوريدا/فلوريدافاف-iCreتيراغرام/+اقترح تحليل الفئران وتسلسل الحمض النووي الريبي (RNA) للخلايا المتخصصة في BM أن إشارات IL-1 في الخلايا المتخصصة، بدلاً من الخلايا الجذعية السرطانية أو غيرها من الخلايا المكونة للدم، قد تلعب دورًا في تنشيط ردود الفعل للخلايا الجذعية السرطانية بعد استنفاد الصفائح الدموية. من بين الخلايا المتخصصة، أظهرت خلايا CBM-PV أعلى مستويات النسخ من Il1r1 التعبير (الشكل. 4a) وأظهر أيضًا تعبيرًا مميزًا لبروتين IL-1R ، في حين أن جميع مجموعات الخلايا اللحمية / البطانية الأخرى كانت سلبية تقريبًا بالنسبة للتعبير السطحي للخلية IL-1R القابل للاكتشاف (الشكل XNUMXA). 4b). في الواقع، يمكن تخصيص كل تعبيرات IL-1R تقريبًا في CBM إلى Lepr+ الخلايا الكهروضوئية (الشكل XNUMX). 4c) ، والتي عبرت عن مستويات أعلى من المنظمين الحاسمين لـ HSC مثل Cxcl12 و كيتل، بالمقارنة مع IL-1R باطن العظم–/لو خلايا BL-PV (الشكل التكميلي XNUMX). 3c). الأهم من ذلك هو أن مقارنة جينات DE في خلايا CBM-PV من Wt و ايل1ر1-/- كشفت الفئران في التوازن وبعد علاج GPIbα أن غالبية جينات DE التي تم تحديدها في الفئران بالوزن بعد نضوب الصفائح الدموية (الأشكال XNUMX أ). 2f و 3b) لم يتم التعبير عنها بشكل مختلف في خلايا CBM-PV من الخلايا المستنفدة للصفائح الدموية ايل1ر1-/- الفئران (الشكل. 4d) ، بما في ذلك الجينات المرتبطة مباشرة بتنشيط مسار إشارات IL-1 (الشكل XNUMX أ). 4e). بالإضافة إلى الجينات المرتبطة بتشوير IL-1، وجدنا دليلًا على وجود DE المعتمد على IL-1R للمسارات المتورطة في التنظيم الخارجي لانتشار HSC، بما في ذلك مسار إشارات TGFβ (الأشكال XNUMX). 2g و 4 د، و، ز)34. وشمل ذلك رفع مستوى التنظيم فاسن (فاسورين)، وهو مثبط مباشر لإشارة TGFβ35 المتورط سابقا في تفعيل HSC36. تم تضمين جينات DE الأخرى المعتمدة على IL-1R FST (فوليستاتين)، وهو مثبط مباشر لإشارة BMP/Activin37 وأظهر سابقًا أنه يمنع تمايز Mk عن الخلايا السلفية المكونة للدم38والجينات المرتبطة بالتصاق الخلايا وربط / تنظيم الإنتغرين (الشكل XNUMX أ). 2 و ، ز و 4 يوم-ز).
a تحليل تسلسل الحمض النووي الريبي (RNA). ايل1ر1 التعبير الجيني (FPKM) في خلايا متخصصة مختلفة معزولة من الفئران في التوازن (معالجة IgG) أو استنزاف الصفائح الدموية بعد يوم واحد (معالجة GPIbα). يعني ± بيانات SD FPKM من 1 مكررات بيولوجية من تجربتين مستقلتين. b, c تحليل التدفق الخلوي للتعبير IL-1R في مجموعات مختلفة من الخلايا البطانية / اللحمية المعزولة من الفئران في التوازن أو استنزاف الصفائح الدموية بعد يوم واحد. يعني ± بيانات SD لمتوسط شدة التألق (MFI) الذي تم تطبيعه إلى MFI من سكان الخلية المكافئين في ايل1ر1- / - الفئران التي تم تحليلها ضمن نفس التجربة (b). c تردد الجذام+ الخلايا الكهروضوئية في مجموع IL-1R+ الخلايا غير المكونة للدم CBM المعزولة من الفئران في التوازن. بيانات من 4 (IgG) و 3 (GPIbα) الفئران في تجربتين مستقلتين. d تحليل تسلسل الحمض النووي الريبي (RNA) لخلايا CBM-PV المعزولة من ايل1ر1+ / + و ايل1ر1- / - الفئران في التوازن وبعد استنفاد الصفائح الدموية، للتعبير عن الجينات المستجيبة للعلاج CBM-PV-GPIbα. البيانات من 3 مكررات البيولوجية لكل حالة. e التعبير عن الجينات التابعة لمسار الإشارة IL-1 في خلايا CBM-PV المعزولة من ايل1ر1- / - الفئران 1 يوم بعد نضوب الصفائح الدموية. يعني ± بيانات SD FPKM من 3 مكررات بيولوجية لكل حالة. GSEA لبيانات التعبير الجيني العالمية لمجموعة الجينات المشار إليها (f) والتعبير (FPKM؛ يعني ± SD) من الجينات المشار إليها (g)، في خلايا CBM-PV من النوع البري و ايل1ر1- / - الفئران في التوازن وبعد نضوب الصفائح الدموية. بيانات من 3 الفئران لكل حالة. NES، درجة الإثراء الطبيعية (أو النتيجة المقاسة). *p <0.05 ؛ **p <0.01؛ نانوثانية، غير هامة (p > 0.05)؛ باستخدام اختبار t على الوجهين (a, b, e) و ANOVA ثنائي الاتجاه مع مقارنات Tukey'a المتعددة (g).
تعد إشارات IL-1 في الخلايا المحيطة بالأوعية الدموية أمرًا بالغ الأهمية للتنشيط الأمثل لـ Vwf+ HSC
للتحقيق بشكل مباشر أكثر في دور إشارات IL-1 في خلايا CBM-PV في تنشيط Vwf+ الخلايا الجذعية السرطانية استجابةً لنقص الصفيحات، قمنا بتحريض استنزاف الصفائح الدموية في الفئران مع الحذف المشروط لـ ايل1ر1 على وجه التحديد في الجذام+ الخلايا الكهروضوئية (الشكل التكميلي XNUMX). 5d). ايل1ر1فلوريدا/فلوريداالجذام-Creتيراغرام/+ أظهرت الفئران انخفاضًا كبيرًا في ركوب الدراجات بنشاط (S-G2-M) Vwf+ HSCs ، بالمقارنة مع فئران التحكم المعالجة بـ GPIbα (الشكل XNUMX أ). 5a). كان الانخفاض في تنشيط دورة الخلية مشابهًا للذي لوحظ في حذف الخط الجرثومي ايل1ر1-/- الفئران (الشكل. 3 هـ ، ص) ، مما يدعم ذلك الجذام+ خلايا CBM-PV هي الخلايا الرئيسية المشاركة في تنشيط Vwf المعتمد على IL-1R+ HSCs استجابة لنقص الصفيحات الناجم عن GPIbα. ولتأكيد هذه النتائج، تم إعطاء IL-1 المؤتلف لـ ايل1ر1فلوريدا/فلوريداالجذام-Creتيراغرام/+ أدت الفئران إلى انخفاض توظيف Vwf+ HSCs إلى S-G2-M النشط (الشكل XNUMX أ). 5b). علاوة على ذلك، حذف محدد ل ايل1ر1 في الجذام+ أدت الخلايا الكهروضوئية إلى تأخير صغير ولكن مهم في استعادة الصفائح الدموية بعد نضوب الصفائح الدموية (الشكل XNUMX أ). 5c).
(تتعلق بالشكل التكميلي XNUMX). 6). a-c تحليل الفئران مع الحذف المشروط ل ايل1ر1 في الجذام+ الخلايا المحيطة بالأوعية الدموية (ايل1ر1فلوريدا/فلوريدا الجذام-لجنة المساواة العرقيةتيراغرام/+) الفئران بعد نضوب الصفائح الدموية. تشمل الضوابط ايل1ر1فلوريدا/+ الجذام-لجنة المساواة العرقيةتيراغرام/+, ايل1ر1+ / + الجذام-لجنة المساواة العرقيةتيراغرام/+, ايل1ر1فلوريدا/فلوريدا الجذام-لجنة المساواة العرقيةتيراغرام/+ (IgG فقط) و الجذام-Cre+ / + الفئران. a تحليل دورة الخلية لـ Vwf+ و VWF- HSCs بعد يوم واحد من نفاد الصفائح الدموية. تمثل البيانات متوسط ترددات ± SD البالغة 1 (التحكم-IgG)، و3 (التحكم-GPIbα) و5 (ايل1ر1فلوريدا/فلوريدا الجذام-لجنة المساواة العرقيةتيراغرام/+-GPIbα) الفئران من 3 تجارب مستقلة. b تحليل دورة الخلية لـ Vwf+ و VWF- الخلايا الجذعية السرطانية من الفئران بعد يوم واحد من الحقن الوريدي بجرعة 1 ميكروجرام/كجم من IL-50β. البيانات تعني ± SD من 1 (التحكم-IgG)، 3 (التحكم-GPIbα) و6 (ايل1ر1فلوريدا/فلوريدا الجذام-لجنة المساواة العرقيةتيراغرام/+-GPIbα) الفئران من 3 تجارب مستقلة. c تحليل الدم المحيطي لاستعادة الصفائح الدموية في النقاط الزمنية المحددة بعد نضوب الصفائح الدموية. يعني ± أرقام الصفائح الدموية SD من 6 (التحكم) و 11 (ايل1ر1فلوريدا/فلوريدا الجذام-لجنة المساواة العرقيةتيراغرام/+) الفئران في 3 تجارب مستقلة. d-g تحليل التعبير الجيني التفاضلي في Vwf+ و فف- الخلايا الجذعية السرطانية المعزولة من الفئران من النوع البري بعد يوم واحد من استنفاد الصفائح الدموية (علاج GPIbα). d قطع بركانية من الجينات يتم التعبير عنها تفاضليًا في Vwf+ و فف- HSCs. تشير النقاط الحمراء إلى الجينات ذات الاختلافات الكبيرة في التعبير (المعدلة p القيمة (q)<0.05). e مخطط فين يوضح عدد الجينات المعبر عنها تفاضليًا في Vwf+ و فف- HSCs بعد استنفاد الصفائح الدموية وبين مجموعات HSC الفرعية هذه في التوازن (IgG). f تحليل مصطلحات GO للعمليات / المسارات البيولوجية التي يتم تنظيمها في Vwf+ HSCs بعد نضوب الصفائح الدموية. g تعبير (FPKM) للجينات المرتبطة بإشارات Activin / BMP في Vwf+ و فف- HSCs من وزن الفئران في التوازن ونضوب الصفائح الدموية بعد يوم واحد. كل المعلومات (d-g) تمثل بيانات ± SD FPKM المتوسطة لثلاث مكررات بيولوجية لكل التركيب الوراثي والحالة. *p <0.05 ؛ **p <0.01 ؛ ***p <0.001؛ نانوثانية غير هامة (p > 0.05)؛ باستخدام ANOVA ثنائي الاتجاه مع مقارنات Tukey المتعددة (a, b) ، تحليل التباين ثنائي الاتجاه مع مقارنات Sidak المتعددة (c) واختبار t على الوجهين (g). انظر أيضًا الشكل التكميلي. 5.
للحصول على مزيد من المعرفة حول كيفية استخدام Vwf+ يتم تجنيد الخلايا الجذعية السرطانية في التكاثر استجابةً لاستنفاد الصفائح الدموية الناجم عن مضاد GPIbα، وقد أجرينا تسلسل الحمض النووي الريبي (RNA) لـ Vwf+ و فف- HSCs. تسلسل الحمض النووي الريبي (RNA) لـ Vwf+ حددت HSCs 230 جينًا تم التعبير عنها تفاضليًا بعد استنفاد الصفائح الدموية، منها 170 تم التعبير عنها بشكل تفاضلي حصريًا في Vwf+ وليس VWF- HSCs، و 24 من هؤلاء Vwf المميزين بالفعل+ و فف- الخلايا الجذعية السرطانية في التوازن، بما في ذلك الجينات المرتبطة بنسب الصفائح الدموية/Mk (الشكل XNUMX أ). 5d ، هالشكل التكميلي 5 هـ ، ص والبيانات التكميلية 6, 7). مقارنة Vwf+ و فف- كشفت الخلايا الجذعية السرطانية من الفئران المستنفدة للصفائح الدموية عن إثراء جينات تنشيط دورة الخلية في Vwf+ HSCs، مما يؤكد على المستوى الجزيئي التنشيط التفضيلي لـ Vwf+ HSCs استجابة لنضوب الصفائح الدموية (الشكل التكميلي XNUMX). 5g والبيانات التكميلية 8). الجينات المعبر عنها تفاضليًا في Vwf+ ترتبط الخلايا الجذعية السرطانية بعد تنشيط الصفائح الدموية واستنفادها بشكل أساسي بإشارات الإنتغرين والتصاق الخلايا، المعروف أنه يتم تنظيمها بواسطة إشارات TGFβ39ولكن أيضًا دورة الخلية وتخثر الدم والاستجابة للإجهاد/الالتهاب (الشكل XNUMX). 5d – f). في حين أننا لا نستطيع استبعاد مشاركة مسارات الإشارات الأخرى في تنظيم هذه الجينات، وذلك تمشيا مع التنظيم السفلي للجينات. FST في خلايا CBM-PV (الشكل XNUMX أ). 4g) ، الجينات المستهدفة Activin / BMP المرشحة رونكس 3 و معرف 140 كانت على التوالي منخفضة ومرتفعة التنظيم في Vwf+ ولكن ليس VWF- HSCs بعد نضوب الصفائح الدموية (الشكل XNUMX أ). 5g). تجدر الإشارة إلى أن الجين الخاص بـ α1,6-fucosyltransferase (فوت8) الذي ينظم بشكل تفاضلي نشاط مستقبلات TGFβ و Activin41 وهو أيضًا منظم لإشارات الإنتغرين42 تم العثور عليه منظمًا على وجه التحديد في Vwf+ HSCs بعد نضوب الصفائح الدموية. بالإضافة إلى ذلك، ردًا على استنزاف الصفائح الدموية الناجم عن مضادات GPIbα Vwf+ HSCs ولكن ليس Vwf- HSCs خاضعة للتنظيم Fkbp1a، منظم داخل الخلايا لإشارات Smad الذي يعدل شدة ومدة الإشارات في اتجاه مجرى مستقبلات TGFβ وActivin وBMP43,44 (تين. 5g). جنبا إلى جنب مع أسفل التنظيم FST في خلايا CBM-PV (الشكل XNUMX أ). 4g) ، تشير هذه البيانات إلى أن التحول من إشارات TGFβ المعززة للهدوء إلى تنشيط إشارات Activin / BMP قد يؤدي إلى تغييرات في نشاط الإنتغرين والتصاق الخلايا وحالة دورة الخلية للخلايا الجذعية السرطانية استجابةً لتنشيط الصفائح الدموية الحادة ونضوبها.
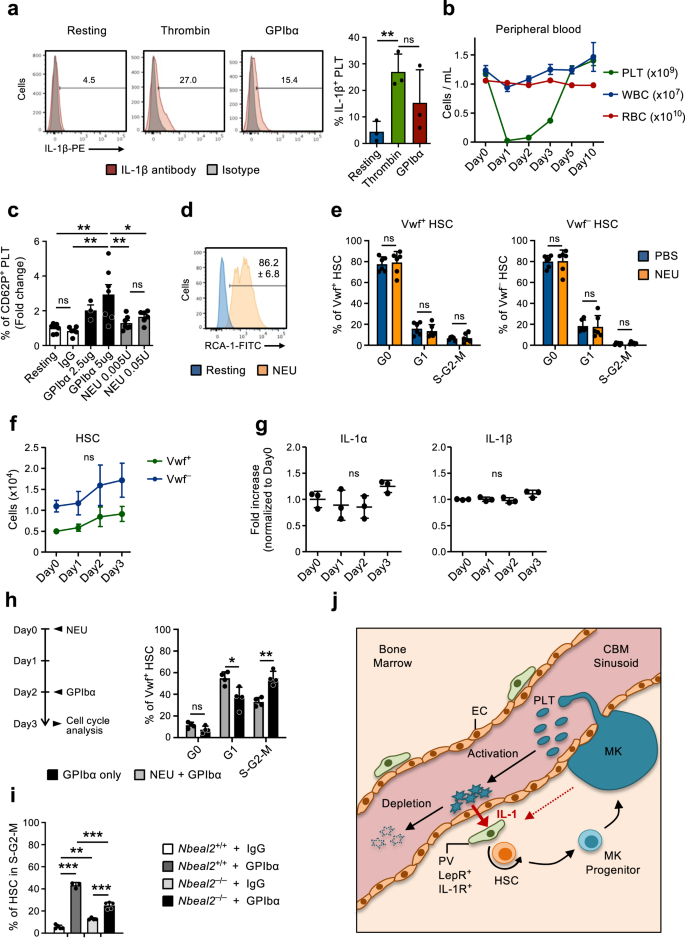
يعد تنشيط الصفائح الدموية ضروريًا لاستجابة HSC لنضوب الصفائح الدموية
كشف تحليل التعبير الجيني لـ CBM-ECs عن العديد من الجينات التي يتم تنظيمها عند استنفاد الصفائح الدموية المرتبطة بتنشيط الصفائح الدموية وتجلط الدم (الشكل XNUMX أ). 2 و ، ز). وهذا يتماشى مع الآلية التي يتم من خلالها استهلاك الصفائح الدموية بشكل متكرر45، يتم تقليده هنا من خلال استنفاد الصفائح الدموية بوساطة GPIbα، والذي يعمل عن طريق تحفيز تنشيط الصفائح الدموية المستقلة عن Fc، مما يؤدي إلى انتقال الصفائح الدموية سياليداز نيورامينيداز -1 (NEU) إلى الغشاء وإزالة التحلل والتصفية اللاحقة في الكبد20. علاوة على ذلك، يتم التعرف على الصفائح الدموية كوسيط مهم للالتهاب46,47 وتنظيم التعبير البروتيني IL-1 بسرعة عند التنشيط (الشكل XNUMX أ). 6a)، كما بينا سابقا من قبل آخرين48,49,50. يدعم هذا دورًا لتنشيط الصفائح الدموية والاستهلاك اللاحق في التوسط في التنشيط المعتمد على IL-1 لـ Vwf+ HSCs استجابة لنقص الصفيحات. لمزيد من التحقيق في هذا الاحتمال قمنا بمعاملة الفئران بـ NEU51، والذي يشبه علاج GPIbα (الشكل XNUMX أ). 1a) يؤدي إلى استنزاف الصفائح الدموية بشكل فعال (الشكل XNUMX أ). 6b) ولكن يتجاوز تنشيط الصفائح الدموية20. في حين أن علاج GPIbα ينشط الصفائح الدموية بكفاءة في المختبر، كما تم قياسه عن طريق تلطيخ P-Selectin السطحي (CD62P)، فإن علاج NEU في المختبر أدى فقط إلى تنشيط خفيف جدًا للصفائح الدموية، وفقط بتركيزات عالية (الشكل XNUMX أ). 6c). ومع ذلك، تم تأكيد نشاط NEU في المختبر بواسطة Ricinus communis وضع العلامات على الراصات I (RCA-1) (الشكل XNUMX أ). 6d) ، والذي يرتبط بشكل خاص بالبروتينات منزوعة السيليلات20. على الرغم من استنفاد الصفائح الدموية في الجسم الحي بنفس الكفاءة، على عكس العلاج المضاد لـ GPIbα، لم يؤد علاج NEU إلى تنشيط دورة الخلية HSC (الشكل XNUMX أ). 6e) كما أنها لم تؤدي إلى زيادة كبيرة في أعداد Vwf+ أو فولكس فاجن- HSCs (الشكل . 6f) ، LSK Flt3-CD48+CD150+ MPPs و pre-MegE و MkPs في BM (الشكل التكميلي SXNUMX). 6a ، ب). تجدر الإشارة إلى أنه في الفئران المعالجة بـ NEU ظلت مستويات IL-1α و IL-1β في BM دون تغيير إلى حد كبير (الشكل XNUMX أ). 6g). تشير هذه النتائج إلى أنه بدلاً من مجرد فقدان الصفائح الدموية، فإن استنزاف الصفائح الدموية الناجم عن تنشيط GPIbα متورط في التنشيط الملحوظ المعتمد على IL-1 للخلايا الجذعية السرطانية. أشارت الدراسات السابقة إلى دور Mks وعواملها المفرزة في تنظيم هدوء / انتشار HSC31,32,33,52. نظرًا لأن Mks يعبر أيضًا عن GPIbα، لتوضيح دور الصفائح الدموية بشكل أكثر تحديدًا في تنشيط HSC المرصود استجابةً لعلاج الأجسام المضادة لـ GPIbα، بشكل مستقل عن Mks، قمنا بإعطاء الجسم المضاد لـ GPIbα للفئران التي تم فيها استنفاد الصفائح الدموية بكفاءة باستخدام NEU - العلاج (الشكل . 6b) ، والذي لا يغير عدد أعضاء الكنيست33. أدى هذا العلاج المتسلسل NEU-GPIbα إلى تقليل تنشيط دورة الخلية لـ Vwf+ HSCs، عند مقارنتها بمعالجة GPIbα وحدها (الشكل XNUMX أ). 6h) مما يؤكد مشاركة الصفائح الدموية في هذه العملية. ومع ذلك، فقد لوحظت حقيقة أن بعض تنشيط HSC في الفئران ذات الصفائح الدموية المستنفدة لـ NEU، عند مقارنتها بفئران التحكم ذات أعداد الصفائح الدموية الطبيعية (الشكل XNUMX أ). 1d و 3e) ، يدعم أيضًا دور Mks في تنشيط HSC الملحوظ استجابةً لعلاج الأجسام المضادة لـ GPIbα.
(تتعلق بالشكل التكميلي XNUMX). 4). a التعبير عن IL-1β في استراحة الصفائح الدموية أو بعد التنشيط في المختبر (3 ساعات) باستخدام الثرومبين أو الجسم المضاد GPIbα. (يسار)، لمحات تمثيلية FACS. الأرقام في المؤامرات هي متوسط الترددات من 3 تجارب مستقلة. (يمين) تردد IL-1β+ الصفائح؛ يعني ± SD من 3 مكررات بيولوجية لكل حالة في 3 تجارب مستقلة. تتكون كل نسخة بيولوجية من صفائح دموية مجمعة من 2-3 فئران. b التحليل الحركي لسلالات خلايا الدم المحيطية التالية في إدارة النورامينيداز (NEU) في الجسم الحي. تمثل البيانات يعني ± SEM من 10 (Day0)، 7 (Day1)، 8 (Day2)، 9 (Day3)، 6 (Day5) و 3 (Day10) الفئران من 6 تجارب مستقلة. الصفائح الدموية PLT، خلايا الدم البيضاء WBC، خلايا الدم الحمراء RBC. c التعبير عن P-selectin السطحي (CD62P) على الصفائح الدموية المقاسة بواسطة قياس التدفق الخلوي بعد الحضانة في المختبر باستخدام الجسم المضاد GPIbα أو NEU، عند التركيزات المشار إليها. تمثل البيانات تغييرات أضعاف ± SD بنسبة٪ CD62P+ الخلايا في كل حالة فيما يتعلق بالصفائح الدموية (الراحة) غير المعالجة، 7 (الراحة)، 6 (IgG)، 3 (GPIbα-2,5ug)، 7 (GPIbα-5ug)، 7 (NEU 0.005U) و6 (NEU) 0.05U) الفئران في 3 تجارب مستقلة. d نشاط النورامينيداز في المختبر (NEU) في استراحة الصفائح الدموية أو بعد 30 دقيقة من العلاج باستخدام NEU، تم تحليله بواسطة ربط RCA-1. ملف تعريف تمثيلي من 1 من أصل 3 مكررات بيولوجية. تشير الأرقام إلى متوسط الصفائح الدموية ± SD % RCA-1+. e يعني ± SD توزيع مرحلة دورة الخلية من Vwf+ (يسار) وVwf- (يمين) HSCs بعد يوم واحد من استنفاد الصفائح الدموية مع NEU. بيانات من 1 فئران لكل حالة، في 6 تجارب مستقلة. f التقييم القائم على نظام مراقبة الأصول الميدانية لمقصورة HSC في نخاع العظم من الفئران في النقاط الزمنية المحددة بعد استنفاد الصفائح الدموية مع NEU. تمثل البيانات الأعداد المطلقة ل فولكس فاجن-GFP+ (فف+) أو فولكس فاجن-GFP- (فف-) HSCs (متوسط ±SEM) في النقاط الزمنية المشار إليها بعد نضوب الصفائح الدموية. البيانات مأخوذة من 5 (Day0)، 4 (Day1)، 5 (Day2) و 6 (Day3) الفئران في 4 تجارب مستقلة. لم يلاحظ أي تغيرات كبيرة في أعداد Vwf+ أو فولكس فاجن- HSCs في أي وقت. g متوسط مستويات ± SD (زيادة أضعاف بالنسبة إلى اليوم 0) من السيتوكينات المشار إليها في السائل خارج الخلية لنخاع العظم المعزول من الفئران في النقاط الزمنية المحددة بعد استنفاد الصفائح الدموية باستخدام النورامينيداز. بيانات من 3 فئران لكل نقطة زمنية في تجربتين مستقلتين. h عولجت الفئران بـ NEU في اليوم 0، تليها إدارة الجسم المضاد GPIbα في اليوم 2 وتم تحليلها في اليوم 3 (يسار) لتوزيع مرحلة دورة الخلية في Vwf.+ HSCs (يمين). عولجت الفئران الضابطة فقط بالأجسام المضادة GPIbα وتم تحليلها بعد يوم واحد. تمثل البيانات متوسط ترددات ± SD لأربعة فئران لكل مجموعة في تجربتين مستقلتين. i HSCs في S-G2-M في نبيل2- / - الفئران بعد يوم واحد من نضوب الصفائح الدموية (GPIbα). تمثل البيانات متوسط ترددات الخلايا SD البالغة 1 (Wt-IgG)، 5 (Wt-GPIbα)، 3 (نبيل2- / --IgG) و5 (نبيل2- / --GPIbα) الفئران لكل حالة من 3 تجارب مستقلة. j مخطط يصور آلية ردود الفعل المقترحة. أثناء استهلاك الصفائح الدموية المنشطة، تفرز IL-1، الذي ينشط IL-1R الذي يعبر عن الخلايا الكهروضوئية للحث على تكاثر HSC والتمايز نحو سلالة الصفائح الدموية. كما هو موضح، قد يساهم Mks أيضًا في التجنيد الموصوف للخلايا الجذعية السرطانية في الانتشار استجابةً للعلاج باستخدام الجسم المضاد لـ GPIbα مما يؤدي إلى استنفاد الصفائح الدموية المعتمد على التنشيط. لجميع البيانات ***p <0.001 ؛ **p <0.01 ؛ *p <0.05 (يشار إليه فقط في حالة وجود اختلافات كبيرة) باستخدام ANOVA أحادي الاتجاه مع مقارنات Tukey المتعددة (a, c, f, i) ، تحليل التباين ثنائي الاتجاه مع مقارنات Sidak المتعددة (e, h) أو مقارنات دونيت المتعددة (g); غير مهم. انظر أيضًا الشكل التكميلي. 6.
تقوم الصفائح الدموية بتخزين مُعدِّلات التهابية متعددة في حبيبات الصفائح الدموية، والتي يتم إطلاقها عند تنشيط الصفائح الدموية53,54. لمزيد من التحقيق فيما إذا كان إطلاق محتويات حبيبات الصفائح الدموية مطلوبًا لتنشيط HSC بوساطة GPIbα قمنا بتحفيز استنفاد الصفائح الدموية (علاج GPIbα) في الفئران الناقصة لـ نبيل2 (نبيل2-/-)، التي تفتقر إلى حبيبات الصفائح الدموية55. نبيل2-/- تتمتع الفئران بتكوين دم طبيعي بشكل عام على الرغم من الانخفاض الطفيف في أعداد الصفائح الدموية وزيادة طفيفة في الخلايا الجذعية السرطانية (الشكل التكميلي SXNUMX). 6 ج – هـ). يوم واحد بعد العلاج المضاد لـ GPIbα نبيل2-/- كان لدى الفئران انخفاض ملحوظ في تكرار الخلايا الجذعية السرطانية لركوب الدراجات بشكل نشط مقارنةً بالفئران بالوزن ، على الرغم من وجود تردد أعلى للخلايا الجذعية السرطانية في الدورة قبل العلاج (الشكل XNUMXA). 6i). تشير هذه النتائج معًا إلى أن IL-1 والمنظمين الآخرين الذين يتم إفرازهم عند تنشيط الصفائح الدموية قد يلعبون دورًا في تنظيم تنشيط الخلايا الجذعية السرطانية استجابةً لنقص الصفيحات.
- محتوى مدعوم من تحسين محركات البحث وتوزيع العلاقات العامة. تضخيم اليوم.
- PlatoData.Network Vertical Generative Ai. تمكين نفسك. الوصول هنا.
- أفلاطونايستريم. ذكاء Web3. تضخيم المعرفة. الوصول هنا.
- أفلاطون كربون، كلينتك ، الطاقة، بيئة، شمسي، إدارة المخلفات. الوصول هنا.
- أفلاطون هيلث. التكنولوجيا الحيوية وذكاء التجارب السريرية. الوصول هنا.
- المصدر https://www.nature.com/articles/s41467-023-41691-y