الجسيمات الدقيقة F16BP موجودة في نطاق قابل للبلعمة
لإثبات قوة مثل هذه الإستراتيجية، تم اختيار PFK15 (كتل −6-Phosphofructo-2-Kinase Fructose-2,6،3-Biphosphatase 3-PFKFBXNUMX) لمنع تحلل السكر، حيث إنها إحدى خطوات الحد من المعدل في تحلل السكر.20. علاوة على ذلك، تم اختيار الفركتوز-1,6،16-ثنائي الفوسفات (F3BP)، الذي يتم توليده بواسطة الفوسفوفركتوكيناز (PFK) والذي يمثل خطوة أسفل PFKFBXNUMX ليكون مستقلبًا لتوليد جزيئات قابلة للبلعمة.21. تم إنشاء الجسيمات الدقيقة المعتمدة على F16BP باستخدام كيمياء فوسفات الكالسيوم. أظهر تشتت الضوء الديناميكي أن حجم هذه الجزيئات كان 2.3 ± 0.4 ميكرومتر (الشكل XNUMX أ). 1b) وأظهر مسح الصور المجهرية الإلكترونية أن هذه الجزيئات لها شكل كروي سلس (الشكل XNUMX أ). 1c). باستخدام رسم خرائط الرنين المغناطيسي النووي 1H وEDX، تم تحديد أن F16BP تم دمجه داخل هذه الجسيمات الدقيقة (الشكل XNUMX أ). 1c؛ س1) وكانت الجزيئات 2 ± 0.14 من نسبة الكالسيوم إلى الفوسفور (Ca: P) (الشكل XNUMX أ). 1c).
يتم بلعمة الجسيمات الدقيقة F16BP بواسطة البلدان النامية
لاختبار ما إذا كان بإمكان أعضاء البرلمان F16BP إطلاق F16BP، تم إجراء حركية الإطلاق في محلول ملحي بالفوسفات. وقد لوحظ أن النواب F16BP يمكنهم إطلاق F16BP لمدة 6 ساعات بطريقة مستدامة (الشكل XNUMX أ). S2). أظهرت هذه البيانات أن النواب الذين تم إنشاؤهم يحتويون على F16BP، وهم في نطاق البلدان النامية القابلة للبلعمة ويمكنهم إطلاق F16BP للسماح بتحلل السكر بالمضي قدمًا. بالإضافة إلى F16BP، تم أيضًا إنشاء جزيئات مستقلبات التحكم الأخرى مثل فوسفات الريبولوز 5 (R5P)، وحمض الفوسفونولبيروفيك (PEP)، وفوسفات الفركتوز 6 (F6P) (الشكل XNUMX أ). S3). في هذه الدراسة، تم اختيار برنامج تلفزيوني لتقليد الظروف الفسيولوجية للفوسفات في الجسم الحي، وتم تحديد إطلاق F16BP في هذه الوسيلة22. علاوة على ذلك، نظرًا لأنه من المتوقع أن تظل البلدان النامية المنشَّطة على قيد الحياة لمدة 1-3 أيام في الجسم الحي عند البلعمة، فإن النشاط قصير المدى أو استقرار أعضاء البرلمان F16BP أمر مرغوب فيه23.
لاختبار ما إذا كان يمكن بلعمة هذه الجسيمات بواسطة البلدان النامية، تم إجراء التصوير متحد البؤر. على وجه التحديد، تم إنشاء F16BP MPs مع FITC مقحم داخل الجزيئات. ثم تم تحضين البلدان النامية المشتقة من النخاع العظمي مع هذه الجزيئات لمدة 60 دقيقة، وملطخة بالأكتين والنوى، وتم إجراء التصوير الفلوريسنت. تم استخدام Cytochalasin D بحضور F16BP-FITC MP كعنصر تحكم. وقد لوحظ أن البلدان النامية كانت قادرة على الارتباط بالجزيئات بشكل فعال، وأظهرت الشرائح متحد البؤر في الاتجاه z أن الجزيئات تم استيعابها (الشكل XNUMX أ). S4).
تنقذ الجسيمات الدقيقة F16BP تحلل السكر في البلدان النامية في المختبر
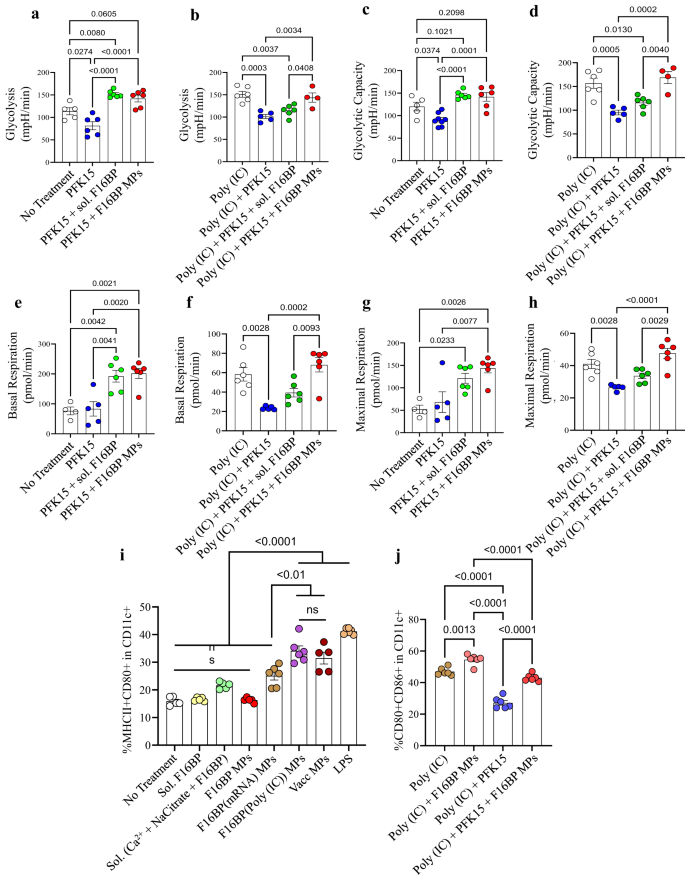
بعد ذلك، تم اختبار قدرة النواب F16BP على إنقاذ تحلل السكر في البلدان النامية في وجود مثبط حال السكر PFK15 باستخدام فحوصات التدفق خارج الخلية. تمت زراعة البلدان النامية إما باستخدام PFK15 أو F16BP MPs أو الفركتوز 6-فوسفات القابل للذوبان (F6P-upstream من PFKFB3) أو PFK15 + F16BP MPs أو المكونات الفردية لـ F16BP MPs لمدة ساعتين ومعدل التحمض خارج الخلية (ECAR - معدل تم الحصول على قياسات تحلل السكر. وقد لوحظ أن PFK2 جلب تحلل السكر والقدرة على تحلل السكر (y-محور ECAR) أقل من التحكم في عدم العلاج (الشكل XNUMX أ). 2 أ - د؛ س5). الأهم من ذلك أن تحلل السكر وقدرة تحلل السكر كانا أعلى بكثير في F16BP MPs حتى في وجود PFK15، مقارنةً بالتحكم PFK15 وحده (الشكل XNUMX أ). 2 أ - د). أيضًا، في وجود poly(IC) (عامل تنشيط للـ DC)24، قلل PFK15 من تحلل السكر وقدرة تحلل السكر، وتمكن أعضاء البرلمان F16BP من إنقاذ هذا النقصان حتى في وجود PFK15 (الشكل XNUMX أ). 2e – h). بشكل عام، تشير هذه البيانات إلى أن نواب F16BP القابلة للبلعمة كانت قادرة على إنقاذ تحلل السكر في البلدان النامية حتى في وجود مثبط تحلل السكر PFK15، وبالتالي يمكن استخدامها في العلاجات المناعية حيث يتم استهداف مسار تحلل السكر في الخلايا السرطانية. هذا أمر مهم لأنه في ظل ظروف الالتهاب، تحتاج البلدان النامية إلى أداء مستويات معززة من تحلل السكر لدعم إنتاج البروتين الالتهابي11,25.
a-d أنقذت البلدان النامية المعالجة بـ F16BP MPs تحلل السكر وقدرة تحلل السكر من تثبيط تحلل السكر (PFK15)، في المختبر (ن = 6؛ اختبار ANOVA Tukey أحادي الاتجاه)، e-h تعمل البلدان النامية المعالجة بـ F16BP MPs على تسريع التنفس القاعدي والحد الأقصى حتى في ظل تثبيط تحلل السكر (PFK15) ، في المختبر (n = 6؛ اختبار أنوفا توكي أحادي الاتجاه). i تسببت جزيئات اللقاح في حدوث تردد أعلى بكثير لـ MHCII + CD86 + في CD11c + DC مقارنةً بعناصر التحكم في المكونات الفردية في MPs (n = 6؛ اختبار أنوفا توكي أحادي الاتجاه). j تمكن نواب F16BP من إنقاذ تنشيط DC حتى في وجود PFK15 (PFK15 conc. = 25 ميكرومتر) (n = 6؛ اختبار أنوفا توكي أحادي الاتجاه). البيانات ممثلة كخطأ متوسط ± std.
تنقذ الجسيمات الدقيقة F16BP تنشيط البلدان النامية في المختبر
لاختبار ما إذا كان بإمكان F16BP MPs تعديل وظيفة البلدان النامية، تمت صياغة لقاح F16BP MPs القائم على mRNA والقائم على الببتيد. تم إنشاء هذه اللقاحات عن طريق إقحام مستضد الببتيد الميلانيني ثنائي الفسفرة والبروتين المرتبط بالتيروزين 2 (pTRP2) والبولي (IC) والرنا المرسال المستمدة من خلايا سرطان الجلد، والتي تحتوي على عدة مجموعات فوسفات في العمود الفقري لها (الشكل XNUMX أ). S6). نظرًا لأن pTRP2p وpoly(IC) لديهما مجموعات فوسفات، يمكن دمج هذه الجزيئات في MPs F16BP باستخدام كيمياء فوسفات الكالسيوم. تم تحديد كمية pTRp2 وpoly(IC) المدمجة داخل F16BP MPs لتكون 78 ± 3.4 و50.9 ± 7.9 ميكروغرام، على التوالي. بعد ذلك، تم تحضين F16BP MPs المقحمة مع بولي (IC) وpTRP2 مع وحدات تحكم المجال DC طوال الليل، وتم استخدام قياس التدفق الخلوي لاختبار ما إذا كانت هذه الجزيئات يمكنها تنشيط وحدات تحكم المجال DC (الشكل XNUMX أ). 2 ط ، ي). وقد لوحظ أن جزيئات اللقاح تسببت في تردد أعلى بكثير لـ MHCII + CD86 + في CD11c + DC مقارنة بعناصر التحكم في المكونات الفردية للنواب (الشكل XNUMX أ). 2i). بالإضافة إلى ذلك، لوحظ أن PFK15 كان قادرًا على تقليل تنشيط وحدات تحكم المجال DC (CD80 + CD86+ في CD11c + ) حتى في وجود poly(IC)، وكانت نواب F16BP قادرة على إنقاذ تنشيط وحدات تحكم المجال DC حتى في وجود PFK15 (تين. 2j). أيضًا ، لم تؤد أيونات الكالسيوم عند التركيز التي تمت إضافتها إلى وحدات تحكم المجال DC مثل F16BP MPs إلى تغييرات في ملف التنشيط (MHCII + CD80 + في CD11c + ) لملف تعريف وحدات تحكم المجال DC (الشكل XNUMX أ). S5). تشير هذه البيانات إلى أن نواب اللقاح المعتمد على F16BP ينقذون تنشيط DC حتى في وجود PFK15، وهو أمر مهم إذا كانت هناك حاجة إلى إنشاء استجابات لقاح سرطان الجسم الحي في وجود تثبيط تحلل السكر.
لمزيد من التحليل إذا كانت البلدان النامية المعالجة بتركيبات F16BP MP تعدل استجابات الخلايا التائية، تم إجراء تفاعل الخلايا الليمفاوية المختلطة (MLR). تم علاج البلدان النامية المشتقة من النخاع العظمي C57BL / 6j بظروف مختلفة (الشكل XNUMX أ). S7) لمدة ساعتين ثم تم تربيتها بخلايا T معزولة عن الفئران C2BL/57j لمدة 6 ساعة. تم بعد ذلك تلوين الخلايا ضد CD60 وCD4 وCD8 وTbet وRORɣT وGATA44 وCD3 وFoxp25، وتم تحليلها باستخدام قياس التدفق الخلوي. وقد لوحظ أن F3BP MPs وF16BP (pTRP16) وF2BP (poly (IC) وF16BP (pTRP16 + poly (IC)) وPFK2 + F15BP MPs وPFK16 + F15BP (pTRP16 + poly (IC)) جميعها منظمة بشكل كبير تردد خلايا Th2 المنشَّطة، وTh1 المنشَّطة، وخلايا Tc17 المنشَّطة، مع تقليل تنظيم تردد Th1، وTregs، وTh2 المنشَّط في نفس الوقت (الشكل 2 أ). S7). ومن المثير للاهتمام أنه لوحظ أن علاج البلدان النامية باستخدام النواب F16BP أدى إلى أكبر التغييرات في استقطاب الخلايا التائية وتنشيطها. كان هذا التغيير الملحوظ حتى في وجود بولي مساعد (IC) أو مستضد pTRP2. علاوة على ذلك، تسبب F16BP القابل للذوبان ومكوناته المضافة إلى وحدات تحكم المجال DC في حدوث تردد أقل بكثير من Th1 وTc1 وTh17 المنشط مقارنةً بـ F16BP MPs في جميع المجموعات الممكنة. تشير هذه البيانات إلى أن وجود الجزيئات كان مهمًا لتحريف ترددات الخلايا التائية المؤيدة للالتهابات في تفاعل MLR.
تولد لقاحات F16BP مع مثبطات تحلل السكر استجابات قوية مضادة للورم
لاختبار ما إذا كان نهج تعديل الأيض المناعي لإنقاذ تحلل السكر في وجود مثبطات تحلل السكر وتوليد علاجات مناعية لقاح السرطان، تم اختيار أشكال عدوانية للغاية من نماذج سرطان الجلد الماوس. على وجه التحديد، تم حقن MPs اللقاح تحت الجلد في الفئران التي تحتوي على YUMM1.1 (فئران BRAFv600e تم اختبار أورام سرطان الجلد، وقدرتها على تقليل نمو الورم وتعديل الاستجابات المناعية الفطرية والتكيفية.
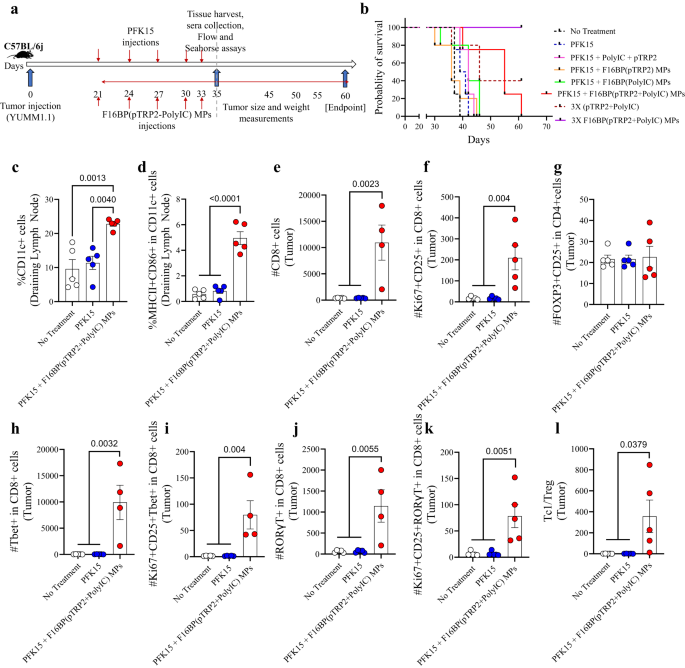
في نموذج سرطان الجلد هذا، 0.75 × 106 تم حقن خلايا YUMM1.1 تحت الجلد في الفئران ذات الكفاءة المناعية C57BL/6j، وتم حقن PFK15 كل يوم بديل طوال مدة الدراسة. علاوة على ذلك، تم حقن F16BP(pTRP2+poly(IC)) تحت الجلد في نفس أيام حقن PFK15 (الشكل XNUMX أ). 3a). في المختبر تم تحديد أن PFK15 كان فعالاً في منع تكاثر الخلايا السرطانية YUMM1.1 (الشكل XNUMX أ). S8). وقد لوحظ أن مجموعة العلاج من لقاح PFK15 + MPs أدت إلى زيادة كبيرة في بقاء الفئران (اليوم 60 - نقطة النهاية) ونمو أبطأ للورم مقارنة بجميع عناصر التحكم المختلفة (الشكل XNUMX أ). 3b؛ س9). ارتبطت هذه الزيادة في البقاء على قيد الحياة في لقاح MPs مع زيادة في عدد سكان DC وتنشيط سكان DC في الغدد الليمفاوية الإربية التصريفية في اليوم 35 ، مما يشير إلى أن MPs في اللقاح كانوا قادرين على تعديل الاستجابات المناعية الفطرية (الشكل XNUMX أ). 3c ، د). كان F16BP ضروريًا في توليد استجابات مضادة للورم في الفئران نظرًا لأنه بدون F16BP لم تتمكن الفئران من البقاء على قيد الحياة بعد اليوم 45. علاوة على ذلك، تمكنت 3 أضعاف جرعة F16BP (pTPR2 + poly IC) MPs بدون PFK15 من إلغاء الأورام الموجودة، والتي لم يتم اكتشافها حتى اليوم 60 (الشكل . 3b؛ س9). بالإضافة إلى ذلك، وجد أيضًا أن poly(IC) وpTRP2 بحاجة إلى دمجهما ضمن F16BP MPs، وحقن F16BP MPs مع القابل للذوبان (poly(IC) + pTRP2)، لم يقلل من نمو الورم في الفئران (الشكل XNUMX أ). S9). قد يؤدي F16BP MPs في حد ذاته إلى تسريع تحلل السكر في الخلايا المختلفة في الفئران، كما لوحظ في المختبر في البلدان النامية. قد يؤدي هذا التسارع في تحلل السكر إلى انحراف الاستجابة المناعية نحو الاستجابات المضادة للورم. ومع ذلك، لم يتم اختبار عنصر التحكم هذا في الفئران وهو قيد على هذه الدراسة. داخل الورم، لم يلاحظ أي فروق ذات دلالة إحصائية في عدد خلايا CD4 + T من مجموعات العلاج المختلفة؛ ومع ذلك، كانت هناك زيادة كبيرة في خلايا CD4 + المتكاثرة والمنشطة في الفئران التي عولجت بلقاح MPs مقارنة بمجموعات العلاج الأخرى (الشكل XNUMX أ). S10أ). علاوة على ذلك، لم تلاحظ فروق ذات دلالة إحصائية في عدد خلايا T-helper 1 (Th1) وخلايا Th1 المنشطة والمتكاثرة؛ وقد لوحظت زيادة كبيرة في نوع T-helper 17 (Th17) وخلايا Th17 المنشطة والمتكاثرة في الفئران التي عولجت بلقاح MPs مقارنة بمجموعات العلاج الأخرى (الشكل XNUMXA). S10أ). ولوحظ أيضًا أنه عندما عولجت الفئران بـ PFK15 ومع pTRP2 القابل للذوبان والبولي القابل للذوبان (IC) بدون F16BP، أدى ذلك إلى زيادة مستويات البلدان النامية المنشَّطة، مقارنةً بالتحكم غير المعالج، ومع ذلك، لم يتم تعديل البلدان النامية في مناطق أخرى. الأعضاء (الشكل . S10b). علاوة على ذلك، بدون F16BP، لم تعدل التركيبة استجابات الخلايا التائية المؤيدة للالتهابات مقارنةً بالتحكم في عدم العلاج (الشكل XNUMX أ). S10c). تشير هذه البيانات إلى أن F16BP كان مطلوبًا في التركيبة لتوليد استجابات الخلايا التائية المؤيدة للالتهابات. علاوة على ذلك، داخل الورم، كانت هناك زيادة كبيرة في عدد خلايا CD8 + T وخلايا CD8 + T المتكاثرة والمنشطة في الفئران المعالجة باللقاح MPs مقارنة بمجموعات العلاج الأخرى مما يشير إلى انخفاض حركية نمو الورم في الفئران المعالجة باللقاح. استجابات نواب اللقاح (الشكل XNUMX). 3 هـ ، ص). لم يلاحظ أي فروق ذات دلالة إحصائية في الخلايا التائية التنظيمية في مجموعات العلاج المختلفة (الشكل XNUMXA). 3g). بالإضافة إلى ذلك، كانت هناك زيادة كبيرة في عدد Tc1 وTc17 وخلايا Tc1 وTc17 المتكاثرة والمنشطة في الفئران التي عولجت بلقاح MPs مقارنة بمجموعات العلاج الأخرى (الشكل XNUMX أ). 3 ساعات – ك). أيضًا ، لوحظت زيادة كبيرة في نسبة Tc1 / Treg في الفئران التي عولجت بلقاح MPs مقارنة بمجموعات العلاج الأخرى (الشكل XNUMXA). 3l). توضح هذه البيانات أن نواب اللقاح كانوا قادرين على توليد استجابات مناعية تكيفية قوية مؤيدة للالتهابات في الورم.
a تمثيل تخطيطي للحقن تحت الجلد لأعضاء Vacc MP، في الجسم الحي، b يُظهر منحنى كابلان-مئير معدل بقاء أعلى بكثير للفئران التي عولجت بـ Vacc MPs، c, d كان لدى الفئران التي عولجت بـ Vacc MPs نسبة أعلى بكثير من إجمالي البلدان النامية وكذلك تنشيطها في الليمفاوية المستنزفة (n = 5؛ اختبار أنوفا توكي أحادي الاتجاه)، e, f كان لدى الفئران التي عولجت بـ Vacc MPs عدد أكبر بكثير من Tc و Tc المنشط والمتكاثر مقارنة بمجموعات العلاج الأخرى (n = 4 أو 5؛ اختبار أنوفا توكي أحادي الاتجاه)، g لم يلاحظ أي فروق ذات دلالة إحصائية في عدد Tregs عبر مجموعات العلاج (n = 5؛ اختبار أنوفا توكي أحادي الاتجاه)، h-k كان لدى الفئران التي عولجت بـ Vacc MPs عدد أكبر بكثير من خلايا Tc وTc1 وخلايا Tc1 وTc17 المنشطة والمتكاثرة (n = 4؛ اختبار أنوفا توكي أحادي الاتجاه)، l وقد لوحظت نسبة Tc1/Treg أعلى بشكل ملحوظ في الفئران التي عولجت بـ Vacc MPs مقارنة بمجموعات التحكم (n = 4؛ اختبار أنوفا توكي أحادي الاتجاه). البيانات ممثلة كخطأ متوسط ± std.
تحافظ لقاحات F16BP على وظيفة التمثيل الغذائي للخلايا DC والخلايا التائية في الجسم الحي
لاختبار ما إذا كانت الخلايا DC أو الخلايا التائية تحافظ على وظيفتها الأيضية بعد العلاج، تم القتل الرحيم للفئران المصابة بالأورام وتم عزل الخلايا من الأورام والطحال والـ LNs الأربية. تم بعد ذلك زراعة هذه الخلايا باستخدام 2NBDG وتم استخدام التدفق لتحديد امتصاص 2NBDG الذي يمثل مستوى تحلل السكر. وقد لوحظ أنه في الورم، كان gMFI لـ 2NBDG في CD80 + DCs والبلاعم أعلى بكثير في PFK15 + F16BP (polyIC) MPs مقارنةً بحالة PFK15 الوحيدة، ومع ذلك، لم تكن هذه مختلفة بشكل كبير عن التحكم بدون علاج (الشكل XNUMX أ). S11a – ز). في الطحال ، كان gMFI لـ 2NBDG في البلدان النامية ، و CD80 + DC ، ولكن ليس في CD206 + DC أعلى بكثير في الفئران المعالجة بـ PFK15 + F16BP (polyIC) مقارنة بجميع عناصر التحكم (الشكل XNUMX أ). S11h – ي). تم عكس هذه الاتجاهات في البلاعم المعزولة من الطحال لدى الفئران المعالجة بـ PFK15 + F16BP (polyIC) مقارنة بجميع عناصر التحكم (الشكل XNUMXA). S11k – م). تشير هذه البيانات إلى أن النواب يعدلون بشكل منهجي تحلل السكر في البلدان النامية والبلاعم. في LNs الأربية ، تم أيضًا تنظيم gMFI لـ 2NBDG في CD80 + DCs المنشَّطة و CD206 + DCs (الشكل XNUMX أ). S11n-s). وهكذا أظهر اختبار 2NBDG أن تحلل الجلوكوز في DC والبلاعم لا يزال موجودًا في الورم والطحال وفي تصريف LNs الإربي. تم إجراء دراسة مماثلة على الخلايا التائية التكيفية لفهم مرونة تحلل السكر في هذه الخلايا. على وجه الخصوص، لوحظ أن خلايا CD45 المعزولة من الورم لديها 2NBDG gMFI أقل بشكل ملحوظ في PFK15، وPFK15 + F16BP القابل للذوبان + بولي (IC) القابل للذوبان، وPFK15 + F16BP (polyIC) الفئران المعالجة مقارنة بالتحكم في عدم العلاج. (تين. S12أ). تشير هذه البيانات إلى أن النواب أو الأجزاء القابلة للذوبان من النواب لم تكن قادرة على تعديل تحلل السكر في الخلايا غير المناعية بشكل كبير أو أن هذه الخلايا لديها مستوى أعلى من اللدونة الأيضية مقارنة بالخلايا المناعية. علاوة على ذلك، لم يكن gMFI لـ 2NBDG في الخلايا التائية المساعدة في الورم مختلفًا بشكل كبير في أعضاء البرلمان PFK15 + F16BP (polyIC) مقارنةً بالتحكم في عدم العلاج، وكان هذان الشرطان أعلى بكثير من عناصر التحكم الأخرى (الشكل XNUMX أ). S12b). لم يكن gMFI لـ 2NBDG في خلايا CD8 + T في الورم مختلفًا بشكل كبير في PFK15 + F16BP (polyIC) MPs مقارنةً بالتحكم في عدم العلاج (الشكل XNUMXA). S12c) ، ولكنها كانت أعلى من حالة PFK15 + F16BP القابلة للذوبان + حالة بولي (IC) القابلة للذوبان. في الطحال، لم تكن هناك فروق ذات دلالة إحصائية في خلايا CD4 + T، ومع ذلك، كانت خلايا CD8 + T تحتوي على 2NBDG gMFI أعلى مقارنةً بعناصر التحكم في الفئران المعالجة بـ PFK15 + F16BP (polyIC) MPs، ولكنها لا تختلف عن التحكم بدون علاج (تين. S12d، ه). أيضًا ، في الغدد الليمفاوية الأربية ، خفضت الفئران المعالجة بـ PFK15 + F16BP (polyIC) الفئران 2NBDG gMFI مقارنةً بالتحكم في عدم العلاج (الشكل XNUMXA). S12f ، ز). يشير اختبار 2NBDG للخلايا التائية إلى أن كلاً من خلايا CD4+ وCD8+ T في الورم تحافظ على تحلل السكر حتى بعد زراعة الجسم الحي، وبالتالي قد تدعم الاستجابات المضادة للورم في الجسم الحي. بشكل عام، أظهرت هذه البيانات أن لقاحات MP التي تقدم F16BP ويمكنها إنقاذ البلدان النامية كانت قادرة على توليد استجابات مناعية قوية ضد الشكل العدواني لأورام سرطان الجلد.
ينقذ F16BP عملية التمثيل الغذائي للتيار المستمر المنقولة بالتبني في الفئران
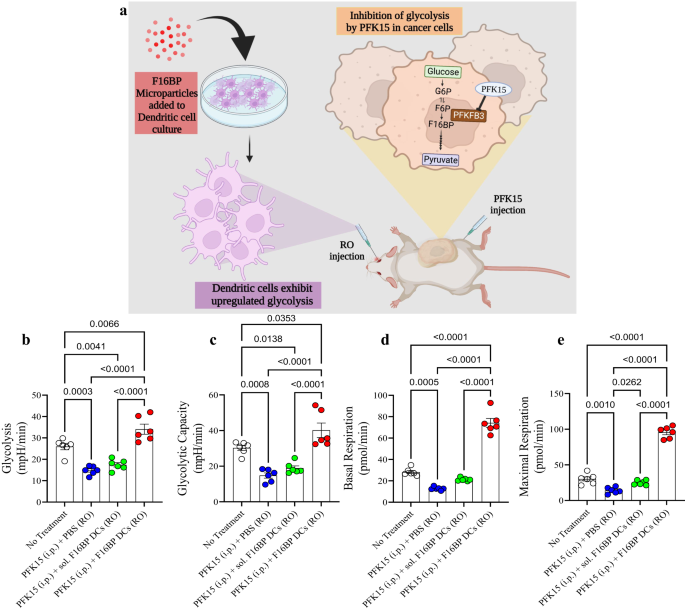
بالإضافة إلى استراتيجية اللقاح تحت الجلد، تم اختبار النقل بالتبني للخلايا الجذعية في العيادات لعلاج سرطان البروستاتا26,27,28. ومع ذلك، لم تكن هذه الاستراتيجيات ناجحة جدًا في العيادات، ويرجع ذلك جزئيًا إلى فعاليتها المنخفضة في تحسين البقاء على قيد الحياة. لاختبار مدى تعدد استخدامات نظام F16BP-PFK15، تم اختيار نموذج سرطان الجلد B16F10 عدواني آخر وتم تحميل قدرة النقل بالتبني للـ DC مع النواب كطريقة علاج (الشكل XNUMX أ). 4a). في هذا النموذج، تم تحميل البلدان النامية بـ F16BP MPs مقحمة مع mRNA المعزول من الخلايا السرطانية B16F10، والبولي (IC) (Vacc DC) وتم نقلها بالتبني في الفئران التي تحتوي على أورام B16F10. تم قياس قدرة هذا العلاج الخلوي على تعديل الاستجابات المناعية التكيفية، وتقليل نمو الورم وتحسين البقاء على قيد الحياة.
a التمثيل التخطيطي لنموذج العلاج الخلوي بالتبني المستخدم. b, c تمكنت الفئران التي تم حقنها باستخدام وحدات تحكم المجال DC المنقولة بالتبني جنبًا إلى جنب مع F16BP MPs من إنقاذ تحلل السكر وقدرة تحلل السكر من تثبيط تحلل السكر (PFK15) في الجسم الحي (n = 6؛ اختبار أنوفا توكي أحادي الاتجاه)، d, e تم حقن الفئران باستخدام وحدات تحكم المجال DC المنقولة بالتبني جنبًا إلى جنب مع F16BP MPs لتسريع التنفس الأساسي والحد الأقصى حتى في ظل تثبيط تحلل السكر (PFK15) ، في الجسم الحي (n = 6؛ اختبار أنوفا توكي أحادي الاتجاه). البيانات ممثلة كخطأ متوسط ± std.
أولاً، لاختبار ما إذا كان بإمكان أعضاء البرلمان F16BP (بدون بولي (IC) أو mRNA) إنقاذ البلدان النامية في الجسم الحي، تم تحميل أعضاء البرلمان F16BP في البلدان النامية عن طريق احتضان هذه الجزيئات مع البلدان النامية لمدة ساعتين. بعد ذلك، تم نقل هذه البلدان النامية بالتبني عن طريق الوريد في الفئران وتم حقن PFK2 داخل الصفاق. تم عزل البلدان النامية عن الطحال وأجريت فحوصات التدفق خارج الخلية على هذه الخلايا. من المتوقع أن تكون هذه البلدان النامية المعزولة من الطحال عبارة عن مزيج من كل من البلدان النامية الطحالية الذاتية والبلدان النامية المنقولة بالتبني. وقد لوحظ أن أعضاء البرلمان F15BP كانوا قادرين على إنقاذ تحلل السكر وقدرة تحلل السكر في البلدان النامية كما لوحظ من خلال قيم ECAR المتزايدة في وجود PFK16 مقارنة بعناصر التحكم (الشكل 15 أ). 4b ، ج). علاوة على ذلك، تمكن النواب F16BP أيضًا من إنقاذ التنفس القاعدي والحد الأقصى للوحدات DC في وجود PFK15، مقارنةً بعناصر التحكم (الشكل XNUMX أ). 4d ، ه). أظهرت هذه البيانات أن هذه الجسيمات لا يمكنها إنقاذ تحلل السكر وتنفس الميتوكوندريا في هذه الخلايا في المختبر فحسب، بل أيضًا في الجسم الحي، وبالتالي قد تكون قادرة على توليد استجابات علاجية مناعية وظيفية.
الإنقاذ الأيضي للبلدان النامية يولد علاجًا مناعيًا قويًا للخلايا بالتبني
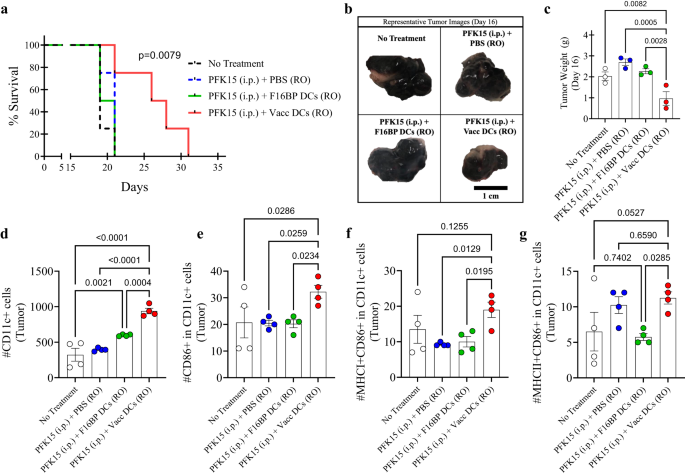
لاختبار ما إذا كان من الممكن تطبيق الإنقاذ الأيضي في البلدان النامية على العلاج بالخلايا بالتبني، تم اختبار النقل بالتبني للقاحات DC في الفئران (الشكل XNUMX أ). S13). أولاً، في المختبر، تم تحديد أن PFK15 كان فعالاً في منع تكاثر الخلايا السرطانية B16F10 (الشكل XNUMX أ). S14). على وجه التحديد، 0.75 × 106 تم حقن خلايا B16F10 في الفئران ذات الكفاءة المناعية C57BL/6j، وتم حقن PFK15 كل يوم بديل طوال مدة الدراسة (الشكل XNUMX أ). S13). علاوة على ذلك ، تم نقل وحدات تحكم المجال DC السابقة المحملة بـ F16BP (mRNA + poly (IC)) (Vacc DC) أو وحدات تحكم المجال DC المحملة بـ F16BP MPs بالتبني باستخدام الحقن المداري الرجعي (RO) في اليومين 6 و 19 (الشكل XNUMX ب). S13). وقد لوحظ أن بقاء الفئران التي تلقت لقاح DC + PFK15 زاد بشكل كبير مقارنة بجميع عناصر التحكم، ونما الورم بشكل أبطأ في الفئران التي تلقت لقاح DC مقارنة بعناصر التحكم (الشكل XNUMX أ). 5a؛ س15). تم دعم هذه البيانات بشكل أكبر من خلال أوزان الورم والصور التي تم الحصول عليها في نصف نقطة الدراسة في اليوم 16 (الشكل XNUMX أ). 5b ، ج). تشير هذه البيانات إلى أنه بعد حقنتين فقط من اللقاحات DC، كانت هناك استجابة قوية ضد الورم، مما أدى بعد ذلك إلى تقليل نمو الورم في الفئران.
a يُظهر منحنى كابلان-مئير بقاءً أعلى بكثير للفئران التي عولجت بأعضاء لقاح Vacc المنقولة بالتبني (n = 10 ، p <0.001) ، b صور الورم التمثيلية لمجموعات العلاج المختلفة في اليوم 16. c كان لدى الفئران التي عولجت باللقاحات DC المنقولة بالتبني أوزان أقل بكثير للورم مقارنة بمجموعات العلاج الأخرى، في الجسم الحي (n = 3؛ اختبار أنوفا توكي أحادي الاتجاه). d, e وقد لوحظ وجود إجمالي أعلى بشكل ملحوظ، وكذلك DCs المنشطة، في الفئران التي عولجت بـ Vacc DCs المنقولة بالتبني مقارنة بمجموعات العلاج الأخرى، في الجسم الحي (n = 4؛ اختبار أنوفا توكي أحادي الاتجاه). f وقد لوحظت مستويات أعلى بكثير من MHCI + DCs المنشطة في الفئران التي عولجت بـ Vacc DC المنقولة بالتبني مقارنة بمجموعات العلاج الأخرى في الجسم الحي (n = 4؛ اختبار أنوفا توكي أحادي الاتجاه). g وقد لوحظت مستويات DC أعلى بكثير من MHCII + في الفئران التي عولجت بـ Vacc DCs المنقولة بالتبني مقارنةً بـ F16BP DCs في الجسم الحي (n = 4؛ اختبار أنوفا توكي أحادي الاتجاه). البيانات ممثلة كخطأ متوسط ± std.
بعد ذلك، لاختبار ما إذا كان بإمكان لقاحات Vacc DC تعديل الاستجابات المناعية بعد تناولها، في اليوم 16، تم عزل الطحال والغدد الليمفاوية والأورام من ظروف مختلفة وصبغها لملف تنشيط الخلايا DC والخلايا التائية. وقد لوحظ أن العدد الإجمالي للوحدات DC والوحدات DC المنشطة في الأورام الخاصة بـ Vacc DC كان أعلى بكثير مقارنة بجميع عناصر التحكم (الشكل XNUMXA). 5d ، ه). علاوة على ذلك، قامت Vacc DCs أيضًا بتنظيم عدد من DCs التي كانت MHCI + CD86 + CD11c + في الورم مقارنة بمجموعات العلاج الأخرى، مما يشير إلى أن Vacc DCs تدعم تنشيط DC في الجسم الحي (الشكل XNUMX أ). 5f). أيضًا ، قامت Vacc DCs أيضًا بتنظيم عدد DCs التي كانت MHCII + CD86 + CD11c + في الورم مقارنةً بـ F16BP DCs المنقولة بالتبني ، مما يشير إلى أن Vacc DCs تنحرف نحو الاستجابات المرتبطة بـ MHCII في الجسم الحي (الشكل XNUMX أ). 5g). تشير هذه البيانات إلى أن تحلل السكر قد يكون ضروريًا للتسلل المحتمل للـ DC في الطحال والورم، وتوفر F16BP MPs القدرة على الـ DC لحدوث تحلل السكر.
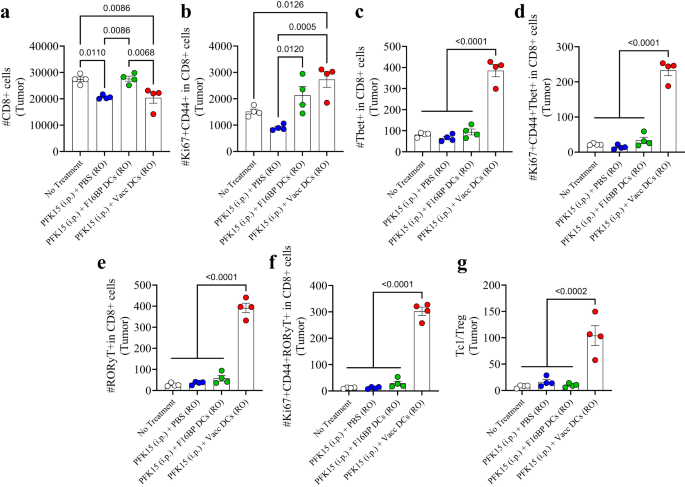
كانت استجابات الخلايا التائية التكيفية في الورم منحرفة نحو الاستجابات المؤيدة للالتهابات (الشكل XNUMX أ). 6a-g؛ س16). وقد لوحظ أن العلاج PFK15 وحده قلل بشكل كبير من العدد الإجمالي لخلايا CD8 + T في الورم، وأن البلدان النامية المحملة بـ F16BP، كانت قادرة على جعل هذا العدد مساويًا للتحكم في عدم العلاج (الشكل XNUMX أ). 6a). ضمن أرقام خلايا CD8 + T هذه، لوحظ أن هناك زيادة بمقدار 2-3 أضعاف في الخلايا التائية المنشطة والمتكاثرة (Ki67 + CD44 + في CD8 +) في الورم في مجموعة Vacc DC مقارنةً بمجموعات التحكم (الشكل XNUMX أ). 6b). علاوة على ذلك، كانت هناك زيادة كبيرة بمقدار 4 أضعاف في Tbet + السامة للخلايا في خلايا CD8 + T (Tc1) في مجموعة Vacc DCs مقارنة بجميع المجموعات الأخرى (الشكل XNUMX أ). 6c). علاوة على ذلك، كان عدد خلايا Tc1 المنشطة والمتكاثرة أعلى بمقدار 10 أضعاف في مجموعة Vacc DC مقارنة بجميع حالات العلاج الأخرى (الشكل XNUMX أ). 6d). وبالمثل، فإن عدد خلايا Tc17 (RORγt+ في CD8+)، وخلايا Tc17 المنشطة والمتكاثرة (RORγt+Ki67+CD44+ في CD8+)، والتي تظهر كأنواع مهمة من الخلايا المؤيدة للالتهابات التي تحفز موت الخلايا السرطانية، كانت أيضًا أكبر من 10- أضعاف أعلى بكثير من الضوابط في الأورام (الشكل XNUMX). 6 هـ ، ص). بالإضافة إلى مجموعات Tc، أدت مراكز Vacc DC أيضًا إلى انخفاض في أعداد الخلايا التائية المساعدة (Th)، وخلايا Th المنشطة والمتكاثرة، وTh1 (Tbet+ في CD4+)، وTh2 (GATA3+ في CD4+)، وTh1 المنشط والمتكاثر. (Tbet + CD44 + Ki67 + في CD4 +)، وأرقام خلايا Th2 المنشطة والمتكاثرة (GATA3 + CD44 + Ki67 + في CD4 +) في مجموعة Vacc DC (الشكل XNUMX أ). S16). كان هناك انخفاض كبير في عدد Treg (CD25 + Foxp3 + في CD4 +) داخل الورم في الفئران المعالجة بـ Vacc DC مقارنة بالفئران غير المعالجة (الشكل XNUMX أ). S16). علاوة على ذلك، كانت هناك زيادة كبيرة في Th17 (RORγt+ في CD4 +) وخلايا Th17 المنشطة والمتكاثرة (RORγt+Ki67+CD44+ في CD4+) داخل الورم في الفئران المعالجة بـ Vacc DC مقارنة بجميع المجموعات الأخرى (الشكل . S16). علاوة على ذلك ، كانت نسبة Tc1 إلى خلايا Treg أعلى بمقدار 5-10 أضعاف في ورم الفئران المعالجة بـ Vacc DC مقارنةً بعناصر التحكم (الشكل XNUMX ب). 6g). تشير هذه البيانات إلى أن اللقاحات DC كانت قادرة على تحفيز استجابة مناعية تكيفية قوية ضد الأورام، والتي قد تكون مدفوعة في المقام الأول بالزيادات في مجموعات خلايا Tc1 وTc17.
a, b لوحظ تعديل كبير للخلايا التائية السامة للخلايا (CD8 +) وكذلك الخلايا التائية السامة للخلايا المنشطة والمتكاثرة (Ki67 + CD44 + في CD8 +) في الفئران التي عولجت بـ Vacc DCs المنقولة بالتبني مقارنة بمجموعات العلاج الأخرى، في الجسم الحي (n = 4؛ اختبار أنوفا توكي أحادي الاتجاه). c-f وقد لوحظ وجود ارتفاع ملحوظ في إجمالي Tc1 (Tbet+ في CD8+)، وTc1 المنشط والمتكاثر (Tbet+Ki67+CD44+ في CD8+)، وإجمالي Tc17 (RORɣT+ في CD8+)، وTc17 المنشط والمتكاثر (RORɣT+Ki67+CD44+ في CD8+) في الفئران المعالجة. مع اللقاحات DC المنقولة بالتبني مقارنة بمجموعات العلاج الأخرى، في الجسم الحي (n = 4؛ اختبار أنوفا توكي أحادي الاتجاه). g وقد لوحظت نسبة أعلى بكثير من الخلايا التائية السامة للخلايا إلى الخلايا التائية التنظيمية (Tc1/Treg) في الفئران التي عولجت باللقاح DC المنقول بالتبني مقارنة بمجموعات العلاج الأخرى، في الجسم الحي (n = 4؛ اختبار أنوفا توكي أحادي الاتجاه). البيانات ممثلة كخطأ متوسط ± std.
نظرًا لأن لقاحات Vacc DC تدار بشكل منهجي ، فقد تم أيضًا تحليل العقد الليمفاوية الطحال وعنق الرحم بحثًا عن التغيرات في الاستجابات المناعية الفطرية والتكيفية (الأشكال XNUMX). S17-S20). بشكل ملحوظ، التردد الإجمالي لـ DC (CD11c +) و DC المنشط (MHCII + CD86 + في CD11c +، MHCI + CD86 + في CD11c +، CD86 + في CD11c +، MHCI + في CD11c +، MHCII + في CD11c +) كانت أعلى بكثير في الطحال بالمقارنة مع الضوابط؛ ومع ذلك، لم يتم ملاحظة هذا الاختلاف في العقد الليمفاوية العنقية (الشكل XNUMX). S17 و S18). تشير هذه النتائج إلى أن النقل بالتبني للبلدان النامية يولد في المقام الأول استجابات مناعية عن طريق تعديل الاستجابات المناعية الفطرية في الطحال. على عكس الورم، لوحظ أنه في الطحال، كان هناك انخفاض كبير في تردد Th17 في مجموعات Vacc DC مقارنة بجميع عناصر التحكم (الشكل XNUMX أ). S19) ، زيادات كبيرة في تردد Th2 مقارنة بجميع عناصر التحكم (الشكل XNUMX أ). S19) ، وانخفاض كبير في تردد Tc17 مقارنة بـ PFK15 وحده، وعناصر التحكم PFK15 + F16BP DC (الشكل XNUMX أ). S20). تشير هذه النتائج إلى أنه على الرغم من إعطاء لقاحات Vacc DC بشكل منهجي، إلا أن الاستجابات المناعية التكيفية المؤيدة للالتهابات وجدت في المقام الأول في الورم وليس في الطحال. بالإضافة إلى ذلك، حافظت مراكز اللقاحات DC المعزولة من طحال الفئران أيضًا على ارتفاع مستوى ECAR وOCR مقارنة بعناصر التحكم (الشكل XNUMX أ). S21). لاختبار ما إذا كان مكون F16BP في التركيبة مهمًا لتوليد استجابات مناعية فطرية وتكيفية، تم حقن وحدات تحكم المجال DC المحملة بـ mRNA القابل للذوبان + بولي قابل للذوبان (IC) في الفئران بشكل مداري رجعي والاستجابات المناعية الفطرية والتكيفية المتولدة في iLN والطحال والأورام تم اختبارها ومقارنتها مع السيطرة على عدم العلاج. وقد لوحظ أنه من أجل زيادة استجابات كل من البلدان النامية والخلايا التائية المؤيدة للالتهابات، كان F16BP المحمل في البلدان النامية ضروريًا، حيث لم تكن هناك فروق ذات دلالة إحصائية بين التحكم بدون علاج والبلدان النامية المحملة بـ mRNA القابل للذوبان + بولي قابل للذوبان (IC) في هذه الأعضاء (تين. S22).
- محتوى مدعوم من تحسين محركات البحث وتوزيع العلاقات العامة. تضخيم اليوم.
- PlatoData.Network Vertical Generative Ai. تمكين نفسك. الوصول هنا.
- أفلاطونايستريم. ذكاء Web3. تضخيم المعرفة. الوصول هنا.
- أفلاطون السيارات / المركبات الكهربائية ، كربون، كلينتك ، الطاقة، بيئة، شمسي، إدارة المخلفات. الوصول هنا.
- أفلاطون هيلث. التكنولوجيا الحيوية وذكاء التجارب السريرية. الوصول هنا.
- تشارت بريم. ارفع مستوى لعبة التداول الخاصة بك مع ChartPrime. الوصول هنا.
- BlockOffsets. تحديث ملكية الأوفست البيئية. الوصول هنا.
- المصدر https://www.nature.com/articles/s41467-023-41016-z