کمپیوٹیشنل ڈیزائن کی حکمت عملی
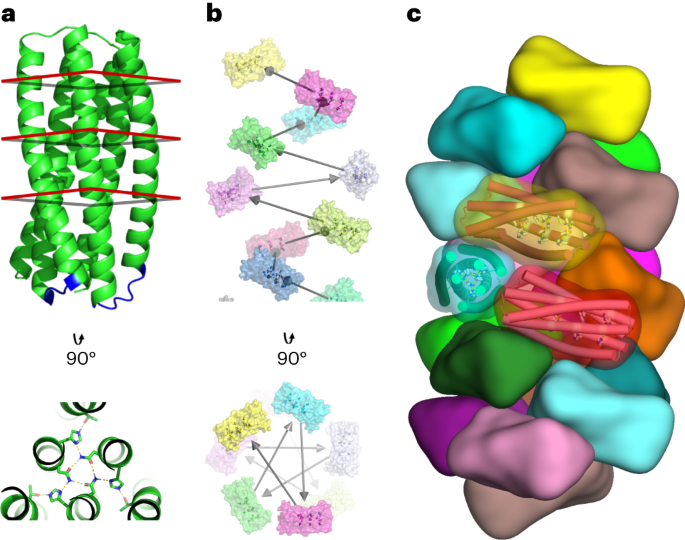
PRO-2.3 ہیلیکس کو ایک ہی زنجیر میں جوڑنے کے لیے مختصر لوپس کو ریڑھ کی ہڈی کے نمونوں کے ایک مکمل ڈیٹا بیس کا استعمال کرتے ہوئے ڈیزائن کیا گیا تھا جو دو ہیلیکل خطوں پر پھیلے ہوئے ٹکڑوں پر مشتمل تھا جس کی شناخت ڈی ایس ایس پی نے ہائی ریزولوشن کرسٹاللوگرافک ڈھانچے میں کی تھی (جیسا کہ پہلے بیان کیا گیا ہے۔14)۔ اس ڈیٹا بیس میں لوپس کی شناخت ایک بہترین سپرپوزیشن الگورتھم کا استعمال کرتے ہوئے ٹکڑے اور ہدف کے ٹرمینل کی باقیات کی سخت سیدھ کے ذریعے کی گئی تھی۔15. 0.35 Å RMSD کی سیدھ میں رواداری کو پورا کرنے والے امیدواروں کو ٹورشن – اسپیس کوآرڈینیٹ اور نرم کوآرڈینیٹ رکاوٹوں کے ذریعے ٹارگٹ بیک بون کے ساتھ منسلک امیدوار بیک بون ہیوی ایٹم کوآرڈینیٹس کے ساتھ منسلک کیا گیا تھا۔ اس کے بعد امیدواروں کے لوپ کی ترتیب کو سورس ڈھانچے کے ڈیٹا بیس میں لوپ بیک بون کی سیدھ کے ذریعے پیدا ہونے والی ترتیب پروفائل رکاوٹوں کے تحت ڈیزائن کیا گیا تھا۔ سب سے کم اسکور والے امیدوار فائنل لوپ ڈیزائن کے لیے منتخب کیے گئے۔
ہیلیکل ڈاکنگ اور ڈیزائن کے طریقے7 ہیلیکل فلیمینٹ ڈیزائن ماڈل بنانے کے لیے منسلک پرو-2.3 پر لاگو کیا گیا تھا۔ مندرجہ ذیل معیارات نے انفرادی ڈیزائن کی رفتار کو فلٹر کیا: پابند (پولیمرک) اور ان باؤنڈ (مونومیرک) ریاستوں کے درمیان −15.0 روزیٹا انرجی یونٹس سے زیادہ فرق، ایک انٹرفیس کی سطح کا رقبہ 700 Å سے زیادہ2، ایک روزیٹا شکل کی تکمیل 0.62 سے زیادہ ہے اور ایک غیر مطمئن قطبی باقیات 5 سے نیچے شمار کرتے ہیں۔ ان معیارات کو پورا کرنے والے ڈیزائنوں کو دستی اصلاح سے گزرنا پڑتا ہے، جس میں انٹرفیس کی پابند حالت کو مستحکم کرنے کے لیے غیر معاون سمجھے جانے والے تغیرات میں سنگل پوائنٹ کی تبدیلی شامل ہوتی ہے۔ ہر ڈوکڈ کنفیگریشن کے لیے ٹاپ اسکورنگ ڈیزائن کو پھر تجرباتی توثیق کے لیے حتمی پروٹین سیٹ میں ضم کیا گیا۔
پروٹین کا اظہار اور طہارت
مجموعی طور پر 18 ڈیزائنوں کے مصنوعی جین کو اظہار کے لیے بہتر بنایا گیا تھا۔ Escherichia کولی اور IDT سے حاصل کیا گیا، پھر NdeI اور XhoI پابندی والی سائٹوں کے درمیان pET29b+ ویکٹر کی متعدد کلوننگ سائٹ میں داخل کیا گیا۔ یہ تعمیرات BL21* (DE3) میں متعارف کرائی گئی تھیں۔ E. کولی قابل خلیات. ٹرانسفارمینٹس کو 50 ملی لیٹر ٹیریفک شوربے میں 200 ملی گرام ایل کے ساتھ ملایا گیا1- کنامیسن اظہار، T7 پروموٹر کے کنٹرول میں، Studier آٹو انڈکشن کا استعمال کرتے ہوئے 24 ° C پر 37 گھنٹے کے لیے آگے بڑھا۔16 جب تک ثقافتوں کو سینٹرفیوگریشن کے ذریعے کاشت نہیں کیا جاتا۔ سیل چھروں کو Tris-buffered saline (TBS) میں دوبارہ معطل کیا گیا اور بگ بسٹر ڈٹرجنٹ کے ساتھ لیس کیا گیا۔ گھلنشیل حصہ، سینٹرفیوگریشن کے ذریعے واضح کیا گیا، Ni کے ذریعے صاف کیا گیا۔2+ Ni-NTA سپر فلو رال کا استعمال کرتے ہوئے غیر متحرک دھاتی وابستگی کرومیٹوگرافی۔ پابند سیل لیسیٹ کے ساتھ رال کو 40 ایم ایم امیڈازول اور 500 ایم ایم NaCl کے دس کالم والیوم کے ساتھ دھویا گیا، اس کے بعد 400 ایم ایم امیڈازول اور 75 ایم ایم NaCl کے ساتھ ایلیوشن کیا گیا۔ گھلنشیل اور ناقابل حل حصوں کو SDS – polyacrylamide جیل الیکٹروفورسس تجزیہ کا نشانہ بنایا گیا۔ صحیح سالماتی وزن پر پروٹین بینڈ کی نمائش کرنے والے نمونے الیکٹران مائکروسکوپی اسکریننگ کے لیے منتخب کیے گئے تھے۔ مزید خصوصیت کے لیے منتخب کردہ ڈیزائنز کو 0.5 l تک پیمانہ کیا گیا، جس میں اسٹڈیر آٹو انڈکشن کا استعمال کرتے ہوئے 24 ° C پر 37 گھنٹے کے لیے دوبارہ اظہار کیا گیا۔16 سنٹرفیوگریشن کے ذریعے کٹائی سے پہلے۔ سیل چھرروں کو ٹی بی ایس میں دوبارہ معطل کیا گیا تھا اور مائکرو فلائیڈائزیشن کے ذریعہ لیس کیا گیا تھا ، جس کے بعد اوپر بیان کیا گیا ہے۔
منفی داغ EM
الیکٹران مائیکروسکوپی اسکریننگ کے لیے TBS (25 mM Tris buffer، 75 mM NaCl، pH 8) میں گھلنشیل حصے مرتکز تھے۔ ایک 6 µl قطرہ (1 µl نمونہ فوری طور پر 5 µl بفر کے ساتھ پتلا ہوا) منفی طور پر چمک سے خارج ہونے والے، کاربن لیپت 200 میش تانبے کے گرڈز پر لگایا گیا، اسے ملی-کیو پانی سے دھویا گیا اور 0.75٪ یورینیل فارمیٹ (پی پی پی) کا استعمال کرتے ہوئے داغ دیا گیا۔ ) یا Nano-W (pH 4.0) Nanoprobes, Inc. سے خریدا گیا جیسا کہ پہلے بیان کیا گیا ہے۔17. اسکریننگ یا تو 100 kV Morgagni M268 ٹرانسمیشن الیکٹران مائکروسکوپ (FEI) یا 120 kV Talos L120C ٹرانسمیشن الیکٹران مائکروسکوپ (تھرمو فشر) کا استعمال کرتے ہوئے کی گئی۔ نیچے ماؤنٹ Teitz CMOS 4k کیمرہ سسٹم کا استعمال کرتے ہوئے تصاویر کیپچر کی گئیں اور فجی سافٹ ویئر (ورژن: 2.14.0/1.54f) کا استعمال کرتے ہوئے بہتر کنٹراسٹ کے لیے کارروائی کی گئی۔18 وضاحت کے لئے.
cryoSPARC میں فائبر ٹریسنگ الگورتھم کا استعمال کرتے ہوئے فائبر کی لمبائی کی مقدار درست کی گئی۔8. یہ طریقہ ریشوں کی شناخت کسی ٹیمپلیٹ کلاس سے باہمی تعلق کے ذریعے کرتا ہے اور شناخت شدہ ذرات سے ملحقہ ریشوں کا پتہ لگاتا ہے۔ DpHF19 سے تیار کردہ ٹیمپلیٹ کلاس تمام ریشوں کی پیمائش کے لیے استعمال کی گئی تھی۔ ریشوں کو اوسط گھماؤ کے مطابق فلٹر کیا گیا تھا (<0.0005 Å1-) اور ہر ایک فائبر میں اوسط نارمل کراس ارتباط (>0.5)۔ DpHF18 کے لیے، ہم نے پی ایچ 5، 2، 3، 20، 28 اور 21 سے 3 کے لیے بالترتیب 3.5، 4.2، 5، 8، 3 اور 8 تصاویر استعمال کیں۔ DpHF19 کے لیے، ہم نے بالترتیب پی ایچ 7، 8، 8، 28، 4 اور 5 سے 3 کے لیے 3.5، 4.2، 5، 8، 3 اور 8 تصاویر استعمال کیں۔ DpHF19_9 اس کے لیے، ہم نے بالترتیب پی ایچ 6، 6، 8، 14، 15، 8 اور 4 سے 3 کے لیے 3.5، 4.2، 5، 6، 8، 3 اور 8 تصاویر استعمال کیں۔
Cryo-EM
Cryo-EM کے نمونے CFLAT ہولی کاربن گرڈز پر پروٹین لگا کر، مائع کو دور کر کے اور وِٹرو بوٹ (تھرمو فشر) کا استعمال کرتے ہوئے گرڈ کو مائع ایتھین میں ڈال کر تیار کیے گئے۔ DpHF19 کے لیے، ویڈیوز Glacios مائکروسکوپ (ThermoFisher) پر حاصل کیے گئے تھے جو K-2 Summit Direct Detect کیمرہ (Gatan Inc.) سے لیس ہے جو کاؤنٹنگ موڈ میں کام کرتا ہے، جس کا پکسل سائز 1.16 Å فی پکسل، 50 فریمز اور کل الیکٹران کی خوراک ہے۔ کے 65 Å-2. DpHF18 اور DpHF7 کے لیے، ویڈیوز کو ٹائٹن کریوس (تھرمو فشر) پر حاصل کیا گیا تھا جو K-2 سمٹ ڈائریکٹ ڈیٹیکٹ کیمرہ (گیٹن انکارپوریشن) سے لیس ہے جو سپر ریزولوشن موڈ میں کام کرتا ہے، جس کا پکسل سائز 0.525 Å فی پکسل، 50 فریم اور 90 Å کی کل الیکٹران خوراک-2. Leginon کا استعمال کرتے ہوئے خودکار ڈیٹا اکٹھا کیا گیا۔19 ورژن 3.4۔ ڈیٹا پروسیسنگ cryoSPARC کا استعمال کرتے ہوئے کی گئی تھی۔8، اور ورک فلو کا خلاصہ ضمنی انجیر میں کیا گیا ہے۔ 10-12. ویڈیوز کو پیچ موشن تصحیح کے ذریعے منسلک کیا گیا تھا، جس میں سپر ریزولوشن ویڈیوز 1.05 Å کے پکسل سائز پر بنی ہوئی تھیں۔ کنٹراسٹ ٹرانسفر فنکشن (CTF) پیرامیٹرز کا تخمینہ پیچ CTF کا استعمال کرتے ہوئے لگایا گیا تھا۔ ٹیمپلیٹ فری فلیمینٹ ٹریسنگ امیجز کے سب سیٹ پر کی گئی تھی، اور نتیجے میں آنے والے ذرات کو 2D درجہ بندی کا نشانہ بنایا گیا تھا۔ منتخب شدہ 2D کلاسز کو پھر مکمل ڈیٹا سیٹس پر ٹیمپلیٹ پر مبنی فلیمینٹ ٹریسنگ کے لیے بطور ٹیمپلیٹس استعمال کیا گیا۔ 2D درجہ بندی کے متعدد راؤنڈ کے بعد، منتخب ذرات کو ہیلیکل ہم آہنگی کے ساتھ 3D ریفائنمنٹ کا نشانہ بنایا گیا اور غیر یونیفارم ریفائنمنٹ کو فعال کیا گیا۔ DpHF19 کے لیے، ہم نے دو اسٹارٹ ہیلیکل سمیٹری پیرامیٹرز کی بجائے انفرادی، غیر رابطہ کرنے والے ذیلی یونٹس سے متعلق ایک اسٹارٹ ہیلیکل سمیٹری نافذ کی۔ DpHF7 اور DpHF19 کے لیے، فی پارٹیکل ڈیفوکس، بیم ٹیلٹ اور کروی خرابی کو بھی بہتر کیا گیا تھا۔ فینکس میں ResolveCryoEM کا استعمال کرتے ہوئے کثافت میں ترمیم کی گئی۔20,21 ورژن فینکس-1.20.1۔ DpHF18 اور DpHF19 کے ایٹم ماڈلز کو ISLDE کا استعمال کرتے ہوئے cryo-EM نقشوں میں بہتر کیا گیا تھا۔22، اس کے بعد فینکس میں حقیقی جگہ کی تطہیر، روٹیمر اور رامچندرن پابندیوں کے ساتھ اور ان پٹ سٹارٹنگ ماڈل کے ذریعہ عائد کردہ حوالہ جاتی پابندیوں کے ساتھ۔ ڈی پی ایچ ایف 7 کے لیے ماڈل کی وضاحت نے ڈی نوو ماڈل بلڈنگ پروٹوکول کو سیگمنٹڈ کرائیو-EM غیر متناسب یونٹ کثافت پر استعمال کیا۔23. RosettaCM کا استعمال کرتے ہوئے بعد میں باقیات کی شمولیت اور تطہیر حاصل کی گئی۔24 ورژن 2019.31، بہترین فٹ سے کثافت اور انٹرا فلیمینٹ انٹرفیس کے لیے غیر منقطع کریو-EM نقشے میں ہم آہنگی کا فائدہ اٹھانا۔ Phenix میں حقیقی خلائی تطہیر کا آخری دور انجام دیا گیا، جیسا کہ اوپر DpHF18 اور DpHF19 کے لیے بیان کیا گیا ہے۔ Cryo-EM ڈیٹا اکٹھا کرنے، ریفائنمنٹ اور توثیق کے اعدادوشمار کا خلاصہ ضمنی جدول میں دیا گیا ہے۔ 1.
TIRFM
فائبر اسمبلی
پی ایچ ریسپانسیو ریشوں کے سیڈڈ نیوکلیشن کی تصویر کشی کے لیے، ڈی پی ایچ ایف 18 ریشوں پر دو مختلف میلیمائیڈ کنجوگیٹڈ فلوروفورس، اوریگون 488 اور سلفو-سائی 5 کا لیبل لگایا گیا تھا۔ زیبا اسپن کالم پر TBS (10 mM Tris, 1 mM NaCl, pH 4) میں بفر کے تبادلے سے پہلے PBS + 25 mM TCEP میں کمرے کے درجہ حرارت پر 100× داڑھ اضافی کے ساتھ فائبرز کا لیبل لگایا گیا تھا اور ارتکاز 8.0 μM تک تھا۔ . پی ایچ کو 30 تک کم کرنے کے لیے 30 μM پر سبز ریشوں کو 1 M سائٹریٹ (0.6 μl سائٹریٹ سے 20 μl ریشوں) کے اضافے کے ذریعے الگ کیا گیا تھا۔ پی ایچ کو واپس 3.0 پر لانے کے لیے ٹرائس (5 μl 3.6 M اسٹاک) کے اضافے سے پہلے محلول کو 1 منٹ تک انکیوبیٹ کیا گیا تھا۔ 8.0 μM پر جمع شدہ DpHF1–Cy18 فائبر کا 5 μl حل میں شامل کیا گیا تھا۔ اس محلول کو بعد میں 30 پر سینٹرفیوگریشن سے پہلے کمرے کے درجہ حرارت پر انکیوبیٹ کیا گیا۔ g ایک بینچ ٹاپ سینٹری فیوج میں 2 منٹ کے لیے۔ ریشوں کو TBS میں دوبارہ معطل کیا گیا تھا اور TIRFM کے ذریعہ ان کی تصویر کشی کی گئی تھی۔
فائبر جدا کرنا
کم پی ایچ پر جدا ہونے والے ریشوں کی تیز TIRFM امیجنگ تیز رفتار کے ساتھ کامل فوکس سسٹم سے لیس Nikon Ti اسٹینڈ پر مبنی کسٹم بلٹ TIRF سسٹم پر کی گئی۔ Z پیزو سٹیج (ASI)، ایک ایزیموتھل TIRF الیومینیٹر (iLas2، Roper France) جس میں اپنی مرضی کے مطابق توسیع شدہ فیلڈ آف ویو (Cairn) اور PLAN Apo 1.45 NA × 100 مقصد ہے۔ تصاویر کو فوٹو میٹرکس پرائم 95B بیک الیومینیٹڈ ایس سی ایم او ایس کیمرہ کے ساتھ حاصل کیا گیا تھا جو سیوڈو گلوبل شٹر موڈ میں چلایا گیا تھا، جسے ایزیمتھل الیومینیشن کے ساتھ ہم آہنگ کیا گیا تھا۔ سسٹم میٹامورف 7.10.1.161 کے ذریعہ چلایا گیا تھا۔ Sulfo-Cy5 maleimide-lebelled fibers کو 630 nm لیزر (کیرن لیزر لانچ میں نصب 150 میگاواٹ کوہرنٹ OBIS) کے ساتھ امیج کیا گیا تھا اور ہر 655 فریم 1 فریم پر کیرن اوپٹاسپن وہیل میں نصب کروما ET16lp فلٹر کا استعمال کرتے ہوئے تصویر کشی کی گئی تھی۔
ریشوں کو امیجنگ بفر (25 mM Tris pH 8.0, 100 mM NaCl) میں ایک Ibidi فلو سیل میں جو صاف کمرے کے درجے کے کور سلپس پر نصب کیا گیا تھا (اپنی مرضی کے مطابق، 25 × 75 ملی میٹر)2، نیکسٹیریون)، اور PLL-PEG (0.1 mg ml1- 20 ایم ایم ہیپس میں، پی ایچ 7.6؛ 5 منٹ)۔ امیجنگ بفر کے ساتھ ان باؤنڈ ریشوں کو ہٹانے سے پہلے ریشوں کو کور سلپ پر 5 منٹ تک جمع کرنے کی اجازت تھی۔ تیزی سے حصول کے دوران، پی ایچ کم پی ایچ بفر (25 ایم ایم ٹریس، 100 ایم ایم NaCl، پی ایچ 3.0) میں بہہ کر کم کیا گیا تھا۔
بلک محلول میں فائبر کو جدا کرنے کی پیمائش کرنے کے لیے، 1.5 ملی لیٹر ایپنڈورف ٹیوبوں میں پہلے سے بنائے گئے ریشوں کو بے ترکیبی کو متحرک کرنے کے لیے کم پی ایچ پر سائٹریٹ بفرز میں تبدیل کیا گیا۔ ہر پی ایچ ری ایکشن کا ایک حصہ مختلف ٹائم پوائنٹس پر ہٹا دیا گیا اور 96 کنویں پلیٹ میں اور 10 منٹ کے لیے شامل کیا گیا تاکہ ریشوں کو شیشے کے سبسٹریٹ پر قائم رہنے اور اس پر عمل کرنے کی اجازت دی جا سکے۔ ہر حالت اور ٹائم پوائنٹ کے لیے، ایک Nikon ×2500 PLAN Apo 60 NA ایئر مقصد اور ایک 0.95 nm LED اتیجیت کا ذریعہ، اکٹھا اخراج کے ساتھ 631 ms نمائش کا وقت استعمال کرتے ہوئے IN Cell Analyzer 150HS مائکروسکوپ (مالیکیولر ڈیوائسز) پر نو فیلڈز حاصل کیے گئے۔ 684 ± 24 nm بینڈ پاس فلٹر کے ذریعے۔ اوٹسو تھریشولڈنگ الگورتھم کے ساتھ ریشوں کو سیگمنٹ کرنے کے لیے حسب ضرورت سیل پروفائلر اسکرپٹ کا استعمال کرتے ہوئے تصاویر کی مقدار درست کی گئی۔25. دہلیز کی اوپری اور نچلی حدود کے ساتھ ساتھ آبجیکٹ ID کے لیے انکولی ونڈو کو اس وقت تک ایڈجسٹ کیا گیا جب تک کہ بیک گراؤنڈ سگنل کے مقابلے میں ریشوں کی صحیح شناخت نہ ہو جائے۔ CellProfiler پائپ لائن کا استعمال کرتے ہوئے شناخت شدہ اشیاء کی بڑی محور کی لمبائی ہر pH حالت کے لیے انکیوبیشن ٹائم کے خلاف بنائی گئی تھی۔
مائع فیز اے ایف ایم
نمونے کی تیاری
ہم نے 10 wt% poly-lysine محلول کے 0.01 µl کو 12 منٹ کے لیے تازہ کلیئڈ مسکووائٹ میکا سطح (2 ملی میٹر، ٹیڈ پیلا انکارپوریشن) پر انکیوبیٹ کیا۔ اضافی محلول کو ہٹا دیا گیا تھا اور سطح کو پانی سے دھویا گیا تھا اور N کے ساتھ خشک کیا گیا تھا۔2 گیس7. پھر امیجنگ بفر میں 30 µl 10 µM پروٹین محلول (25 mM Tris-HCl، pH 400 پر 8 mM NaCl) کو پولی لائسین لیپت میکا پر 30 منٹ تک انکیوبیٹ کیا گیا اور اضافی پروٹین کو ہٹانے کے لیے امیج بفر سے دھویا گیا۔ جدا کرنے والے بفر (25 mM Tris-HCl, 400 mM NaCl, pH 4.1, 4.4, 4, 5 یا 4.7) کے pH کو 10 M NaOH یا 1 M سائٹرک ایسڈ کے ساتھ ایڈجسٹ کیا گیا تھا اور PVDF کے استعمال سے پہلے 0.1 µm porefil سائز کے ساتھ فلٹر کیا گیا تھا۔ . فوٹو ایسڈ تجربات کے لیے، 10 mM Tris-HCl pH 25 میں 8 µM پروٹین محلول کو ننگے میکا پر 30 منٹ تک انکیوبیٹ کیا گیا اور 25 mM Tris-HCl pH 5.5 سے دھویا گیا۔ اگر سطح پر ریشوں کی تعداد کی کثافت کم تھی تو ایک اضافی جمع اور کللا مرحلہ کیا گیا تھا۔ ہم نے 1 mM 2-nitrobenzaldehyde (Sigma-Aldrich) کو 25 mM Tris-HCl pH 5.5 میں بھی تازہ طور پر تیار کیا اور کسی بھی مرحلے پر روشنی کی نمائش کے بغیر اسے فوری طور پر استعمال کیا۔26. سپیکٹروسکوپک اور پی ایچ پیمائش نے اشارہ کیا کہ 2-نائٹروبینزالڈہائڈ 200 اور 405 nm کی طول موج کے درمیان فعال ہے اور پی ایچ کو 5.5 سے 2.7 تک کم کرتا ہے، اور یہ کہ لیزر کی زیادہ شدت تیزی سے کھپت اور تیزابیت کا باعث بنتی ہے۔
امیجنگ
مستقل ساخت پر متحرک مطالعہ کے لئے، پروٹین لیپت پولی لائسین میکا سبسٹریٹس کو اے ایف ایم مائع سیل (بروکر ملٹی موڈ 8) کے نیچے رکھا گیا تھا۔ امیجنگ بفر میں صاف سلیکون نائٹرائڈ کینٹیلیور (بروکر، SNL-10، موسم بہار کا مستقل: 0.12 N m) استعمال کرتے ہوئے تصاویر کیپچر کی گئیں۔1-، کمرے کے درجہ حرارت (5 ° C) پر ٹیپنگ موڈ میں 25 منٹ کے لئے UV اوزون کیا گیا۔ جدا کرنے والے بفر کو بہانے سے پہلے، پیرامیٹرز (10 اسکین لائنز، 256 ہرٹز اسکین ریٹ، ہائی انٹیگرل گین (1.5–3) اور 4–50 ایم وی فری طول و عرض) کو بہتر بنانے کے لیے ریشوں کو 100 منٹ تک مسلسل امیج کیا گیا۔ اس بات کی تصدیق کرنے کے بعد کہ کینٹیلیور کی حوصلہ افزائی سے کوئی نقصان نہیں ہوا، جدا کرنے والے بفر کو 25 µl منٹ پر لگاتار انجیکشن لگایا گیا۔1-. فلو تھرو سیٹ اپ کو نہ ہونے کے برابر رہائش کا وقت اور تیز پی ایچ سوئچنگ فراہم کرنے کے لیے بہتر بنایا گیا تھا۔10.
فوٹو ایسڈ مطالعہ کے لیے، 25 ایم ایم Tris-HCl pH 5.5 کے ساتھ پروٹین لیپت ابرک کو ایک سائفر VRS AFM (اسائلم ریسرچ) کے مائع سیل کے نیچے رکھا گیا تھا جو بلیو ڈرائیو لیزر (×0.3 شدت کا فلٹر، 405 nm طول موج) وینٹ والو کے ساتھ لیس تھا۔ ٹیپنگ موڈ میں کھلا اور چلایا جاتا ہے۔ ریشوں کی اونچی سطح کی کوریج کی تصدیق کرنے کے بعد، امیجنگ بفر کو 1 ایم ایم Tris-HCl pH 2 میں 25 mM 5.5-nitrobenzaldehyde سے تبدیل کر دیا گیا، جس کو نظر آنے والی پس منظر کی روشنی کی نمائش کے بغیر چلایا گیا اور دوبارہ تصویر بنائی گئی۔ اس کے بعد کینٹیلیور کو واپس لے لیا گیا، اور بلیو ڈرائیو کو آن کیا گیا اور AFM کے موٹرائزڈ آپٹیکل مائکروسکوپ کا استعمال کرتے ہوئے بار بار پہلے سے منتخب کردہ علاقوں میں راسٹر کیا گیا۔ اسپاٹ اور لائن پیٹرن کے لیے راسٹر/ڈول کے دوران UV کی نمائش کا کل وقت 10 منٹ سے زیادہ نہیں تھا، جس کے بعد کینٹیلیور کو واپس بے نقاب علاقوں میں منتقل کر کے امیج کیا گیا۔ عالمی پی ایچ تبدیلیوں کے لیے، فوٹو ایسڈ محلول کے ساتھ رابطے میں اے ایف ایم مائع سیل کی کوارٹج ونڈو کو 364 منٹ کے لیے ہینڈ ہیلڈ یووی لیمپ (7 این ایم طول موج) کے سامنے لایا گیا، اور پھر تصویر بنائی گئی۔
تصاویر کو Gwyddion SPM v2.62 ڈیٹا تجزیہ سافٹ ویئر کے ساتھ پروسیس کیا گیا اور فجی سافٹ ویئر v1.53s کے ساتھ تجزیہ کیا گیا۔18. حرکیات کے لیے، فائبر کی کل لمبائی کی پیمائش کی گئی، اور جو بھی ٹکڑوں کو پہلے سے جدا کیا گیا سمجھا جاتا ہے اسے لمبائی کی پیمائش سے خارج کر دیا گیا۔ انفرادی ریشوں کے ہر سرے پر بے ترکیبی کی شرح کی پیمائش کرنے کے لیے (ضمیمہ انجیر۔ 8)، فائبر کا مرکز (ابتدائی لمبائی کا نصف) لمبائی کی پیمائش کے لیے دوسرے سرے کے طور پر تفویض کیا گیا تھا، جبکہ فائبر کے ٹکڑوں کے لیے، ٹکڑے کے مرکز کو دوسرے سرے کے طور پر ماپا گیا تھا۔
- SEO سے چلنے والا مواد اور PR کی تقسیم۔ آج ہی بڑھا دیں۔
- پلیٹو ڈیٹا ڈاٹ نیٹ ورک ورٹیکل جنریٹو اے آئی۔ اپنے آپ کو بااختیار بنائیں۔ یہاں تک رسائی حاصل کریں۔
- پلیٹوآئ اسٹریم۔ ویب 3 انٹیلی جنس۔ علم میں اضافہ۔ یہاں تک رسائی حاصل کریں۔
- پلیٹو ای ایس جی۔ کاربن، کلین ٹیک، توانائی ، ماحولیات، شمسی، ویسٹ مینجمنٹ یہاں تک رسائی حاصل کریں۔
- پلیٹو ہیلتھ۔ بائیوٹیک اینڈ کلینیکل ٹرائلز انٹیلی جنس۔ یہاں تک رسائی حاصل کریں۔
- ماخذ: https://www.nature.com/articles/s41565-024-01641-1



