Heterojen fibroblastlar kertenkele kuyruğunun yeniden büyümesine katkıda bulunur
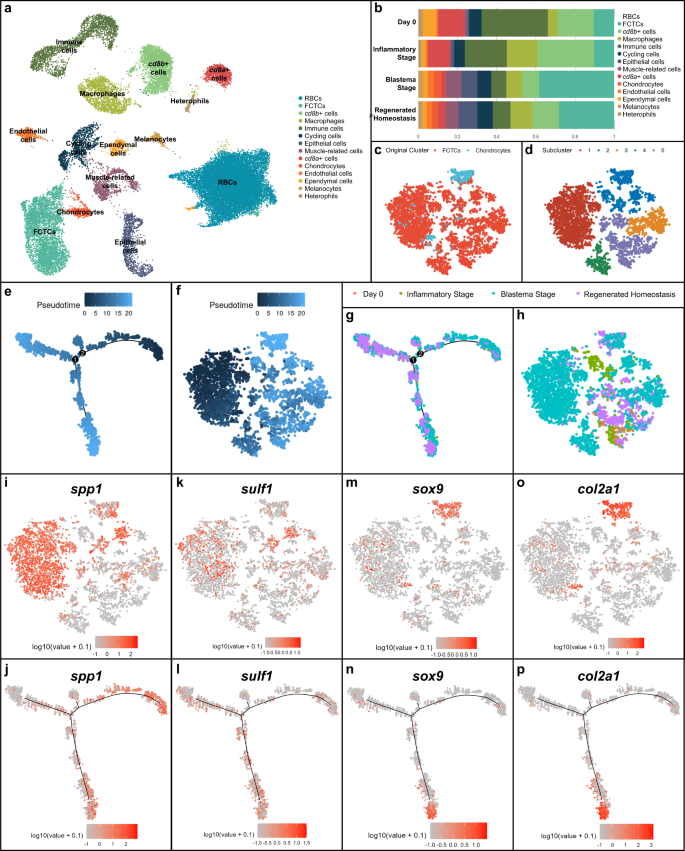
Kuyruk yeniden büyümesi sırasında her bir yenilenme durumunun karmaşıklığını ve heterojenliğini araştırmak için, yeşil anole kertenkelesinin aşamalı kuyruk örneklerinde tek hücreli RNA dizilimi (scRNAseq) gerçekleştirdik. Anolis carolinensis. 10x Genomics scRNAseq platformu kullanılarak, kuyruk numuneleri aşağıdaki dört numune grubundan birine ayrıldı: orijinal kuyruk (ampütasyondan 0 gün sonra, DPA), inflamatuar evre (1, 3 ve 7 DPA), blastema evresi (14 ve 21) DPA) veya rejenere homeostaz (28 DPA). Enflamatuar ve blastema aşaması numuneleri, bireyler arasında kuyruk rejenerasyonundaki doğal değişkenliği göz önünde bulundurarak numune grupları arasında tutarlılığı sağlamak için çoklu numune zaman noktalarını içermiştir.41. Numune DPA'sının izlenmesine ek olarak, numuneler morfoloji ve karakteristik rejenerasyon aşaması fenotipleri açısından değerlendirildi.42, enflamatuar ve blastema evrelerinde birden çok zaman noktasının kullanılmasıyla sonuçlanır (her bir kuyruk aşaması için ayrıntılı fenotipler/morfolojiler Yöntemlerde açıklanmıştır). Sıralama sonuçları, 10x Genomics Cell Ranger kullanılarak analiz edildi43 boru hattı ve R paketleri Seurat44 ve Uyum45.
Rejenerasyon süresi kursunun denetimsiz UMAP kümelemesi, 14 farklı hücre kümesini ortaya çıkardı (Şekil XNUMXA). 1a). Kümeler, üst diferansiyel olarak eksprese edilmiş genler için analiz edildi ve anahtar hücre tipleri, in situ hibridizasyon (ISH) ve rejenere edici kuyruk numunelerinde karşılık gelen doku geni ekspresyonu için histoloji yoluyla doğrulandı (Ek Şekil XNUMXa). 1). Katepsin B dahil olmak üzere birkaç bağışıklık ve kan hücresi kümesi tanımlandı (ctsb+) makrofajlar9, yüksek seviyelerde CD8 alt birim A ile tanımlanan kümeler (cd8a+) ve CD8 alt birimi B (cd8b+) ifade ve çekirdekli kırmızı kan hücreleri. Keratin tip II hücre iskeleti 5 (krt5+) epitel hücreleri, von Willebrand faktörü (vwf+) endotel hücreleri, yağ asidi bağlayıcı protein 7 (fabp7+) ependimal hücreler46, yüksek proliferasyon Ki-67 belirteci ile karakterize edilen döngüsel hücreler (mki67) ekspresyonu, kreatin kinaz M tipi (ckm+) kasla ilgili hücreler15, premelanozom proteini (pmel+) melanositler, SRY kutusu transkripsiyon faktörü 9 (sox9+) kondrositler47ve kollajen tip I alfa 1 zinciri (col1a1+) fibroblastik bağ dokusu hücresi (FCTC) kümeleri, diferansiyel gen ekspresyon analizi ve memeli ortolog tanımlaması yoluyla da tanımlandı.
a Kertenkele için tek hücreli RNA sıralamasının (scRNAseq) denetimsiz kümelenmesinin UMAP sonuçları (Anolis carolinensis) zarar görmemiş 0. gün kertenkele kuyruğu (amputasyondan 0 gün sonra veya DPA), enflamatuar aşama (1, 3 ve 7 DPA), blastema aşaması (14 ve 21 DPA) ve yenilenmiş homeostaz (28 DPA) örneklerinden oluşan kuyruk rejenerasyon süresi kursu . b Kırmızı kan hücreleri hariç, kuyruk numune aşaması başına göreli hücre tipi bileşim oranlarının miktarının belirlenmesi. c ScRNAseq veri kümesinden izole edilmiş, entegre edilmiş ve alt kümelenmiş fibroblastik bağ dokusu hücrelerinin (FCTC'ler) ve kondrositlerin TSNE'si (a). d FCTC'lerin ve kondrosit hücre alt kümesinin denetimsiz kümelenmesinin TSNE'si. e FCTC'ler ve kondrosit scRNAseq hücre alt kümesi için Monocle2 sözde zaman yörünge analizi (c). f TSNE FCTC/kondrosit hücre alt kümesi üzerine bindirilmiş sözde zaman. g FCTC/kondrosit alt kümesi için sözde zaman yörüngesinde yer alan rejenerasyon zaman noktası. h FCTC/kondrosit TSNE, rejenerasyon zaman noktasına göre analiz edildi. i, j Sp1, k, l sülf1, m, n sox9, ve o, p col2a1 sırasıyla FCTC/kondrosit TSNE alt kümesinde ve FCTC/kondrosit alt kümesi sözde zaman yörüngesinde gen ifadesi.
Rejenerasyon aşamasına göre analiz edildiğinde, numunedeki toplam hücrelere kıyasla her bir hücre tipinin orantılı katkıları (Şekil XNUMXa). 1b), daha önce bahsedilen aksolotl scRNAseq analizine benzer şekilde, blastema aşamasında FCTC popülasyonunda büyük bir genişleme ortaya çıkardı36. Bu FCTC kümesi, kertenkele kuyruğunu yenilemek için iskelet öncüleri olan kondrosit hücre kümesiyle yakından ilişkiliydi. Orantılı hücre tipi katkıları, küme tanımlayıcı işaret genleri (Ek Şekil XNUMXa) kullanılarak floresan ISH (FISH) ile doğrulandı. 2), 14 ve 0 DPA'ya kıyasla FCTC'ler 7 DPA'da önemli bir artışı gösteriyor. FCTC'lerin blastema aşamasındaki genişlemesi ve kondrositlerle yakın kümelenmeleri göz önüne alındığında, FCTC kümesi ve kondrosit kümesi izole edildi, hesaplamalı olarak entegre edildi ve alt kümelendi (Şekil XNUMXb). 1c, d) FCTC kümesi içinde farklı fibroblast popülasyonlarının var olup olmadığını belirlemek ve FCTC kondrojenik potansiyeline yol açan olası gen imzalarını ortaya çıkarmak için.
Sözde zaman yörünge analizi, scRNAseq gen ekspresyon profillerine dayalı olarak biyolojik geçişleri veya hücre soy ilişkilerini anlamak için kullanılan bir hesaplama yöntemi48, FCTC/kondrosit alt kümesinde gerçekleştirildi (Şek. 1e, f) R paketi Monocle2 kullanılarak49,50,51 ve rejenerasyon boyunca potansiyel hücre kaderi yörünge değişikliğinin bir küçük ve iki ana dal noktasını ortaya çıkardı. Rejenerasyon zaman noktasına göre analiz edildiğinde (Şek. 1g, h ve Ek Şekil. 3), daha önceki yalancı zaman hücre popülasyonları, çoğunlukla blastema aşaması hücre popülasyonlarına karşılık gelirken, daha sonraki sahte zaman dallanma noktaları, rejenere homeostaz ve orijinal kuyruk hücreleri tarafından yönetildi; geç sözde zamandaki hücreler daha kısıtlı/tanımlanmış bir hücre kaderine sahip olabilir.
FCTC/kondrosit alt kümesindeki diferansiyel olarak eksprese edilen genlerin (DEG'ler) daha fazla analizi, aynı zamanda salgılanmış fosfoprotein 1 olarak da adlandırılan yüksek seviyelerde osteopontin ortaya çıkardı (spp1), ifade (Şek. 1i, j), özellikle FCTC/kondrosit veri setinin 1. alt kümesinde, blastema aşaması örneği ve erken yalancı zaman içinde. Sp1 ilk olarak kemik mineralizasyonundaki ve hücre dışı matris birikimindeki rolüyle tanımlanmıştır.52, ancak daha yeni çalışmalar öneriyor spp1 bir sitokin olarak hareket edebilir ve yaralanma yanıtında rol oynayabilir53,54,55,56. Örneğin, spp1 Wnt ve Hedgehog (Hh) yolu sinyal modülasyonunda yer almıştır57,58 ve anti-apoptotik aktiviteler nedeniyle kritik hücre popülasyonlarının yara ortamlarında hayatta kalmasına yardımcı olabilir59.
sülfataz 1 (sülf1) ifade (Şek. 1 bin, ben) yayılmalı blastema ve rejenere zaman noktalarının yanı sıra yalancı zamanın çoğu, ifade erken, orta ve geç yalancı zaman arasında değişir. 6-O-sülfat gruplarını heparin sülfat proteoglikanlarından (HSPG'ler) seçici olarak uzaklaştıran bir heparin sülfat 6-O-endosülfataz olarak, sülf1 enzimatik aktivite, heparin bağlayıcı büyüme faktörleri ve sitokinler için birçok HSPG reseptörünün bağlanmasını ve aşağı akış sinyalini modüle eder60,61. Endosülfatazların, memeli ve kuş iskelet oluşumu sırasında Wnt ve BMP sinyalini aktive etmek ve FGF sinyalini azaltmak için gerekli olduğu gösterilmiştir.61,62,63, süre sülf1 spesifik olarak, yerel sonik kirpi geliştirerek Hh sinyalini modüle ettiği de gösterilmiştir (şşt) konsantrasyonlar ve bulunabilirlik64.
kondrosit belirteçleri sox9 (İncir. 1 dk, n) ve kollajen tip II alfa 1 zinciri (col2a1)15 (İncir. 1o, s) ağırlıklı olarak 2. alt kümede, yenilenmiş homeostatik hücrelerde odaklanmıştı ve özellikle geç psödozamanın alt dalında ifade edildi. Böylece, erken sözde zaman yörüngesinin sağ kolu, spp1+ blastema aşaması fibroblastları ve geç psödozamanın alt dalı daha farklılaşmış temsil edildi sox9+ yenilenen kondrositler ve terminal olarak farklılaşmış col2a1+ rejenere homeostazda kıkırdak. DEGs fosfolipid transfer proteini (lütfen) ve spat benzeri transkripsiyon faktörü 1 (sal1) ayrıca sözde zaman yörünge analizi ile de analiz edildi (Ek Şekil SXNUMX). 4) ancak sözde zamanı belirli rejenerasyon aşamalarıyla ilişkilendiren farklı ifade modellerini ortaya çıkarmadı.
Birlikte ele alındığında, sözde zaman yörünge analizi, fibroblastların rejenerasyon boyunca FCTC işaretleyici gen ekspresyonu kazandığını ve sonunda potansiyel kondrojenik kapasiteye ve kondrosit hücre kaderine yol açtığını öne sürdü. Birçok blastema FCTC ifade eder spp1. Bu fibroblastların tümü olmasa da bazıları ifade etmeye devam edebilir. sülf1 kuyruk yenilenme süreci boyunca devam ettikçe ve daha sonra, sox9+ kondrositler ve form col2a1+ kıkırdak. Bu scRNAseq çalışması, kertenkele kuyruğu rejenerasyonunun kritik bir zaman süreci analizini temsil eder ve sözde zaman yörüngesi aracılığıyla, aşağıda daha ayrıntılı olarak incelenen FCTC işaretleyici gen ifadesi ile blastema FCTC kondrojenezi arasında potansiyel bir ilişki önerir.
Kertenkele kuyruğu patlamaları FCTC'lerden oluşur
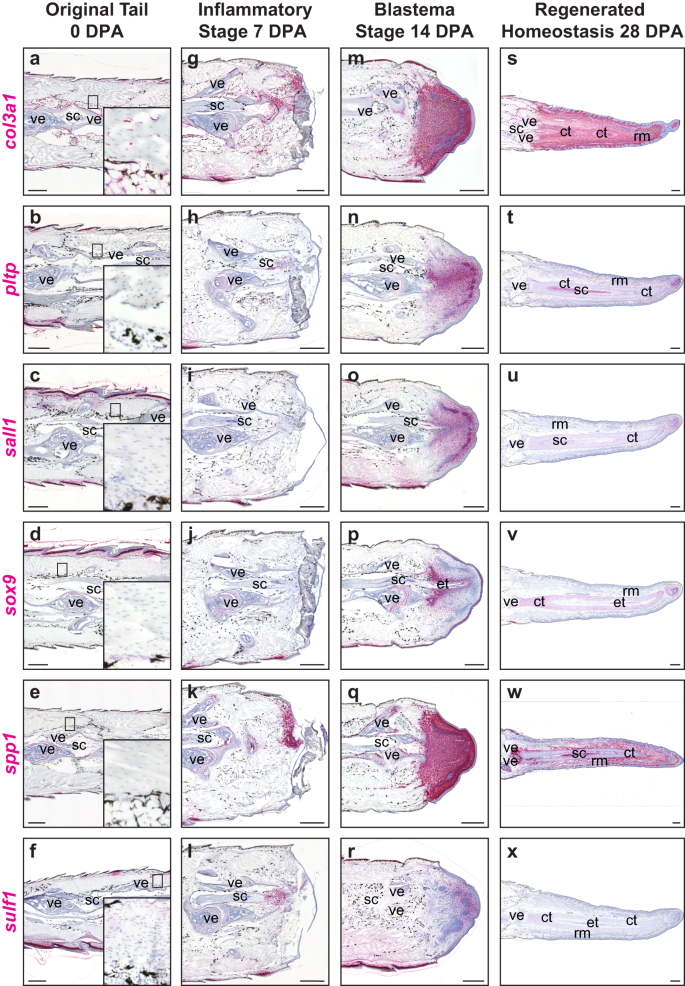
Tek hücreli veri analizi kullanılarak, FCTC kümesi içinde farklı şekilde yukarı regüle edilmiş birkaç fibroblast geni tanımlandı; bunların birçoğu, diğer organizmalarda yoğunlaşan mezenşim, kıkırdak oluşumu ve kemiğin yeniden şekillenmesi ve birikme fonksiyonları için çıkarımlara sahipti.52,65,66. Bu FCTC işaretleyici genleri, kuyruk rejenerasyonu boyunca ekspresyon için boyandı ve fibroblast gen ekspresyon paternlerinde uzaysal-zamansal bir şekilde değişiklikler ortaya çıktı (Şekil XNUMXb). 2 ve Ek Şekil. 5). Yaralanmamış orijinal kuyruklarda, kollajen tip III alfa 1 zinciri (co13a1+) periosteum, perikondrium, epidermis ve diğer bağ dokularını kaplayan homeostatik FCTC'ler (Şek. 2a-f), birçok FCTC de düşük seviyelerde kaderin 11'i ifade eder. (cdh11), (Ek Şek. 5a-e), daha önce bildirildiği gibi67. 7 DPA ile, 0 DPA'ya kıyasla birkaç ek fibroblast geni aktive edildi ve terminal omurlardan distal yara bölgelerine yeniden yerleştirildi. Bu yaralanma durumu FCTC'leri, yüksek performans sergilemiştir. spp1 (İncir. 2k), Hem de col3a1 (İncir. 2g), cdh11, kollajen tip XII alfa 1 zinciri (col12a1), orta kine (mdk), salgılanan protein asidik ve sistein açısından zengin (kısa)ve tenascin benzeri (tnl) ifadesi (Ek Şekil. 5f-j). Sülf1 ampute omuriliklere bitişik bölgelere lokalize olmaya başladı (Şekil XNUMX). 2l), fosfolipid transfer proteini ise (lütfen), spalt benzeri transkripsiyon faktörü 1 (sal1), ve sox9 (İncir. 2sa–j) çok az ifade sergiledi veya hiç göstermedi 7 DPA.
Orijinal ve yenilenen kertenkelenin temsili sagital bölümleri (A. carolinensis) RNAscope™ in situ hibridizasyon yoluyla analiz edilen kuyruk örnekleri. a-f Büyütülmüş homeostatik fibroblastlar içeren orijinal kuyruklar (0 DPA), g-l enflamatuar evre kuyrukları 7 DPA, m-r blastema aşaması 14 DPA'yı takip ediyor ve s-x rejenere homeostaz aşaması kuyrukları 28 DPA için analiz edildi col3a1, pltp, sall1, sox9, spp1, ve sülf1. n = Zaman noktası başına 5 hayvan/örnek. ct kıkırdak tüpü, et ependimal tüp, rm rejenere kas, sc omurilik, ve vertebra. Çubuk = 500 mikron.
Blastema oluşumu 14 DPA sırasında, FCTC'ler uzak kuyruk uçlarında toplandı ve birkaç işaretleyici genin ekspresyonunu arttırdı. Yaygın sparc yenilenen kas demetleri dahil olmak üzere blastemler boyunca ekspresyon gözlendi (Ek Şekil XNUMXc). 5n), while col3a1, spp1, col12a1, mdk, ve tnl yeni oluşan tüm blastemal dokuları etiketledi, ancak yenilenen kas demetlerinde belirgin şekilde daha düşük ifade ile (Şekil XNUMX). 2m, q ve Ek Şekil. 5 l, m, o). Birkaç FCTC işaretçisi, kuyruk patlamaları içinde daha lokalize ifade modelleri sergiledi. sox9 ekspresyon, kertenkelelerde kondrojenik potansiyelin korunmuş işaret geni ve kıkırdak rejenerasyonu47, merkezi rejenere omuriliklerin etrafında yoğunlaşan etiketli pro-kondrojenik mezenkim ve düşük lateral ekspresyona yüksek medial ekspresyon ve proksimal (yüksek) ila distal (düşük) organizasyonlar sergiledi (Şek. 2p). Yoğunlaşan kondrojenik mezenkim ayrıca şu şekilde etiketlendi: plp, sall1, sülf1, ve cdh11 ifade (Şek. 2n, o, r ve Ek Şekil. 5k). Sülf1 ayrıca, medial ila lateral ve proksimodistal organizasyonlar sergileyen, distal blastema uçlarında FCTC popülasyonlarını etiketledi, bunların tersi sox9 (İncir. 2r).
28 DPA'da, rejenere bağ dokusu yüksek ekspresyonunu sürdürdü. spp1, cdh11, MDK, ve tnl, ancak bu belirteçler büyük ölçüde farklılaşmış kas ve kıkırdak elemanlarından dışlandı (Şekil XNUMXa). 2w ve Ek Şekil. 5p, r, t). Col12a1 ve sparc bağ dokularında ve rejenere kıkırdakta yüksek oranda eksprese edildi, ancak özellikle rejenere kas demetlerinden hariç tutuldu (Ek Şekil XNUMXa). 5q, saniye). Sadece col3a1 epidermis, kas demetleri, kıkırdak elemanları ve interstisyum içindeki bağ dokularında 0'dan 28 DPA'ya kadar rejenerasyonun her aşamasında FCTC popülasyonlarında yüksek ekspresyonu korumuştur (Şekil XNUMXa). 2s). sox9 Ekspresyon özel olarak kıkırdak tüplerini işaretledi ve proksimodistal olarak azaldı (Şekil XNUMX). 2v). plp ve sall1 en yüksek oranda medialde, çevreleyen kıkırdak tüplerinde ve distalde kuyruk uçlarında eksprese edildi, ancak diğer bağ dokularında büyük ölçüde kayboldu (Şekil XNUMXa). 2t, sen). Sülf1 kıkırdak tüplerinde kalan yalnızca minimum ifade ile 28 DPA ekspresyonu belirgin bir şekilde yoktu (Şekil XNUMXc). 2x). Genel olarak, yenilenmiş kuyruklar 14 ve 28 DPA, orijinal kuyruklar (0 DPA) içindeki nispeten küçük ve sınırlı nişlerine rağmen FCTC popülasyonları tarafından domine edilirken, birkaç FCTC geni, kuyruk yenilenmesi 7 DPA'nın yaralanma durumu sırasında açıldı.
Sülf1 + Hh tarafından uyarılan blastema FCTC'ler kıkırdak oluşturur
Yukarıda açıklanan ScRNAseq sonuçları, farklı kıkırdak ve blastema FCTC kümelerini gösterdi ve laboratuvarımızdan önceki çalışmalar, blastema kıkırdak oluşumunu indüklemek için kritik sinyal olarak ependim katkılı Hh sinyalini tanımladı.14. Hh inhibisyonunun ve aktivasyonunun blastema hücre kondrojenezi üzerindeki etkilerini test etmek için farmakolojik ajanlar kullanıldı (Ek Şekil XNUMXc). 6). Kertenkeleler, 28 gün boyunca Hh inhibitörü siklopamin, Hh düzleştirilmiş agonist (SAG) veya araç kontrolü ile tedavi edildi. Kuyruklar daha sonra toplandı ve brüt morfoloji ile analiz edildi (Ek Şekil SXNUMX). 6a-c) ve histoloji/FISH ifadesi için col2a1, olgun kıkırdak farklılaşmasının bir belirteci, şşş, yenilenen kuyruklardaki baskın Hh sinyali ve fabp7, bir ependimal hücre işaretleyicisi (Ek Şekil. 6 gün – l).
Taşıt kontrolü ile tedavi edilen kertenkeleler, silindir şeklinde tipik rejenere kuyruklar geliştirdi. col2a1+ çevreleyen kıkırdak tüpleri şşş+ fabp7+ ependimal tüpler (Ek Şekil. 6a, d, g, h). Siklopamin ile tedavi edilen kertenkeleler normal uzunlukta kuyruklar çıkardılar, ancak kıkırdakları tamamen eksikti. şşş ependimal tüplerle ifade (Ek Şekil XNUMX). 6b, e, ben, j). Tersine, SAG ile tedavi, bol miktarda c ile dolu bodur, soğanlı kuyruklarla sonuçlandı.ol2a1+ endojen kıkırdak tüplerine ek olarak ektopik kıkırdak bölgeleri (Ek Şek. 6c, f, k, l). Ne Hh inhibisyonu ne de aktivasyon etkilenmedi şşş tarafından ifade fabp7+ ependimal hücreler (Ek Şekil. 6 saat, j, l), blastema FCTC kondrojenezindeki değişikliklerin doğrudan ilaç tedavilerinden kaynaklandığını gösterir. SAG kaynaklı kıkırdak, kertenkelenin başka hiçbir yerinde gözlenmedi ve blastemadan türetilen kuyruk bölgelerine özgüydü. Bu sonuçlar, Hh sinyalinin blastema FCTC'lerde kondrojenezi indüklemek için gerekli ve yeterli olduğunu ve blastema hücrelerinin büyük bir kısmının kıkırdak farklılaşma yeteneğine sahip olduğunu gösterdi. SAG tedavisinden gelen eksojen Hh sinyalleri, endojen sinyallemeye yanıt olarak tipik olarak kıkırdak oluşturan bölgelerin ötesine pro-kondrojenik alanları genişletir.
Daha sonra, Hh aktivatörlerinin/inhibitörlerinin kertenkele uzuv ve kuyruk FCTC'lerinin gen ekspresyonu ve kondrojenik potansiyel üzerindeki etkileri karşılaştırıldı. Kertenkele kuyrukları ve uzuvları, siklopamin, SAG veya araç kontrolü ile tedavi edilen hayvanlardan 28 DPA toplandı ve histoloji/ISH ile analiz edildi. col2a1, spp1ve GLI ailesi çinko parmak 1 (gli1) ifadesi (Ek Şekil. 7). Yukarıda açıklandığı gibi, kontrol kuyrukları geliştirildi col2a1+ kıkırdak tüpleri. Kıkırdak tüpü gelişimi, siklopamin tedavisi ile inhibe edildi ve SAG tedavisi ile genişletildi, bu da kapsamlı ektopik kıkırdak oluşumuna neden oldu (Ek Şekil XNUMXc). 7a, gr, m). Kuyruk FCTC'leri korunur spp1 ekspresyon 28 DPA ve ekspresyon, siklopamin veya SAG işleminden etkilenmedi (Ek Şekil XNUMXa). 7b, h, n).
Kuyruk blastema hücrelerinin doğrudan aksine, uzuv fibroblastları eksprese etmedi. col2a1 veya test edilen koşullardan herhangi birinde kondrojeneze uğrar (Ek Şekil XNUMX). 7d–f, j–l, p–r). Spesifik olarak, SAG ile tedavi edilen gruplarda ektopik kıkırdak oluşmadı (Ek Şekil XNUMXa). 7p). Ayrıca, uzuv FCTC spp1 ekspresyon 28 DPA'da korunmadı ve Hh sinyallemesine duyarlı değildi (Ek Şekil XNUMXa). 7e, k, q). Gli1, Hh sinyal yolunun bir aşağı akış muhabiri ve Hh yolu aktivasyonunun yerleşik bir okuması68, doğal olarak kontrol kuyruklarında ifade edildi (Ek Şekil SXNUMX). 7c), kontrol uzuvlarında ifade yokken (Ek Şekil SXNUMX). 7f) ve hem uzuv hem de kuyruk Hh inhibitörü siklopamin tedavi örneklerinde (Ek Şekil SXNUMX). 7i, ben). SAG ile tedavi edilen kuyruk ve uzuvların her ikisi de yüksek seviyelerde gli1 aktivasyon (Ek Şek. 7o, r), SAG tedavisinin hem kuyrukta hem de uzuvda bir Hh yolu aktivatörü olarak doğrulanması. Bu sonuçlar, kuyruk blastemal FCTC'lerin aksine, kesilmiş uzuv fibroblastlarının, SAG tedavisi ile yeterli Hh yolu aktivasyonuna dair kanıtlara rağmen, Hh'ye yanıt veren kondrojenik potansiyelden yoksun olduğunu gösterdi.
Yukarıda tanımlanan tek hücreli dizileme sonuçları sülf1, plp, sall1, ve spp1 kertenkele kuyruğu FCTC blastema belirteçleri olarak. Sülf1 diğer sistemlerde Hh stimülasyonu ile düzenlendiği bildirilmektedir60,64,69ve burada, Hh inhibisyonunun ve aktivasyonunun tail blastema marker ekspresyonu üzerindeki etkilerini test ettik (Şekil XNUMXb). 3). Doğal olarak blastem oluşturmayan kesilmiş kertenkele uzuvları, blastemaya özgü belirteçleri spesifik olmayan iyileşme tepkilerinden ayırmak için analizlere dahil edildi.8,70,71,72 (İncir. 3 dk–x). Kuyruk blastemi ve uzuv örnekleri, siklopamin, SAG veya araç kontrolü ile tedavi edilen aynı kertenkelelerden 14 DPA toplandı ve histoloji/ISH ile analiz edildi. sülf1, plp, sall1, ve spp1 işaretleyici ifade modelleri arasında gözlemlenen herhangi bir Hh sinyal bağımlılıkları için bağlam sağlamak.
Temsili sagital bölümleri a-l kuyruk ve m-x kertenkelelerden toplanan uzuv örnekleri (A. carolinensis) 14 DPA ile işlenmiş a-d, m-p araç kontrol, e-h, q-t Kirpi inhibitörü siklopamin ve i-l, u-x Kirpi pürüzsüzleştirilmiş agonist, SAG ve histoloji/ISH ile analiz edildi. sulf1, spp1, pltp, ve sall1. n = Tedavi koşulu başına 5 kertenkele. ve ependimal tüp, sc omurilik, tb tibia, ve vertebra. Çubuk = 500 mikron.
Kontrol kuyruk patlamaları ifade edildi sülf1, spp1, plp, ve sall1 (İncir. 3a-d). spp1 blastemalar boyunca yüksek seviyelerde ifade edilirken, plp ve sall1 nispeten daha düşük seviyelerde ifade edildi (Şek. 3b-d). Sülf1 ependimal tüpleri çevreleyen alanlarda, özellikle apikal blastemlerde ve kıkırdak öncesi tüp yoğunlaşmalarında lokalize olmak üzere en belirgin ifade modelini sergiledi (Şekil XNUMXa). 3a). Siklopamin tedavisi tail blastema'yı önemli ölçüde azalttı sülf1 ifade (Şek. 3e) ancak test edilen diğer belirteçleri etkilemedi (Şek. 3f-h). Tersine, SAG tedavisi artmış ve genişlemiştir. sülf1+ blastema alanları (Şek. 3i), özellikle dorsal ve proksimal blastema bölgelerinde, ancak etkilemedi spp1, plpya da sall1 ifade (Şek. 3j – l).
Kesilmiş uzuv FCTC'leri yüksek seviyelerde ifade etti spp1 (İncir. 3n), Fakat sülf1, plp, ve sall1 kontrol koşulları altında uzuvlarda yoktu (Şek. 3m, a, p). Test edilen gen markörlerinin ekspresyonu, uzuvlarda ne siklopamin ne de SAG işlemlerinden etkilenmedi (Şekil XNUMXb). 3ç–x) ve kuyruk blastema hücrelerinin aksine, kesilmiş uzuv FCTC'leri artmadı sülf1 SAG tedavisine yanıt olarak ifade (Şek. 3u). Bu sonuçlar, 14 DPA kuyruk numunelerinin gerçek zamanlı polimeraz zincir reaksiyonu (RT-PCR) analizi yoluyla kantitatif olarak doğrulanmıştır. sulf1, spp1, pltp ve sall1 (Ek Şekil. 8). Birlikte ele alındığında, bu sonuçlar tespit edildi sülf1, plp, ve sall1 Spesifik blastema belirteçleri olarak. Sülf1 Hh stimülasyonuna ve inhibisyonuna özellikle yanıt veren, test edilen tek blastema belirteciydi. Sp1 ayrıca yara iyileşmesi ile uyarılan yaralanma durumu FCTC'lerinin genel bir belirteci olarak doğrulandı.
Sülf1 kondrojenik potansiyeli olan blastema FCTC'lerini işaretler
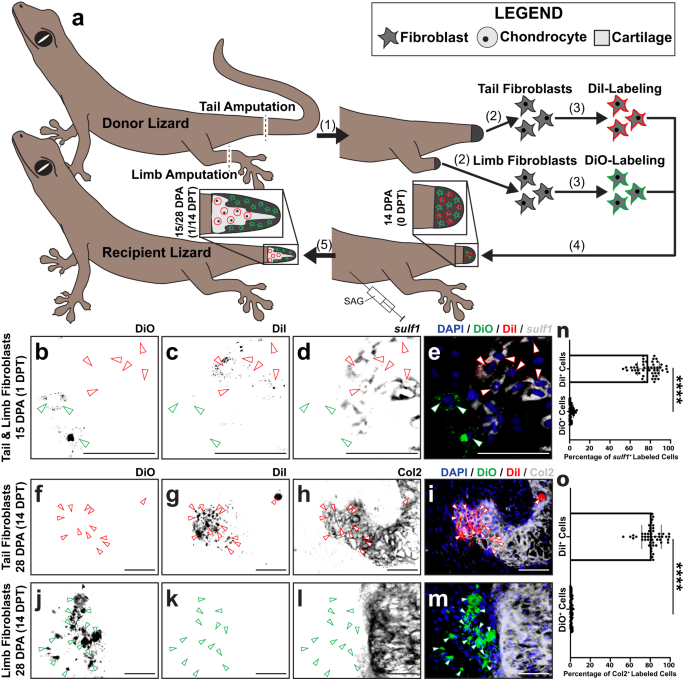
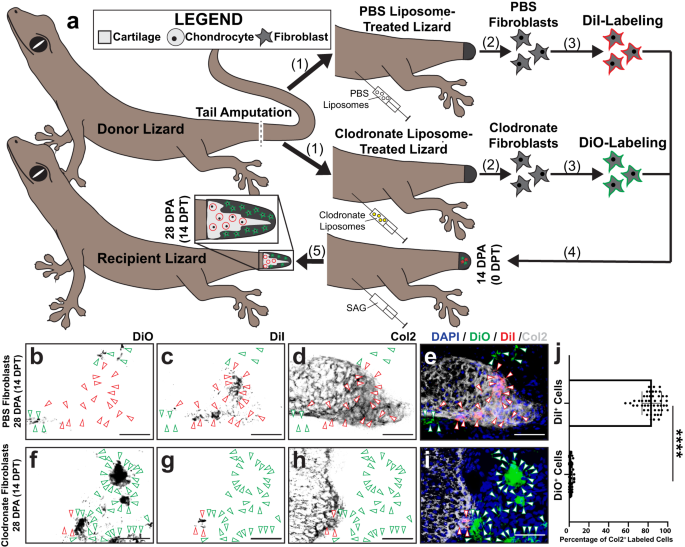
Daha sonra, daha önce kertenkele kuyruğu rejenerasyonu sırasında hücre kaderlerini izlemek için kurulmuş bir transplantasyon modelini kullanarak, in vivo yerel kuyruk çevresel sinyallemesinden bağımsız olarak hangi FCTC'lerin kıkırdak oluşturmaya yetkili olduğunu belirlemek için belirli kuyruk rejenerasyon aşamalarından FCTC'lerin kondrojenik kapasitesini değerlendirdik.73. Partenogenetik kertenkeleden toplanan hücreler Lepidodactylus lugubris Aynı klonal popülasyona ait kertenkelelerin kesilmiş kuyruk kütüklerine transplantasyonu takiben rejenere yapıları, immün baskılayıcı ilaç tedavilerine ihtiyaç duymadan sulandırın74, daha önce rejenerasyonu olumsuz etkilediği gösterildi24,75,76 (İncir. 4). Vericiden fibroblastlar izole edildi L. lugubris orijinal kuyruklar, blastema kuyrukları 14 DPA ve rejenere kuyruklar 28 DPA ve elde edilen izole hücre havuzları, fiziksel ve enzimatik hücre sindiriminin yanı sıra MACS® boncuk tedavileri kullanılarak FCTC popülasyonları için zenginleştirildi (Ek Şekil XNUMXa). 9). Her FCTC havuzu, DiI ile etiketlendi ve ayrı ayrı SAG ile tedavi edilen alıcı blastema kuyruklarına 14 DPA enjekte edildi. Nakilden 14 gün sonra (14 DPT, alıcı kertenkeleler 28 DPA) alıcı kuyrukları, immünofloresan boyama (IF) yoluyla Col2 için analiz edildi (Şek. 4a). Ne orijinal ne de yenilenmiş kuyruk fibroblastları Col2'ye dahil edilmedi+ 28 DPA ile kıkırdak (Şek. 4b–d, h–k), nakledilen blastema fibroblastlarının çoğu, orijinal ve rejenere kuyruk fibroblastlarından önemli ölçüde daha yüksek bir oranda kıkırdak elemanlarına dahil olan DiI etiketini ve Col2 ekspresyonunu birlikte boyadı (Şekil XNUMXb). 4e-g, k). Bu, blastema fibroblastlarının, homeostatik orijinal ve yenilenmiş kuyruk fibroblastlarına kıyasla, Hh stimülasyonuna yanıt olarak kıkırdak oluşturmak için benzersiz bir şekilde yetkin olduğunu ileri sürdü.
a için deneysel şema Lepidodactylus lugubris kuyruk fibroblast transplantasyonları. (1) Donör kertenkele kuyrukları kesilir. FCTC'ler orijinal kuyruklardan (0 DPA), blastema kuyruklarından (14 DPA) ve yenilenmiş kuyruklardan (28 DPA) izole edilir. (2) Her bir kuyruk FCTC havuzu, ayrı ayrı flüoresan DiI ile etiketlenir. (3) Etiketli FCTC havuzları, SAG ile muamele edilmiş alıcı kertenkelelerin kuyruk blastemlerine (14 DPA) ayrı ayrı nakledilir. (4) Nakil sonrası 14 günlük SAG tedavisinin (14 DPT) ardından, yenilenen kuyruklar Col2 immünofloresan boyama (IF) ve floresan mikroskobu yoluyla analiz edilir. b-j () 'dan türetilmiş DiI etiketli kuyruk FCTC'leri ile önceden enjekte edilmiş SAG ile işlenmiş kertenkeleler tarafından yeniden oluşturulan kuyrukların temsili histolojik ve floresan analizib-d) orijinal kuyruk, e-g blastema kuyrukları veya h-j yeniden oluşturulmuş kuyruklar, Col2 IF 14 DPT/28 DPA ile analiz edildi. DiI ve Col2 sinyalleri, ortak lokalizasyonu veya eksikliğini vurgulamak için ayrı ayrı ve birlikte sunulur. Yeşil ok uçları DiI'yi gösterir+ hücreler. Çubuk = 50 mikron. k Col2'ye dahil edilen DiI etiketli hücrelerin miktarının belirlenmesi+ kıkırdak bölgeleri 14 DPT. n = Her durum için 50 farklı hayvan/kuyruk örneğindeki beş görüntüden ölçülen 10 hücre sayısı. Veriler, ortalama değerler +/− standart sapma olarak sunulur. Eşit olmayan varyanslar için Welch'in tek yönlü ANOVA'sı ve Dunnett'in T3 çoklu karşılaştırma testleri kullanıldı. ****düzeltilmiş P < 0.0001 (Dunnett'in T3 çoklu karşılaştırma testleri). Kaynak veriler, Kaynak Veri dosyası olarak sağlanır.
Önceki çalışma, kertenkele blastema kondrojenezini düzenleyen Hh sinyalini göstermiştir.14, ve sülf1 kondrojenez sırasında ön yoğunlaşan mezenkimde eksprese edildiği bildirilmektedir.77, 78. Burada, ortak yerelleştirmeyi test ettik sülf1 ile sox9, siklopamin, SAG ve araç kontrolü ile tedaviye yanıt olarak kertenkele kuyruğu blastemaları 14 DPA içinde kondrojenezi düzenleyen transkripsiyon faktörü. (Ek Şek. 10). Kontrol kuyruk blastemleri, proksimodistal gradyanlar sergiledi. sülf1 ve sox9 ependimal tüpleri çevreleyen FCTC'lerde ifade (Ek Şekil SXNUMX). 10a, b). Sülf1 distal apikal blastema bölgelerinde lokalize olan ve yerini aldıkça proksimale doğru azalan ekspresyon sox9. sox9 amputasyon düzlemlerinde orijinal kuyruk omurlarına bitişik proksimal iskelet elemanlarında en güçlü ifadesini sergiledi. Siklopamin tedavisi hem azalttı sülf1 ve sox9 ekspresyonu ve kesintiye uğramış proksimodistal işaretleyici lokalizasyonları (Ek Şekil XNUMXa). 10c, d). SAG uygulanmış kuyruklarda, her ikisi de sülf1+ ve sox9+ alanlar, periferik olarak ependimal tüplerden çıkarılan bölgelere genişledi, ancak proksimodistal ekspresyon ilişkileri korundu (Ek Şekil XNUMXc). 10e, f).
Yukarıdaki sonuçlar, Hh sinyali arasında bir ilişki önerdi, sülf1 ekspresyon ve kondrojenez. Burada, yeteneklerini karşılaştırarak bu ilişkiyi test ettik. sülf1+ ve sülf1- kertenkele fibroblastları kullanılarak in vivo kondrogeneze uğrayacak L. lugubris transplantasyon modeli (Ek Şekil. 11). İlk olarak, donör orijinal (0 DPA) kuyruk ve uzuv FCTC'leri, sırasıyla DiI ve DiO floresan boyaları ile önceden etiketlendi. Etiketli kuyruk ve uzuv FCTC'leri karıştırıldı ve alıcı kertenkele kuyruğu amputasyonu (0 DPA) sırasında alıcı kertenkele kuyruklarına birlikte nakledildi. Alıcı kertenkeleler SAG ile tedavi edildi ve entegrasyon değerlendirmesi için kuyruklar 14 ve 28 DPT toplandı (Ek Şekil XNUMXa). 11a). 14 DPT örneğinin FISH ve histolojik analizi DiI gösterdi+ kuyruk ve DiO+ ekstremite kaynaklı fibroblastlar ifade edildi sülf1 (Ek Şekil. 11b–e, j). Benzer şekilde, hem DiI+ ve DiO+ Col2'yi oluşturan fibroblastlar+ IF tarafından değerlendirilen 28 DPT numunesindeki kıkırdak (Ek Şekil SXNUMX). 11f–i, k). Bu sonuçlar, hem kuyruk hem de uzuv fibroblastlarının, sülf1 blastema oluşum sürecine ve sinyal nişine maruz kaldığında ekspresyon ve kondrojenez.
Son olarak, yukarıdaki sonuçları, eksojen kuyruk blastemi ve uzuv FCTC'leri, zaten blastemalar oluşturmuş olan alıcı kuyruklarına nakledildiğinde gözlemlenen sonuçlarla karşılaştırdık. Vericiden izole edilen fibroblastlar L. lugubris sırasıyla DiI ve DiO ile önceden etiketlenmiş kuyruk blastemaları ve uzuvlar 14 DPA, SAG ile tedavi edilmiş alıcı kertenkele kuyruk blastemalarına birlikte nakledildi (Şekil XNUMXa). 5). Kuyruklar 1 ve 14 DPT toplandı ve eksprese edilen eksojen kuyruk blastemi ve uzuv fibroblastlarının yüzdelerini karşılaştırmak için yukarıda tarif edildiği gibi analiz edildi. sülf1 FISH veya Col2 aracılığıyla IF aracılığıyla (Şek. 5a).
a için deneysel şema L. lugubris tail blastema ve ampute uzuv fibroblast transplantasyonları. (1) Donör kertenkele kuyrukları ve sol arka uzuvları kesildi. (2) FCTC'ler kuyruk blastemlerinden ve uzuv güdüklerinden 14 DPA izole edilmiştir. (3) Kuyruk FCTC'leri DiI ile etiketlenirken, uzuv FCTC'leri DiO ile etiketlenir. (4) Etiketli FCTC'ler, SAG ile muamele edilmiş alıcı kertenkelelerin kuyruk blastemlerine (14 DPA) birlikte nakledilir. (5) Transplantasyon sonrası 1 ve 14 günlük SAG tedavisinin ardından, yenilenen kuyruklar şu şekilde analiz edilir: sülf1 FISH, Col2 IF ve floresan mikroskopisi. b-m DiI etiketli kuyruk FCTC'leri ve DiO etiketli uzuv FCTC'leri ile önceden enjekte edilmiş SAG ile işlenmiş kertenkeleler tarafından yeniden oluşturulan kuyrukların temsili histolojik ve floresan analizi, tarafından analiz edildi b-e sülf1 BALIK Transplantasyondan 1 gün sonra (DPT)/15 DPA ve f-m Col2 IF 14 DPT/28 DPA. DiI, DiO ve sülf1 veya Col2 sinyalleri, ortak lokalizasyonu veya eksikliğini vurgulamak için ayrı ayrı ve birlikte sunulur. Kırmızı ok uçları DiI'yi işaretler+ hücreler ve yeşil ok uçları DiO'yu gösterir+ hücreler. Çubuk = 50 mikron. n, o DiI- ve DiO-etiketli hücrelerin miktarının belirlenmesi (n) birlikte ifade etme sülf1 1 DPT ve o Col2'ye dahil edilmiş+ kıkırdak bölgeleri 14 DPT. n = Her durum için on farklı hayvan/kuyruk numunesi arasındaki beş görüntüden ölçülen 50 hücre sayısı. Veriler, ortalama değerler +/− standart sapma olarak sunulur. Eşlenmemiş iki yönlü t eşit olmayan varyanslar için Welch düzeltmeli testler kullanıldı. ****P < 0.0001. Kaynak veriler, Kaynak Veri dosyası olarak sağlanır.
1 DPT örneğinde DiI+ ile kollokalize edilmiş tail blastema kaynaklı fibroblastlar sülf1 ifade, DiO ise+ uzuvdan türetilen fibroblastlar yapmadı (Şek. 5b-e, n). Col14 ifadesi için IF yoluyla analiz edilen 2 DPT numunesi, Col2 oluşturan tail blastema FCTC'lerin önemli ölçüde daha yüksek yüzdelerini ortaya çıkardı+ Ekstremite fibroblastlarından daha kıkırdak (Şek. 5f-o). Kuyruk ve uzuv fibroblastları ayrıca kontroller olarak araç kontrolü veya SAG ile muamele edilmiş alıcı blastemlerine ayrı ayrı nakledildi (Ek Şekil XNUMXa). 12). Yalnızca SAG tarafından uyarılan kuyruk fibroblastları, DiI ve Col2'yi birlikte ifade etti (Ek Şekil XNUMXa). 12d–f, m), araç kontrol alıcılarına nakledilen kuyruk ve uzuv FCTC'leri ve SAG ile tedavi edilen alıcı blastemalarına nakledilen uzuv fibroblastları, Col2'yi ifade etmedi veya kıkırdak oluşturmadı (Ek Şekil XNUMXa). 12a–c, g–m). Birlikte ele alındığında, bu sonuçlar yeteneklerini doğruladı sülf1+ blastema FCTC'leri, ancak sülf1- uzuv FCTC'leri, Hh stimülasyonuna yanıt olarak kondrojeneze uğrar.
Kuyruk yeniden büyümesi, fagositlerin farklı lokalizasyonlarını içerir
Kertenkele kuyruğu rejenerasyonunun diğer tek hücreli dizileme analizleri, makrofajları ve diğer fagositik hücreleri araştırarak, diferansiyel marker gen ekspresyonu ve en yakın komşu kümeleme ile tanımlanan heterojenliği ve farklı hücre popülasyonlarını ortaya çıkardı (Ek Şekil XNUMXa). 13a-c). Ctsb+ katepsin K-negatif (ctsk-) makrofajlar ve ctsb+ ctsk+ beklendiği gibi diğer bağışıklık hücreleri ile kümelenmiş osteoklastlar (Ek Şekil XNUMXa). 13a, b). Ancak, ayrı bir ctsb- ctsk+ kollajen tip IV alfa 1 zinciri ile kümelenmiş popülasyon (col4a1+) perisitler (Ek Şekil. 13a-d). Miyeloid soydan ziyade perisitik bir soydan türetilen fagositik hücreler olan septoklast popülasyonlarının, daha önce memelilerde iskelet gelişimini ve iyileşmeyi düzenlediği gösterilmiştir.79, ve biz bunu varsaydık ctsb- ctsk+ col4a1+ hücreler, kertenkele septoklast benzeri fagositik hücreleri (burada septoklastlar olarak anılacaktır) temsil ediyordu.
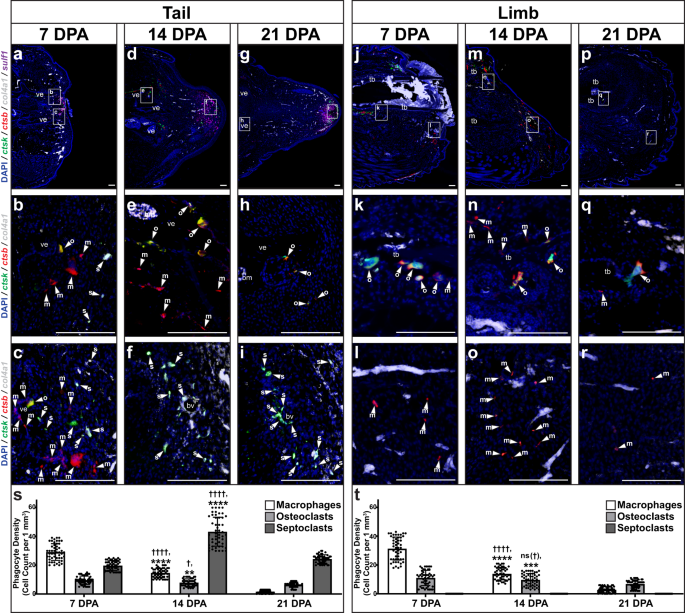
Tek hücre sıralama sonuçları, 7, 14 ve 21 DPA toplanan kertenkele kuyruklarında ve uzuvlarında histoloji/FISH yoluyla doğrulanmıştır. (İncir. 6). Ctsb+ ctsk- col4a1- kuyruklarda 7 DPA'da zirveye ulaşan makrofaj seviyeleri (Şekil XNUMXb). 6a – c, s) 21 DPA azalmadan önce (Şek. 6g–i, s). Ctsb+ ctsk+ col4a1- osteoklast popülasyon sayıları, 7 DPA azalmadan önce 14 ve 21 DPA'da kuyruklarda en yüksekti (Şekil XNUMXa). 6a–i, s). Kuyruk osteoklastları, periosteal yüzeyler boyunca klasik kriptleri işgal ederek, özel olarak omurlarla ilişkilendirildi (Şekil XNUMXb). 6a–i). Ctsb- ctsk+ col4a1+ Septoklast seviyeleri, 14 DPA'da blastema oluşumu sırasında kuyruklarda zirveye ulaştı (Şekil XNUMXb). 6a–i, s) ve arasında tespit edildi sülf1+ blastema fibroblast popülasyonları (Şek. 6a–i). Ek olarak, toplanan kuyruklar 0, 1, 3, 7 ve 14 DPA doğrulandı ctsb+ makrofaj ve osteoklast popülasyonları, immün hücre aktif enflamatuar aşama zaman noktaları 7-1 DPA aralığında 7 DPA'da zirveye ulaştı (Ek Şekil SXNUMX). 14). Bununla birlikte, kuyruk makrofajı ve osteoklastların aksine, kuyruklardaki yüksek septoklast sayıları blastema aşamalarının ötesinde de devam etti ve 21 DPA'da işgal edildi. sülf1+ yenilenen kuyruk uçlarındaki apikal bölgeler (Şek. 6g-i). Birlikte ele alındığında, bu sonuçlar septoklastlar ve blastema hücre durumu arasında bir ilişki olduğunu ortaya koydu.
Kertenkelenin temsili sagital bölümleri (A. carolinensis) a-i kuyruklar ve j-r toplanan uzuvlar a-c, j-l 7DPA, d-f, m-o 14 DPA ve g-i, p-r 21 DPA için histoloji/FISH ile analiz edilmiştir. ctsb, ctsk, col4a1, ve sülf1 ifade. İlgili bölgelerin daha yüksek büyütme görünümleri (a, d, g, j, m, p) vurgulama ctsb+ ctsk- col4a1- makrofajlar (m, ok başı), ctsb+ ctsk+ col4a1- osteoklastlar (o, ok başı) ve ctsb- ctsk+ col4a1+ yakın bölgelerdeki septoklastlar (s, ok başı) b, e, h omurk, n, q kaval kemiği, c, f, i distal kuyruk ve l, o, r distal uzuv. bm kemik iliği, bv kan damarı, tb tibia, ve vertebra. Çubuk = 100 mikron. s, t Kertenkelede ölçülen makrofaj, osteoklast ve septoklast yoğunluklarının miktarının belirlenmesi s kuyruklar ve t uzuvlar 7, 14 ve 21 DPA topladı. n = Her zaman noktası için 50 farklı hayvan/örnek arasındaki beş görüntüden ölçülen 10 hücre yoğunluğu. Veriler, ortalama değerler +/− standart sapma olarak sunulur. Eşit olmayan varyanslar için Welch'in tek yönlü ANOVA'sı ve Dunnett'in T3 çoklu karşılaştırma testleri kullanıldı. †ayarlanabilir P = 0.0139; ††††ayarlanabilir P < 0.0001; ns (†), önemli değil (düzeltilmiş P = 0.4663), karşılık gelen hücre tipi 7 DPA (Dunnett'in T3 çoklu karşılaştırma testleri) ile karşılaştırıldığında. **düzeltilmiş P = 0.0024; ***düzeltilmiş P = 0.0005; ****düzeltilmiş P < 0.0001, karşılık gelen hücre tipi 21 DPA (Dunnett'in T3 çoklu karşılaştırma testleri) ile karşılaştırıldığında. Kaynak veriler, Kaynak Veri dosyası olarak sağlanır.
Uzuvlar, zamanla eşleştirilmiş kuyruk hücresi popülasyonlarına benzer uzay-zamansal eğilimleri izleyen makrofaj ve osteoklast popülasyonları sergiledi (Şekil XNUMXb). 6). Ekstremite makrofajları, yara epidermisi ile ilişkilendirildi ve kemikle ilişkili osteoklastlarla birlikte, 14 DPA'da daha da azalmadan önce 21 DPA'dan önce zirveye ulaştı (Şekil XNUMXa). 6j–r, t). Bununla birlikte, uzuvlar, test edilen hiçbir zaman noktasında tanımlanabilir septoklastlar sergilemedi ve ifade etmedi. sülf1 (İncir. 6j–r, t). Yukarıda açıklanan kesilmiş kertenkele uzuvlarının sergilediği Hh'ye duyarlı kondrojenez eksikliği göz önüne alındığında, bu sonuçlar ayrıca kertenkele septoklastları, blastema oluşumu, sülf1 aşağıda daha ayrıntılı olarak incelenen ifade, Hh duyarlılığı ve kıkırdak oluşumu.
Blastema oluşumu ve kondrogenez fagositlere bağlıdır
Klodronat lipozom tedavilerini daha önce kertenkele fagosit/makrofaj popülasyonlarını tüketmek ve blastema oluşumunu inhibe etmek için etkili yöntemler olarak doğruladık. A. carolinensis9. Burada, klodronat lipozom tedavisinin makrofaj, osteoklast ve septoklast popülasyon seviyeleri ve kertenkele kuyruğu blastema oluşumu sırasında fibroblast marker ekspresyonu üzerindeki etkisini test ettik (Ek Şekil XNUMXc). 15). Kertenkeleler, kuyruk amputasyonundan 72 ve 48 saat önce klodronat veya araç kontrolü fosfat tamponlu salin (PBS) lipozomları ile ön işleme tabi tutuldu ve analiz için blastema aşaması 14 DPA'da kuyruklar toplandı.
Histoloji, klodronat lipozom tedavisinin, kontrollere kıyasla blastema oluşumunu inhibe ettiğini ortaya çıkardı (Ek Şekil SXNUMX). 15a, b, f, g) ve tükenmesine neden oldu ctsb+ ctsk- makrofajlar ctsb+ ctsk+ osteoklastlar ve ctsb- ctsk+ col4a1+ septoklastlar (Ek Şekil. 15c–e, h–j), beklenildiği gibi. Clodronate ile tedavi edilen kuyruklar da kayboldu spp1 ve sülf1 FCTC'lerde ifade (Ek Şekil. 15a, b, f, g). Kontrol blasteminde lokalize makrofajlar ve osteoklastlar ortaya çıktı. sülf1- septoklastlar ise sadece blastemanın distalinde tespit edilmiştir. sülf1+ kuyruğun alanları (Ek Şek. 15c-e). birlikte boyama spp1 ve sülf1 tedavi edilmemiş blastemde 7 ve 14 DPA'da ortaya çıktı spp1 hem 7 hem de 14 DPA'da ifade, geniş alanlar ise sülf1+ birlikte ifade edilen blastema hücreleri spp1, her iki işaretleyicinin de bir blastema FCTC alt popülasyonunda aktif olduğunu doğrulayarak (Ek Şekil SXNUMX). 16). Birlikte ele alındığında, bu sonuçlar kertenkele fagositik soyları ile FCTC işaretleyici gen edinimi arasında bir bağlantı kurdu.
Daha sonra, klodronat lipozom ön işleminin kertenkele FCTC'nin Hh sinyaline yanıt vermesi üzerindeki etkilerini test ettik. L. lugubris blastema fibroblast transplantasyon çalışmaları (Şek. 7). Bu modelin, endojen koşullar blastema/kıkırdak oluşumuna elverişli olmadığında, eksojen FCTC kondrojenik potansiyelini yerinde test etmek için özellikle uygulanabilir olduğu bulunmuştur. L. lugubris kertenkeleler, klodronat lipozomlarla ön işleme tabi tutuldu (Ek Şekil XNUMX'de doğrulandı). 17) veya amputasyondan önce kontrol PBS lipozomları ve fibroblastlar, 14 DPA kuyruklarından izole edildi. PBS ve klodronat lipozom ile tedavi edilmiş kertenkelelerden toplanan fibroblastlar, ayrı bir SAG ile tedavi edilmiş alıcı kertenkele blasteması kohortuna birlikte nakledilmeden önce sırasıyla DiI veya DiO ile önceden etiketlendi (Şekil XNUMXb). 7a).
a Kertenkelelerde klodronat lipozom tedavileri ve fibroblast transplantasyonları uygulamak için deneysel şema (L. lugubris) blastema hücre kondrojenezinin fagosit popülasyonları üzerindeki bağımlılıklarını araştırmaya yönelik. (1) PBS lipozomu ve klodronat lipozomu uygulanmış donör kertenkelelerinin kuyrukları kesilir. (2) Kuyruk fibroblastları, PBS lipozomu ve klodronat lipozomu uygulanmış kertenkele kuyrukları 14 DPA'dan izole edilir. (3) PBS kertenkeleden türetilen fibroblastlar DiI ile etiketlenirken klodronat fibroblastlar DiO ile etiketlenir. (4) İşaretli hücreler alıcı SAG ile tedavi edilmiş kertenkelelerin 14 DPA kuyruk blastemine birlikte nakledilir. (5) Nakil sonrası 14 günlük SAG tedavisinin ardından, yenilenen kuyruklar Col2 IF ve floresans mikroskobu ile analiz edilir. b-i DiI etiketli PBS lipozom ile işlenmiş FCTC'ler ve DiO etiketli klodronat lipozom ile işlenmiş FCTC'ler ile önceden enjekte edilmiş ve histoloji, DiI ve DiO floresansı ve Col2 IF 14 DPT/28 DPA ile analiz edilmiş SAG ile tedavi edilmiş kertenkeleler tarafından yeniden oluşturulan kuyrukların temsili histolojik analizi . Çubuk = 50 mikron. j Col2 14 DPT'yi birlikte ifade eden DiI- ve DiO-etiketli hücrelerin miktarının belirlenmesi. n = Her durum için on farklı hayvan/kuyruk arasında beş görüntüden ölçülen 50 hücre sayısı. Veriler, ortalama değerler +/− standart sapma olarak sunulur. Eşlenmemiş iki yönlü t eşit olmayan varyanslar için Welch düzeltmeli test kullanıldı. ****P < 0.0001. Kaynak veriler, Kaynak Veri dosyası olarak sağlanır.
Yazılar 14 DPT toplandı ve DiO katkısı açısından analiz edildi+ ve DiI+ hücrelerin kıkırdak oluşumuna (Şek. 7b–j). Önemli ölçüde daha yüksek DiI seviyeleri+ kontrol kuyruğu FCTC'leri, Col2'ye dahil olan kondrojenez geçirdi+ DiO ile karşılaştırıldığında yoğunlaşan kıkırdak alanları+ klodronat ile muamele edilmiş FCTC'ler, blastema fibroblastlarının kıkırdak bölgelerine katkıda bulunduğunu, ancak blastemleri olmayan klodronat ile muamele edilmiş kuyruklardan türetilen fibroblastların yapmadığını düşündürür (Şekil XNUMXb). 7b–j). SAG veya araç kontrolü ile tedavi edilen alıcı blastemalarına ayrı ayrı nakledilen klodronat ve PBS lipozomla tedavi edilmiş fibroblastlar, benzer sonuçlar verdi (Ek Şekil XNUMXa). 18), yalnızca Col2'ye dahil olan PBS lipozom ile işlenmiş fibroblastlar ile+ kıkırdak (Ek Şekil. 18d–f, m), SAG ile tedavi edilen alıcılardaki klodronat lipozom fibroblastları ve araç kontrol blastemasına nakledilen PBS veya klodronat lipozomla tedavi edilen fibroblastlar Col2'yi ifade etmedi (Ek Şekil XNUMXa). 18a–c, g–m). Birlikte ele alındığında, bu sonuçlar, kertenkele blastema hücresi Hh'ye yanıt veren kondrojenezin, fagosit popülasyonları tarafından ön şartlandırmaya bağımlılığını ortaya koydu.
Fagosit şartlandırılmış ortam, blastema oluşumunu kurtarır
Fagosit popülasyonlarını birden fazla kertenkele dokusundan izole etmek ve ayırt etmek için daha önce protokoller oluşturduk.9. Septoklastları perisitlerle ilişkilendiren yukarıda açıklanan kanıtlar göz önüne alındığında, perisit açısından zengin kuyruk kan damarlarının etkili septoklast kaynakları olduğunu varsaydık. Kaudal kan damarları kertenkele kuyruklarından izole edildi ve fagosit izolasyon protokollerine tabi tutuldu. Kertenkele kemik iliği, daha önce doğrulandığı gibi bir makrofaj kaynağı olarak kullanıldı.9. Kaudal kan damarlarından ve kemik iliği hücrelerinden farklılaşan fagositler, fagositoz deneyleri, akış sitometrisi ve Ctsk için IF/FISH ile analiz edildi, ctsb, integrin alt birim alfa M (itgam/cd11b), ve col4a1 ifadesi (Ek Şekil. 19).
Hem kaudal damar hem de kemik iliği kaynaklı hücreler, benzer şekilde yüksek seviyelerde fagositoz sergilediler (Ek Şekil XNUMXa). 19a – c, g) ve ifade itgam/cd11b (Ek Şekil. 19d, saat), kimliklerini fagositler olarak doğrulamak. Bununla birlikte, kan damarı ve kemik iliği fagositleri, in vivo olarak gözlenen farklılıkları yansıtan farklı işaretleyici ifadeler sergiledi (Ek Şekil XNUMXa). 19d–f, h–j); kemik iliği fagositleri eksprese edilmiş makrofaj belirteci ctsb (Ek Şekil. 19d-f), kaudal damar fagositleri ise septoklast belirteçleri Ctsk ve col4a1 (Ek Şekil. 19sa–j). Akış sitometrisi, ilgili makrofaj ve septoklast popülasyonlarının saflığını doğruladı; kemik iliği fagosit havuzlarındaki hücrelerin ortalama %94.5'i Ctsb ifade ediyor+ Ctsk- makrofaj imzaları ve kaudal damar fagosit hücrelerinin %98'den fazlası Ctsb ifade etti- Ctsk+ septoklast imzaları (Ek Şek. 19k–p). Birlikte ele alındığında, bu sonuçlar doğrulandı ctsb- ctsk+ col4a1+ septoklastlar olarak kaudal kan damarı kaynaklı fagosit kültürleri ve ctsb+ ctsk- col4a1- makrofajlar olarak kemik iliği kaynaklı fagosit kültürleri.
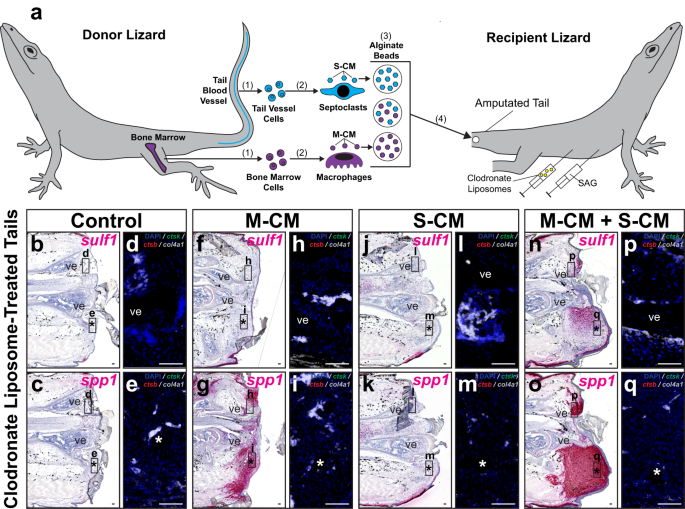
Daha sonra, septoklast popülasyonlarının, Hh-duyarlı tarafından tanımlanan kertenkele kuyruğu blastema hücresi kondrojenik potansiyel durumunu kurtarma yeteneklerini test ettik. sülf1 ekspresyonu, klodronat lipozom tedavisinin ardından (Şek. 8 ve Ek Şekil. 20). Makrofaj koşullu ortam (M-CM) ve septoklast koşullu ortam (S-CM), sırasıyla kemik iliği ve kaudal damar türevli fagositlerden toplandı ve konsantre edildi. Konsantre M-CM ve/veya S-CM'ye batırılmış aljinat tanecikleri, klodronat lipozomları ve SAG ile birlikte işleme tabi tutulmuş kertenkelelerin kesilmiş kuyruklarına implante edildi (Şekil XNUMXc). 8a) veya araç kontrolü (Ek Şek. 20a). İmplantasyondan 14 gün sonra kuyruklar toplandı ve histoloji/ISH/FISH ile analiz edildi. sülf1 ve spp1 ekspresyon ve fagositik hücre belirteçleri (Şek. 8b–q ve Ek Şekil. 20b–q).
a Makrofaj ve septoklast popülasyonları tarafından salgılanan biyomoleküllerin klodronat lipozomla işlenmiş kertenkelede FCTC gen ekspresyonu üzerindeki etkilerini test etmek için deneysel şema (A. carolinensis) kuyruklar. (1) Kemik iliği ve kuyruk kan damarı hücreleri donör kertenkelelerden izole edilir ve (2) in vitro olarak sırasıyla makrofajlara ve septoklastlara farklılaştırılır. (3) Makrofaj ve septoklast koşullu ortam (sırasıyla M-CM ve S-CM) toplanır, konsantre edilir ve hem ayrı ayrı hem de birlikte aljinat tanecikleri tarafından emilir. (4) Aljinat tanecikleri, klodronat lipozomlar ve SAG ile birlikte tedavi edilen kertenkelelerin kesilmiş kuyruklarına (0 DPA) implante edilir. b-q SAG ve klodronat lipozomlarla birlikte tedavi edilen, M-CM ve/veya S-CM boncukları implante edilen ve histoloji/ISH/FISH yoluyla analiz edilen kertenkele kuyruklarının temsili sagittal kesitleri 14 DPA sulf1, spp1, ctsk, ctsb, ve col4a1 ifade. Daha yüksek büyütme floresan görünümleri (b, c, f, g, j, k, n, o), sırasıyla, belirtilen bölgeleri gösterir d, h, l, p omur ve e, i, m, q implante boncuklar. n = Test edilen tedavi koşulu başına 8 kertenkele/numune. *, implante edilmiş boncuğun yeri; ve, omur. Çubuk = 50 mikron.
Sp1 SAG/araç kontrol tedavisinden bağımsız olarak M-CM ile işlenmiş kuyruklarda sinyal tespit edildi (Şekil XNUMXb). 8 gr ve Ek Şekil. 20 gr), ancak yalnızca S-CM ile tedavi edilen koşullarda yoktu (Şekil XNUMXc). 8k ve Ek Şekil. 20k). Sülf1 ifadesi yalnızca SAG ve hem M-CM hem de S-CM ile birlikte tedavi edilen kuyruklarda tespit edildi (Şekil XNUMXb). 8n ve Ek Şekil. 20n). Sp1+ ve sülf1+ M-CM ve S-CM ile işlenmiş numunelerde implante edilmiş boncukların etrafında yoğunlaşan kuyruk bölgeleri (Şekil XNUMXa). 8g, n, veya). endojen ctsb+ ctsk- col4a1- makrofajlar ctsb+ ctsk+ col4a1- osteoklastlar ve ctsb- ctsk+ col4a1+ klodronat lipozom tedavisi nedeniyle beklendiği gibi, test edilen koşulların hiçbirinde septoklastlar tespit edilmedi (Şekil XNUMXa). 8 ve Ek Şekil. 20).
Koşulsuz kültür ortamına batırılmış boncuklar, bir kontrol olarak kullanıldı ve klodronat lipozomla işlenmiş kuyruklara implante edildi (Ek Şekil XNUMXa). 21), herhangi bir değişiklik göstermeden spp1 or sülf1 araç kontrolünde veya SAG ile muamele edilmiş alıcı kuyruklarında ifade (Ek Şekil XNUMXa). 21a-d), fagosit koşullu ortam tedavilerinin, tek başına boncuk implantasyonu veya kültür ortamından ziyade gen ekspresyonundaki değişikliklerden sorumlu olduğunu belirtmek. Birlikte ele alındığında, bu sonuçlar, kertenkele septoklastları tarafından salgılanan biyomoleküllerin, aşağıdakiler de dahil olmak üzere blastema oluşumunun ayırt edici özelliklerini kurtarmak için gerekli olduğunu gösterdi. sülf1 endojen septoklast popülasyonları tükendiğinde bile Hh stimülasyonuna yanıt olarak ekspresyon. Makrofaj salgılayan faktörler FCTC'yi indüklemek için yeterliyken spp1 ifade sülf1 sadece hem makrofaj hem de septoklast ile şartlandırılmış ortamla tedavi edilen kuyruklarda tespit edildi; bu, blastema oluşumu sırasında FCTC işaretleyici gen ekspresyonunun sıralı bir şekilde eklendiğini gösterir.
Septoclast-CM, kesilmiş uzuvlarda kıkırdak oluşumunu indükler
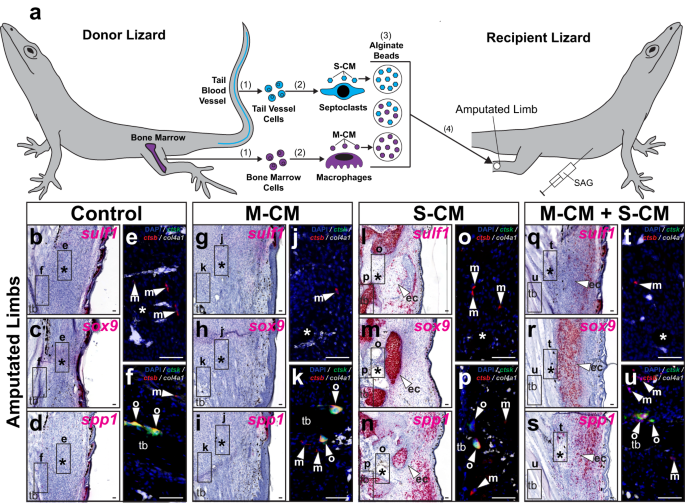
Kesilmiş kertenkele kuyruğu ve uzuv iyileşmesinin yukarıdaki karşılaştırmaları, FCTC kondrojenezi ile septoklast popülasyonları arasında bir bağlantı olduğunu ve burada S-CM'nin kertenkele uzuvları üzerindeki etkilerini öne sürdü. sülf1, spp1, ve sox9 ifadesi test edildi (Şek. 9 ve Ek Şekil. 22). S-CM ve/veya M-CM'ye batırılmış boncuklar, kertenkele uzuvlarına 7 DPA implante edildi. SAG ile 21 günlük tedaviden sonra (Şek. 9) veya araç kontrolü (Ek Şek. 22), uzuvlar toplandı ve FCTC ve kondrogenez işaretleyici ekspresyonu için histoloji/ISH yoluyla ve fagosit işaretleri için FISH aracılığıyla analiz edildi (Şekil XNUMXa). 9a ve Ek Şekil. 22a).
a Makrofaj ve septoklastla şartlandırılmış ortamın kertenkeledeki doğal fibroblastlar üzerindeki etkilerini test etmek için deneysel şema (A. carolinensis) uzuvlar. (1) Kemik iliği ve kuyruk kan damarı hücreleri izole edilir ve (2) sırasıyla in vitro makrofajları ve septoklastları türetmek için kullanılır. (3) Makrofajlar ve septoklastlar (M-CM ve S-CM) tarafından şartlandırılmış ortam toplanır, konsantre edilir ve hem ayrı ayrı hem de birlikte aljinat tanecikleri tarafından emilir. (4) Aljinat tanecikleri, SAG ile tedavi edilen kertenkelelerin 7 DPA kesilmiş uzuvlarına implante edilir. b-u SAG ile tedavi edilen, M-CM ve/veya S-CM boncukları implante edilen ve histoloji/ISH/FISH yoluyla analiz edilen kertenkele uzuvlarının temsili sagital kesitleri 28 DPA sulf1, sox9, spp1, ctsk, ctsb, ve col4a1 ifade. Daha yüksek büyütme floresan görünümleri (b-d, g-i, l-n, q-s), sırasıyla, belirtilen bölgeleri gösterir e, j, o, t implante boncuklar ve f, k, p, u kaval kemiği n = Test edilen tedavi koşulu başına 8 kertenkele/numune. *, implante edilmiş boncuğun yeri; ec (ok başı), ektopik kıkırdak; m (ok başı), makrofaj; o (ok başı), osteoklast; tb, kaval kemiği. Çubuk = 50 mikron.
Kontrol uzuvlarında ve S-CM olmadan M-CM boncukları implante edilmiş uzuvlarda FCTC'ler ifade etmedi sülf1, sox9ya da spp1 SAG/araç kontrol işlemlerinden bağımsız olarak (Şek. 9b–d, g–i ve Ek Şekil. 22b–d, g–i). M-CM'li ve M-CM'siz implante edilmiş S-CM boncukları, FCTC'yi indükledi sülf1 ve sox9 boncuk implantasyon bölgeleri çevresinde ifade, ancak yalnızca SAG ile birlikte tedaviye yanıt olarak (Şekil XNUMXa). 9 l, m, q, r ve Ek Şekil. 22 l, m, q, r). S-CM boncukları, yine M-CM ilavesinden bağımsız olarak indüklenmiş spp1 hem SAG hem de araç kontrolü ile tedavi edilen kertenkelelerin uzuvlarında ifade (Şek. 9n, s ve Ek Şekil. 22n, s). Test edilen tüm koşullarda endojen makrofajlar ve osteoklastlar tespit edildi, ancak septoklastlar tespit edilmedi ve seviyeler, şartlandırılmış ortam tipine bakılmaksızın ilaç veya boncuk muamelesinden etkilenmedi (Şekil XNUMXb). 9 ve Ek Şekil. 22).
Koşulsuz ortam tedavisi, araç kontrolünde veya SAG ile tedavi edilmiş alıcı uzuvlarda gen ekspresyonu değişikliklerini veya kondrojenezi indüklemedi (Ek Şekil XNUMXc). 21e-j). Bu sonuçlar, eksojen septoklast kaynaklı sinyallerin, doğal olarak septoklast eksikliği olan ampute uzuv ortamını desteklemek için gerekli ve yeterli olduğunu ve kesilmiş kertenkele uzuvlarına Hh'ye duyarlı kondrojenezi tanıttığını gösterdi. Kertenkele septoklast hücre faktörleri de korunur spp1 kertenkele uzuvlarında en az 28 DPA'ya kadar ifade. (İncir. 9n, s ve Ek Şekil. 22n, s). kaybından beri spp1 kertenkele uzuv FCTC'leri 28 DPA'nın ifadesi, 28 DPA'nın skar oluşumu ile çakışır (Ek Şekil XNUMXa). 7k), bu sonuçlar kertenkele septoklast popülasyonlarının fibrozisin inhibisyonunda bir rolü olduğunu düşündürür.
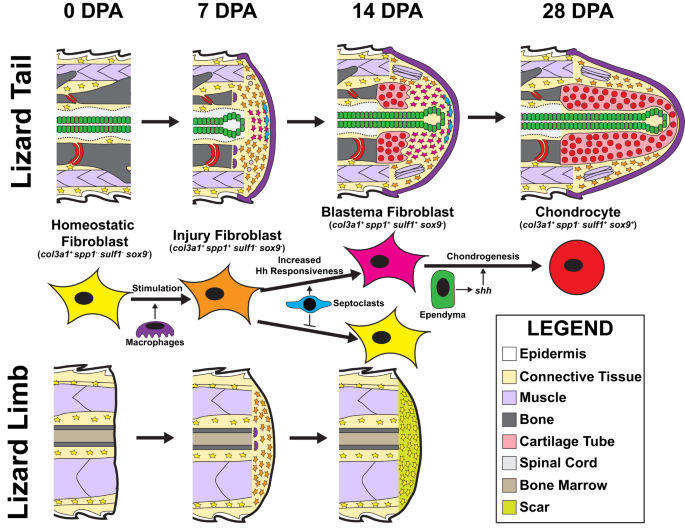
Özet olarak, yukarıda açıklanan sonuçlar, kertenkele kuyruğu blastemal oluşumu sırasında aşağıdaki sıralı fibroblast işaretleyici gen edinme mekanizmalarını önermektedir (Şekil XNUMXb). 10). Col3a1+ Hem kuyrukta hem de uzuvda dinlenen fibroblastlar, amputasyon yaralanmasına şu ifadeyle yanıt verir: spp1gibi diğer yaralanma durumu FCTC işaretleyici genleri ile birlikte col12a1 ve MDK. Yaralanma durumu FCTC'leri, makrofaj popülasyonlarının sızması ve makrofaj tarafından salgılanan faktörlerden sinyal verilmesinin ardından amputasyon bölgelerine göç eder. Kertenkele kuyrukları, ancak uzuvlar, artan FCTC Hh duyarlılığına neden olan amputasyon yaralanmalarını takiben septoklast hücre popülasyonları sergiler. Septoklast tarafından salgılanan faktörlere maruz kalan FCTC'ler korunur spp1 ve ifade etmek sülf1 ve sox9 tarafından uyarıldıktan sonra şşş, ependimal hücreler tarafından üretilir. Bu uzamsal modelleme, blastema ependimal tüplerinin çevresinde kıkırdak oluşumuyla sonuçlanır. Septoklastlar olmadan, kesilmiş uzuv FCTC'leri korumaz spp1 ifade ve Hh sinyaline tepkisiz kalır. Ekstremite FCTC'leri ifade etmez sülf1 veya eksojen Hh sinyalleriyle tedavi edildiğinde bile kondrojeneze uğrar ve sonuçta kıkırdak yerine yara izleri oluşur.
Col3a1+ homeostatik orijinal kuyruk FCTC'leri (0 DPA) makrofaj parakrin sinyalleri tarafından uyarılır ve ifade eder spp1 7 DPA ile yaralanmaya yanıt olarak. Kuyruk septoklastları tarafından salgılanan faktörler spp1 FCTC'lerde ekspresyon ve blastema ependimal tüplerin katkıda bulunduğu Hedgehog (Hh) sinyallerine karşı FCTC duyarlılığını arttırır. Hh stimülasyonu indükler sülf1 septoklastla uyarılan blastema FCTC'lerde 14 DPA ile ekspresyon. Sülf1+ FCTC'ler, Hh sinyallerine yanıt olarak kondrojenik bir programa girer ve eksprese eder. sox9 ve col2a128 DPA ile kondrositlere farklılaşır. Kesilmiş kertenkele uzuvları, FCTC mobilizasyonu ve durum değişiklikleri sergileyen, ancak kondrojenez göstermeyen rejeneratif olmayan ekler olarak kuyruk blastema oluşumu ve yeniden büyümesi için bağlam sağlar. Col3a1+ homeostatik uzuv fibroblastları ekspres spp1 amputasyonun ardından makrofaj infiltrasyonuna yanıt olarak 7 DPA'da. Fakat, spp1 Kesilmiş kertenkele uzuvlarında bulunmayan septoklastlardan uyarı olmadan ifade korunmaz. Septoklast tarafından salgılanan faktörlere maruz kalmadan, uzuv FCTC'leri kaybeder spp1 14 DPA ile ifade, Hh sinyaline tepkisiz kalır ve ifade etmez sülf1 veya kondrojenez geçirir. Bunun yerine, kesilmiş kertenkele uzuvları yara izleri oluşturur.
- SEO Destekli İçerik ve Halkla İlişkiler Dağıtımı. Bugün Gücünüzü Artırın.
- PlatoData.Network Dikey Üretken Yapay Zeka. Kendine güç ver. Buradan Erişin.
- PlatoAiStream. Web3 Zekası. Bilgi Genişletildi. Buradan Erişin.
- PlatoESG. Otomotiv / EV'ler, karbon, temiz teknoloji, Enerji, Çevre, Güneş, Atık Yönetimi. Buradan Erişin.
- PlatoSağlık. Biyoteknoloji ve Klinik Araştırmalar Zekası. Buradan Erişin.
- ChartPrime. Ticaret Oyununuzu ChartPrime ile yükseltin. Buradan Erişin.
- Blok Ofsetleri. Çevre Dengeleme Sahipliğini Modernleştirme. Buradan Erişin.
- Kaynak: https://www.nature.com/articles/s41467-023-40206-z