15 Ağustos 2023, yazan Carmen Phillips
Agresif kan kanseri akut miyeloid lösemisi (AML) olan kişiler için tedavi seçenekleri, Gıda ve İlaç İdaresi'nden (FDA) alınan yeni bir onayla bir kez daha genişledi.
20 Temmuz'da ajans onayladı Quiartinib (Vanflyta) belirli bir değişikliğe sahip olan AML'li kişilerin başlangıç tedavisinin bir parçası olarak kemoterapi ile kombine gen denilen FLT3.
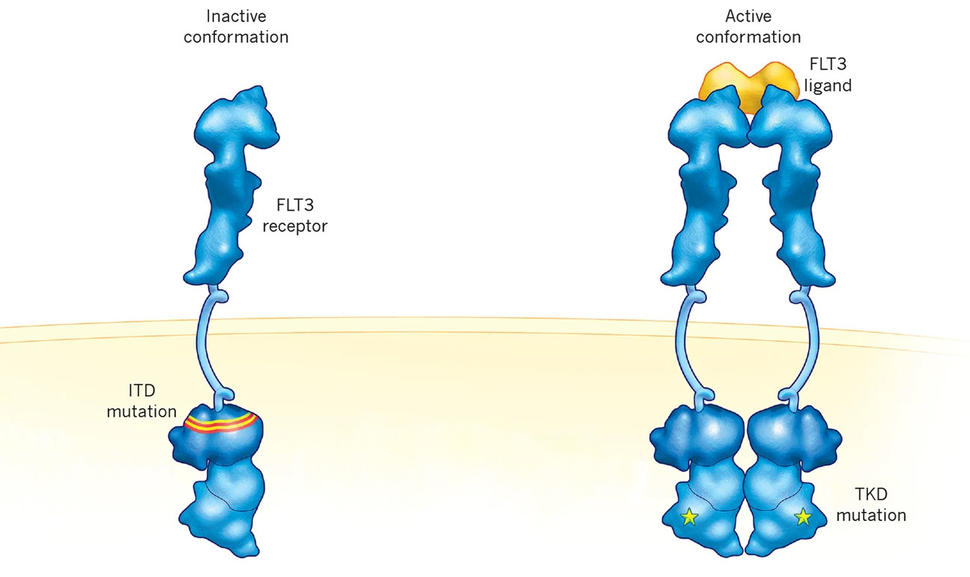
Genetik değişiklikler FLT3 AML teşhisi konan kişilerde yaygındır. bu FLT3 mutasyon İç tandem duplikasyon (ITD) olarak bilinen onay kapsamında, bu kanser teşhisi konan kişilerin yaklaşık dörtte birinde mevcuttur.
FDA'nın onayı, büyük bir klinik deneme Kuantum-Birinci olarak adlandırılır. AML'nin bu spesifik formuna sahip 500'den fazla kişinin dahil olduğu çalışmada, quizartinib artı standart kemoterapi alan katılımcılar, alanlara göre iki kattan daha uzun yaşadılar. standart tedavi tek başına: medyan 32 ay ve 15 ay. Deneme sonuçları Mayıs ayında yayınlandı Lancet.
Ajans ayrıca hastaları belirlemek için bir kan testini onayladı. FLT3 ITD mutasyonu. Bu tür testlere eşlik eden teşhis denir.
Nadir durumlarda, quizartinib kalp işlevinde potansiyel olarak ölümcül değişikliklere neden olabilir. Bu nedenle, onay kapsamında, ilaç adı verilen özel bir FDA güvenlik programının parçası olarak reçete edilmelidir. Risk Değerlendirme ve Azaltma Stratejileri (REMS).
FDA'nın kararı, quizartinib'i AML'li kişiler için başlangıç veya birinci basamak tedavi olarak onaylanan ikinci FLT3 hedefli ilaç haline getiriyor. İlk, midostaurin (Rydapt), 2017'de onaylandı. Üçüncü bir ilaç, Gilteritinib (Xospata), AML'yi tedavi etmek için de onaylanmıştır, ancak yalnızca kanseri ikinci basamak tedavi olarak bilinen daha önceki tedaviden sonra nüksetmiş kişiler için.
AML uzmanları, quizartinib'in onaylanmasının, kanserinde ITD mutasyonu olan kişiler için önemli bir yeni seçenek sunduğu konusunda genel olarak hemfikirdir. FLT3. Birçoğu, 60 yaşın üzerindeki birçok katılımcıyı içerdiği için deneme sonuçlarının özellikle dikkate değer olduğunu belirtti. AML teşhislerinin yarısından fazlası bu yaş grubundaki kişilerdedir.
Karşılaştırıldığında, midostaurin'in onayı, 59 yaşından büyük hastaları içermeyen bir araştırmaya dayanıyordu.
olan insanlar için FLT3 Duke Üniversitesi Kanser Enstitüsü'nden ve araştırmanın baş araştırmacılarından biri olan Dr. Harry Erba, yaşlı hastalar da dahil olmak üzere ITD mutasyonu, yeni onay "ileriye doğru atılmış büyük bir adım" dedi.
Kişi ilacı alacak kadar iyi olduğu sürece yoğun kemoterapi Tedaviye dahil edildiğini söyleyen Dr. Erba, Quiartinib'in eklenmesinin “ bakım standardı olan hastalar için FLT3 ITD-pozitif AML.”
ile AML'ye saldırmak FLT3 mutasyonlar
AML, löseminin en agresif formlarından biridir. AML'de belirli genetik değişiklikler olduğunda FLT3, daha da zahmetli hale gelir, kanserin ilk tedaviden sonra nüks etme olasılığını artırır ve diğer tedavilere yanıt verme olasılığını azaltır.
Midostaurin'in 2017'de onay alması (kemoterapi ile kombinasyon halinde) ve daha önce kök hücre nakillerinin kullanılması, AML'li kişilerin FLT3 Amanda Przespolewski, MD ve Elizabeth Griffiths, MD, mutasyonların eskisinden çok daha uzun yaşadığını yazdı. Neşter deneme sonuçlarına eşlik eden başyazı.
FDA'nın midostaurin onayında herhangi bir yaş sınırlaması yoktu. Ancak 60 yaş ve üstü kişilerde kullanımına ilişkin sınırlı veriler göz önüne alındığında, Dr. Przespolewski ve Griffiths, "hastaların çoğu
bu etkili ek tedaviyi [almaktan] dışlandı.”
Hem midostaurin hem de quizartinib, kanser hücrelerini FLT3 Quiartinib, ITD mutasyonuna sahip AML hücrelerini hedeflemek için özel olarak tasarlanmıştır. FLT3. Öte yandan midostaurin ve gilteritinib de başka bir mutasyonu hedefler. FLT3 TKD denir.
Quiartinib eklenmesiyle genel sağkalımın ikiye katlanması
Quiartinib yapan Daiichi-Sankyo tarafından finanse edilen Quantum-First denemesine yaşları 539 ile 18 arasında değişen 75 yetişkin katıldı. Katılımcıların yaklaşık %40'ı 60 yaş ve üzerindeydi. Birçok katılımcı başka bir gende de mutasyona sahipti, NPM1. olumsuz etkisi FLT3 ITD mutasyonu, aynı zamanda AML'li kişilerde en belirgindir. NPM1 mutasyonlar, dedi Dr. Erba.
Dr. Przespolewski ve Griffiths, AML'li kişilerin yer aldığı diğer denemelere göre "daha gerçekçi bir hasta popülasyonu" kaydettikleri için deneme liderlerini alkışladılar.
Quiartinib grubuna rastgele atanan araştırmaya katılanlar, ilacı kemoterapi ile birlikte standart iki aşamalı tedavi sürecinin bir parçası olarak aldılar. birinci bölüm denir indüksiyonAML'yi göndermeyi amaçlayan hafiflemeve ikinci bölüm denir sağlamlaştırma, bu remisyonun sürdürülmesine yardımcı olmak için. Diğer katılımcılar aynı programa göre kemoterapi ve plasebo aldı.
AML'li kişilerde konsolidasyon tedavisi, allojenik kök hücre nakli. İnsanlarda FLT3 Erba, ITD mutasyonları, bu tür nakillerin, bir tane alacak kadar sağlıklı olanlar için standart bir konsolidasyon tedavisi olduğunu söyledi. Hem quizartinib hem de plasebo gruplarında benzer sayıda katılımcı konsolidasyon tedavisi olarak organ nakli aldı.
Quiartinib grubundaki hastalar ilacı 3 yıla kadar almaya devam etti. idame tedavisi, hastalığın geri dönmesini önlemek için bir adım daha.
Quiartinib grubunda genel sağkalımda iki kat artış olmasına rağmen, bu gruptaki katılımcıların yaşam süresindeki iyileşme en çok 60 yaşın altındakilerde önemliydi.
Ancak Quiartinib tedavisinin klinik olarak önemli başka yararları olduğunu söyledi Dr. Erba.
Örneğin, her iki gruptaki hastalar indüksiyon tedavisi ve konsolidasyon tedavisinden sonra benzer tam remisyon oranlarına sahip olsa da, remisyonlar quizartinib ile tedavi edilen kişilerde önemli ölçüde daha uzundu: medyan 38.6 aya karşı 12.4 ay.
Quiartinib ile tedavi, kök hücre nakli geçirmiş olsunlar ya da olmasın, insanların daha uzun yaşamalarına da yardımcı oldu.
Son olarak, denemedeki bir grup hasta için, araştırma ekibi gelişmiş bir teknik kullandı. Yeni nesil sıralama, tam bir remisyona giren katılımcıların hala tespit edilebilir herhangi bir lösemi hücresine sahip olup olmadığını değerlendirmek için FLT3 Kemik iliğinde ITD mutasyonu.
Böyle bir hücre tespit edilemediğinde buna varlık denir. minimal rezidüel hastalık (MRD)-negatif.
Hangi tedaviyi aldıklarına bakılmaksızın, MRD negatif olan kişiler genel olarak MRD negatif olmayanlardan daha uzun yaşadılar. Bununla birlikte, daha ne kadar süreceği belli değil, çünkü henüz MRD negatif olan yeterli sayıda katılımcı ölmedi. medyan genel sağkalım, MRD pozitif grup için medyan genel sağkalım yaklaşık 27 aydı.
Dr. Erba, bu bulgunun, ileri tedavi kararlarını yönlendirmeye yardımcı olmak için indüksiyon tedavisinden sonra MRD durumunu kullanma potansiyeline işaret ettiğini söyledi.
Teksas Üniversitesi MD Anderson Kanser Merkezi'nde AML tedavisinde uzmanlaşmış ve denemeye dahil olmayan Dr. Farhad Ravandi kabul etti. Dr. Ravandi, "Hassas yeni nesil [dizileme] ile MRD değerlendirmesi, bu ve diğer lösemi türlerinde giderek daha önemli hale geliyor" dedi.
Yan etkiler ve REMS
Quiartinib grubundaki kişilerde, tek başına kemoterapi grubundakilere göre tedaviyle ilişkili ciddi yan etkilere sahip olma olasılığı daha yüksekti, en yaygın olarak önemli beyaz düşüşler kan hücresi sayımı. Quiartinib ile tedavi edilen biraz daha fazla insan tedavinin ilk 2 ayında öldü. Ölümlerin çoğu enfeksiyonlardan kaynaklandı.
Midostaurin mide bulantısı gibi önemli gastrointestinal yan etkilere neden olma eğilimindedir.
ishal. Ancak Dr. Erba, Quantum-First denemesinde, quizartinib ile tedavi edilen kişilerde bu yan etkilerin oranlarının çok düşük olduğunu açıkladı.
Uzamış QT aralığı adı verilen kalple ilgili bir yan etki, quizartinib ile tedavi edilen kişilerde daha yaygındı, bu da FDA'nın onkologlardan ilacı reçete etmek için REMS sürecinden geçmesini istemesine yol açtı. Bu yan etki, kalbin normal ritmini etkileyebilecek elektrik sistemindeki değişiklikleri içerir. İnsanların küçük bir yüzdesinde bu sorun ölümcül olabilir.
Denemede, quizartinib grubundaki kişilerin yaklaşık %2'sinde, tek başına kemoterapi grubundaki %1'e kıyasla durumun daha şiddetli biçimleri görüldü.
Dr. Erba, daha önceki quizartinib çalışmalarında, daha yüksek dozlarda ilaç verilen bazı hastalarda uzamış QT aralığı görüldüğünü söyledi. Ancak Quantum-First denemesinde kullanılan ve FDA tarafından onaylanan daha düşük doz, bu soruna daha az sıklıkla neden oluyor ve meydana geldiğinde genellikle daha az şiddetli oluyor dedi.
REMS sürecinden geçmek "[onkologların] quizartinib reçete etmesine engel olabilir" diye kabul etti. "Ancak bu ilacın faydasının önemli olduğuna ve REMS gereksinimini karşılamak için gereken ekstra adımdan daha ağır basması gerektiğine inanıyorum."
Hangi FLT3 hedefli ilaç kullanılacak?
Artık onkologlar için bir zorluk, hangi FLT3 hedefli ilacın hangi hastalarda kullanılacağına karar vermektir.
Quizartinib'in onayı, yalnızca tümörleri olan kişilerin başlangıç tedavisi içindir. FLT3 ITD mutasyonu. Midostaurin, ITD veya TKD mutasyonu olan kişilerde kullanılabilse de, Dr. Ravandi, AML'yi düzenli olarak tedavi eden birçok onkoloğun, ITD mutasyonu olan hastalarda tercih edilen ilk tedavi olarak muhtemelen quizartinib'i kullanmasını beklediğini söyledi.
Dr. Erba, spesifik olarak bu mutasyonu hedef almasına ek olarak, midostaurine tercih edilmesinin bir başka önemli nedenini vurguladı: ITD mutasyonuna sahip kişiler bir nüks yaşadıklarında, bunun nedeni genellikle TKD mutasyonunun gelişmesidir.
"Öyleyse önce quizartinib kullanmak mantıklı" ve nüksetmenin bir TKD mutasyonundan kaynaklandığı durumlar için ikinci basamak tedavi olarak özel olarak onaylanan gilteritinib'i rezerve etmek mantıklı, dedi.
Ayrıca hastaların 3 yıl boyunca quizartinib idame tedavisinde kalmaları gerekip gerekmediği sorusu da var. Klinik çalışmada, katılımcıların ilaçta kaldıkları medyan süre sadece 16 aydı ve çoğu yan etkiler nedeniyle ilacı bıraktı.
Dr. Ravandi, idame tedavisinin maliyetinin ve yan etkilerle baş etmenin "endişe verici olabileceğini" kabul etti, ancak eğer yapabilirlerse hastaların tüm tedavi süresi boyunca quizartinib kullanmasını savunacağını söyledi.
Ancak bu bir karar, diye devam etti ve daha fazla çalışma yapıldıkça "MRD değerlendirmesi karar verici bir faktör haline gelebilir."
- SEO Destekli İçerik ve Halkla İlişkiler Dağıtımı. Bugün Gücünüzü Artırın.
- PlatoData.Network Dikey Üretken Yapay Zeka. Kendine güç ver. Buradan Erişin.
- PlatoAiStream. Web3 Zekası. Bilgi Genişletildi. Buradan Erişin.
- PlatoESG. Otomotiv / EV'ler, karbon, temiz teknoloji, Enerji, Çevre, Güneş, Atık Yönetimi. Buradan Erişin.
- PlatoSağlık. Biyoteknoloji ve Klinik Araştırmalar Zekası. Buradan Erişin.
- ChartPrime. Ticaret Oyununuzu ChartPrime ile yükseltin. Buradan Erişin.
- Blok Ofsetleri. Çevre Dengeleme Sahipliğini Modernleştirme. Buradan Erişin.
- Kaynak: https://www.cancer.gov/news-events/cancer-currents-blog/2023/fda-vanflyta-aml-flt3