F16BP mikropartikülleri fagositlenebilir aralıktadır
Böyle bir stratejinin gücünü göstermek için PFK15 (bloklar−6-Fosfofrukto-2-Kinaz Fruktoz-2,6-Bifosfataz 3-PFKFB3), glikolizde hız sınırlayıcı adımlardan biri olduğu için glikolizi bloke etmek üzere seçildi.20. Ayrıca, PFKFB1,6'ün aşağısındaki bir adım olan fosfofruktokinaz (PFK) tarafından üretilen Fruktoz-16-BiFosfat (F3BP), fagositozlanabilir parçacıklar üretmek için metabolit olarak seçildi.21. F16BP bazlı mikropartiküller, kalsiyum-fosfat kimyası kullanılarak üretildi. Dinamik ışık saçılımı, bu parçacıkların boyutunun 2.3 ± 0.4 µm olduğunu gösterdi (Şekil XNUMX). 1b) ve taramalı elektron mikrografları, bu parçacıkların düzgün küresel morfolojiye sahip olduğunu gösterdi (Şekil XNUMX). 1c). 1H NMR ve EDX haritalaması kullanılarak F16BP'nin bu mikropartiküller içerisine dahil edildiği belirlendi (Şekil XNUMX). 1c; S1) ve parçacıklar 2 ± 0.14 Kalsiyum: Fosfor (Ca:P) oranına sahipti (Şekil XNUMX). 1c).
F16BP mikropartikülleri DC'ler tarafından fagosite edilir
F16BP MP'lerin F16BP'yi salıp salamadığını test etmek için fosfat tamponlu salin içinde salım kinetiği gerçekleştirildi. F16BP MP'lerin F16BP'yi 6 saat boyunca sürekli bir şekilde serbest bırakabildiği gözlendi (Şekil XNUMX). S2). Bu veriler, üretilen MP'lerin F16BP içerdiğini, DC'lerin fagositozlanabilir aralığında olduğunu ve potansiyel olarak glikolizin ilerlemesine izin vermek için F16BP'yi serbest bırakabildiğini gösterdi. F16BP'ye ek olarak ribuloz 5 fosfat (R5P), Fosfoenolpiruvik asit (PEP) ve fruktoz-6 fosfat (F6P) gibi diğer kontrol metabolitlerinin parçacıkları da üretildi (Şekil XNUMX). S3). Bu çalışmada fosfatların in vivo fizyolojik koşullarını taklit edecek şekilde PBS seçilmiş ve bu ortamda F16BP salınımı belirlenmiştir.22. Ayrıca, aktifleştirilmiş DC'lerin fagositoz sonrasında in vivo 1-3 gün hayatta kalması beklendiğinden, F16BP MP'lerin kısa süreli aktivitesi veya stabilitesi arzu edilir.23.
Bu parçacıkların DC'ler tarafından fagosite edilip edilemeyeceğini test etmek için konfokal görüntüleme yapıldı. Spesifik olarak F16BP MP'ler, parçacıkların içine yerleştirilmiş FITC ile üretildi. Kemik iliğinden türetilen DC'ler (DC'ler) daha sonra bu parçacıklarla 60 dakika boyunca inkübe edildi ve aktin ve çekirdekler için boyandı ve floresan görüntüleme yapıldı. F16BP-FITC MP'lerin varlığında sitokalasin D, kontrol olarak kullanıldı. DC'lerin parçacıklarla etkili bir şekilde ilişki kurabildikleri ve z yönündeki konfokal dilimlerin parçacıkların içselleştirildiğini gösterdiği gözlendi (Şekil XNUMX). S4).
F16BP mikropartikülleri DC'lerde in vitro glikolizi kurtarır
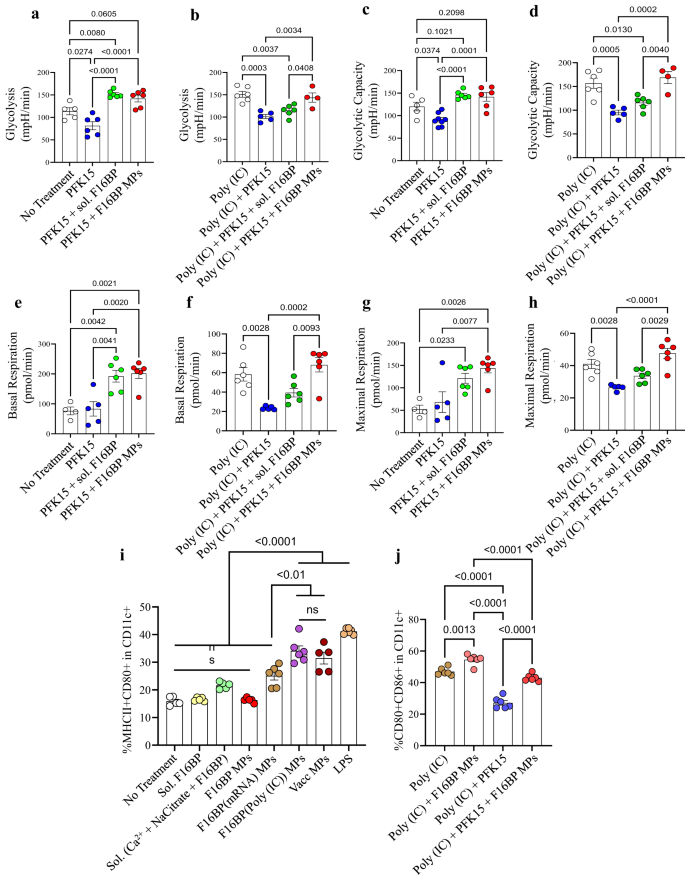
Daha sonra F16BP MP'lerin, glikolitik inhibitör PFK15 varlığında DC'lerdeki glikolizi kurtarma yeteneği, hücre dışı akış analizleri kullanılarak test edildi. DC'ler, PFK15, F16BP MP'ler, çözünür Fruktoz-6-Fosfat (PFKFB6'ün F3P yukarı akışı) veya PFK15 + F16BP MP'ler veya F16BP MP'lerin ayrı bileşenleri ile 2 saat boyunca kültürlendi ve hücre dışı asitlenme oranı (ECAR-hızı) glikoliz) ölçümleri elde edildi. PFK15'in glikoliz ve glikolitik kapasiteyi getirdiği gözlendi (y-axis-ECAR) tedavi uygulanmayan kontrolden daha düşüktür (Şekil XNUMX). 2a-d; S5). Önemli olarak, glikoliz ve glikolitik kapasite, tek başına PFK16 kontrolüne kıyasla, PFK15 varlığında bile F15BP MP'lerde önemli ölçüde daha yüksekti (Şekil XNUMX). 2a-d). Ayrıca poli(IC)'nin (DC'ler için aktive edici bir ajan) varlığında24PFK15, glikolizi ve glikolitik kapasiteyi azalttı ve F16BP MP'leri, PFK15 varlığında bile bu düşüşü kurtarabildi (Şekil XNUMX). 2e-h). Genel olarak bu veriler, fagositozlanabilir F16BP MP'lerin, glikolitik inhibitör PFK15 varlığında bile DC'lerde glikolizi kurtarabildiğini ve dolayısıyla kanser hücrelerinin glikoliz yolunun hedeflendiği immünoterapiler için kullanılabileceğini göstermektedir. Bu önemlidir çünkü iltihaplanma koşulları altında DC'lerin, iltihaplı protein üretimini desteklemek için gelişmiş seviyelerde glikoliz gerçekleştirmeleri gerekir.11,25.
a-d F16BP MP'leri ile tedavi edilen DC'ler, in vitro olarak glikolizi ve glikolitik kapasiteyi glikolitik inhibisyondan (PFK15) kurtardı (n = 6; Tek yönlü ANOVA Tukey testi), e-h F16BP MP'lerle tedavi edilen DC'ler, in vitro glikolitik inhibisyon (PFK15) altında bile bazal ve maksimum solunumu hızlandırır (n = 6; Tek yönlü ANOVA Tukey testi). i Aşı parçacıkları, MP'lerin ayrı ayrı bileşen kontrolleriyle karşılaştırıldığında CD86c+ DC'lerde önemli ölçüde daha yüksek MHCII + CD11+ frekansına neden oldu (n = 6; Tek yönlü ANOVA Tukey testi). j F16BP MP'leri, PFK15 varlığında bile DC'lerin aktivasyonunu kurtarmayı başardı (PFK15 konsantrasyonu = 25 µM) (n = 6; Tek yönlü ANOVA Tukey testi). Veriler ortalama ± standart hata olarak temsil edilir.
F16BP mikropartikülleri DC'lerin in vitro aktivasyonunu kurtarır
F16BP MP'lerin DC'lerin fonksiyonunu modüle edip edemediğini test etmek için mRNA bazlı ve peptid bazlı aşı F16BP MP'ler formüle edildi. Bu aşılar, di-fosforile melanom peptid antijeni Tirozinle ilişkili protein 2 (pTRP2) ve omurgalarında birkaç fosfat grubu içeren melanom hücrelerinden türetilen poli(IC) ve mRNA'nın bir araya getirilmesiyle üretildi (Şekil XNUMX). S6). pTRP2p ve poli(IC) fosfat gruplarına sahip olduğundan, bu moleküller kalsiyum-fosfat kimyası kullanılarak F16BP MP'lere dahil edilebilir. F2BP MP'lerine dahil edilen pTRp16 ve poli(IC) miktarının sırasıyla 78 ± 3.4 ve 50.9 ± 7.9 µg olduğu belirlendi. Daha sonra, poli(IC) ve pTRP16 ile birleştirilmiş F2BP MP'ler, gece boyunca DC'ler ile inkübe edildi ve bu parçacıkların DC'leri aktive edip edemediğini test etmek için akış sitometrisi kullanıldı (Şekil XNUMX). 2i, j). Aşı parçacıklarının, MP'lerin ayrı ayrı bileşen kontrollerine kıyasla CD86c+ DC'lerde önemli ölçüde daha yüksek MHCII + CD11+ frekansını indüklediği gözlendi (Şekil XNUMX). 2i). Ek olarak, PFK15'in poli(IC) varlığında bile DC'lerin aktivasyonunu (CD80c+'da CD86 + CD11+) azaltabildiği ve F16BP MP'lerin, PFK15 varlığında bile DC'lerin aktivasyonunu kurtarabildiği gözlendi. (İncir. 2j). Ayrıca, F16BP MP'leri olarak DC'lere eklenen konsantrasyondaki kalsiyum iyonları, DC'lerin aktivasyon (CD80c +'da MHCII + CD11 +) profilinde değişikliklere yol açmadı (Şekil XNUMX). S5). Bu veriler, F16BP bazlı aşı MP'lerinin, PFK15 varlığında bile DC aktivasyonunu kurtardığını gösterir; bu, glikoliz inhibisyonu varlığında in vivo kanser aşısı yanıtlarının üretilmesi gerekiyorsa önemlidir.
F16BP MP formülasyonları ile tedavi edilen DC'lerin T hücresi yanıtlarını modüle edip etmediğini daha fazla analiz etmek için sinjeneik bir karışık lenfosit reaksiyonu (MLR) gerçekleştirildi. C57BL/6j kemik iliğinden türetilen DC'ler farklı koşullarla tedavi edildi (Şekil XNUMX). S7) 2 saat boyunca kültürlendi ve daha sonra 57 saat boyunca C6BL/60j farelerinden izole edilen T hücreleriyle kültürlendi. Hücreler daha sonra CD4, CD8, CD44, Tbet, RORɣT, GATA3, CD25 ve Foxp3'e karşı boyandı ve akış sitometrisi kullanılarak analiz edildi. F16BP MP'lerin, F16BP(pTRP2), F16BP(poli(IC), F16BP(pTRP2+poli(IC)) PFK15 + F16BP MP'lerin ve PFK15 + F16BP(pTRP2+poli(IC)) hepsinin önemli ölçüde yukarı regüle edildiği gözlemlendi Aktive edilmiş Th1, aktive edilmiş Th17 ve aktive edilmiş Tc1 hücrelerinin frekansını azaltırken aynı anda Th2, Treg'ler ve aktive edilmiş Th2'nin frekansını da azaltır (Şekil XNUMX). S7). İlginç bir şekilde DC'lerin F16BP MP'lerle tedavisinin, T hücresi polarizasyonunda ve aktivasyonunda en büyük değişikliklere yol açtığı gözlemlendi. Gözlenen bu değişiklik, adjuvan poli(IC) veya pTRP2 antijeninin varlığında bile meydana geldi. Ayrıca, DC'lere eklenen çözünür F16BP ve bileşenleri, tüm olası kombinasyonlarda F1BP MP'lerle karşılaştırıldığında önemli ölçüde daha düşük aktif Th1, Tc17 ve Th16 frekansını indükledi. Bu veriler, parçacıkların varlığının, bir MLR reaksiyonunda proinflamatuar T hücresi frekanslarını çarpıtmak için önemli olduğunu göstermektedir.
Glikolitik inhibitörlere sahip F16BP aşıları, güçlü anti-tümör yanıtları üretir
Glikolitik inhibitörlerin varlığında glikolizi kurtarmaya ve kanser aşısı immünoterapileri oluşturmaya yönelik immünometabolizmayı modüle eden yaklaşımın olup olmadığını test etmek için, melanom fare modellerinin oldukça agresif formları seçildi. Spesifik olarak aşı MP'leri, YUMM1.1 (fare BRAF'ı) içeren farelere deri altından enjekte edildi.v600e İnsanlardakine benzer mutasyona sahip melanom tümörleri ve bunların tümör büyümesini azaltma ve doğuştan gelen ve kazanılmış bağışıklık tepkilerini modüle etme yetenekleri test edildi.
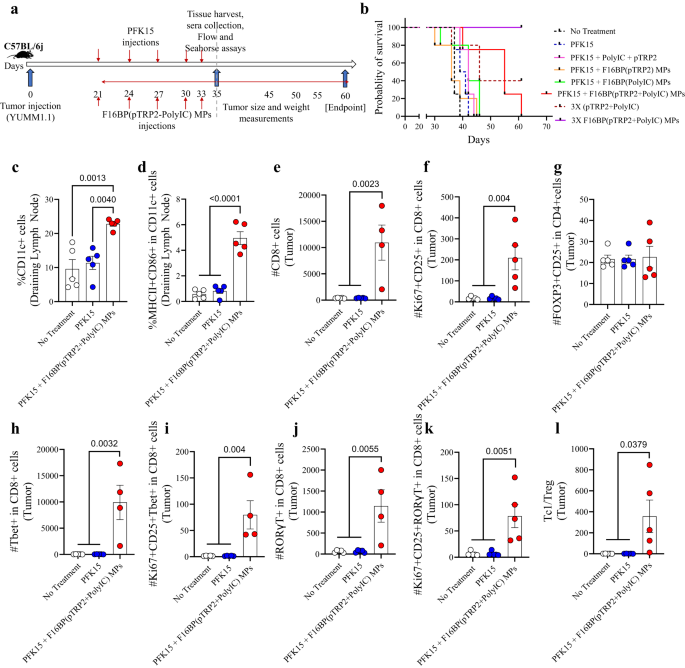
Bu melanom modelinde 0.75 × 106 YUMM1.1 hücreleri, C57BL/6j bağışıklığı yeterli farelere deri altından enjekte edildi ve PFK15, çalışma süresi boyunca günaşırı enjekte edildi. Ayrıca, F16BP(pTRP2+poli(IC)) PFK15 enjeksiyonlarıyla aynı günlerde deri altından enjekte edildi (Şekil XNUMX). 3a). İn vitro olarak PFK15'in YUMM1.1 kanser hücrelerinin çoğalmasını önlemede etkili olduğu belirlendi (Şekil XNUMX). S8). PFK15 + aşı MP'lerinden oluşan tedavi grubunun, tüm farklı kontrollerle karşılaştırıldığında farelerin hayatta kalma oranının (60. gün - son nokta) önemli ölçüde artmasına ve tümör büyümesinin daha yavaş olmasına yol açtığı gözlemlendi (Şekil XNUMX). 3b; S9). Aşı MP'lerinde hayatta kalma oranındaki bu artış, DC popülasyonundaki bir artışla ve 35. günde boşalan kasık lenf düğümlerinde aktifleştirilmiş DC popülasyonuyla ilişkiliydi; bu, aşı MP'lerinin doğuştan gelen bağışıklık tepkilerini modüle edebildiğini gösteriyor (Şekil XNUMX). 3c, d). F16BP olmadan fareler 16. günden sonra hayatta kalamadığı için F45BP, farelerde anti-tümör tepkileri oluşturmada önemliydi. Ayrıca, PFK3'siz F16BP (pTPR2+ poli IC) MP'lerin 15 katı dozajı, şu ana kadar tespit edilemeyen mevcut tümörleri ortadan kaldırabildi. 60. gün (Şek. 3b; S9). Ek olarak, poli(IC) ve pTRP2'nin F16BP MP'lere dahil edilmesi gerektiği ve F16BP MP'lerin çözünür (poli(IC) + pTRP2) enjeksiyonlarının farelerde tümör büyümesini azaltmadığı da bulundu (Şekil XNUMX). S9). F16BP MP'leri, DC'lerde in vitro olarak gözlemlendiği gibi, farelerde farklı hücrelerde glikolizi kendi başlarına hızlandırabilir. Glikolizin bu hızlanması, bağışıklık tepkisinin anti-tümör tepkilerine doğru kaymasına neden olabilir. Ancak bu kontrol farelerde test edilmemiştir ve bu çalışmanın bir sınırlamasıdır. Tümör içerisinde farklı tedavi gruplarının CD4+ T hücrelerinin sayısında önemli bir farklılık gözlenmedi; ancak diğer tedavi grupları ile karşılaştırıldığında aşı MP'leri ile tedavi edilen farelerde çoğalan ve aktive olan CD4+ hücrelerinde önemli bir artış vardı (Şekil XNUMX). S10a). Ayrıca T-yardımcı tip 1 (Th1) ile aktive olan ve çoğalan Th1 hücrelerinin sayısında önemli bir fark gözlenmedi; Diğer tedavi gruplarına kıyasla aşı MP'leri ile tedavi edilen farelerde T-yardımcı tip 17'de (Th17) ve aktifleştirilmiş ve çoğalan Th17 hücrelerinde önemli bir artış gözlendi (Şekil XNUMX). S10a). Ayrıca fareler, PFK15 ve çözünür pTRP2 ve F16BP içermeyen çözünür poli (IC) ile tedavi edildiğinde, tedavi uygulanmayan bir kontrolle karşılaştırıldığında aktifleştirilmiş DC seviyelerinin artmasına yol açtığı, ancak DC'lerin diğer kontrollerde modüle edilmediği de gözlendi. organlar (Şek. S10b). Ayrıca F16BP olmadan formülasyon, tedavi uygulanmayan kontrolle karşılaştırıldığında pro-inflamatuar T hücresi tepkilerini modüle etmedi (Şekil XNUMX). S10C). Bu veriler, formülasyonda proinflamatuar T hücresi yanıtları oluşturmak için F16BP'nin gerekli olduğunu göstermektedir. Ayrıca, tümör içerisinde, aşı MP'leri ile tedavi edilen farelerde CD8 + T hücrelerinin sayısında ve çoğalan ve aktive olan CD8 + T hücrelerinin sayısında, diğer tedavi grupları ile karşılaştırıldığında, aşı MP'leri ile tedavi edilen farelerde tümör büyüme kinetiğindeki azalmaya işaret eden önemli bir artış vardı. aşı milletvekillerinin yanıtları (Şek. 3e, f). Farklı tedavi gruplarında düzenleyici T hücrelerinde anlamlı bir fark gözlenmedi (Şekil XNUMX). 3g). Ek olarak, diğer tedavi grupları ile karşılaştırıldığında aşı MP'leri ile tedavi edilen farelerde Tc1, Tc17 ve çoğalan ve aktive olan Tc1 ve Tc17 hücrelerinin sayısında önemli bir artış vardı (Şekil XNUMX). 3 sa-k). Ayrıca aşı MP'leri ile tedavi edilen farelerde diğer tedavi gruplarına kıyasla Tc1/Treg oranında önemli bir artış gözlendi (Şekil XNUMX). 3l). Bu veriler, aşı MP'lerinin tümörde güçlü proinflamatuar adaptif bağışıklık tepkileri oluşturabildiğini göstermektedir.
a Vacc MP'lerin in vivo deri altı enjeksiyonunun şematik gösterimi, b Vacc MP'lerle tedavi edilen farelerin hayatta kalma oranının önemli ölçüde daha yüksek olduğunu gösteren Kaplan-Meir eğrisi, c, d Vacc MP'lerle tedavi edilen fareler, drenaj yapan lenfteki aktif DC'lerin yanı sıra toplamın önemli ölçüde daha yüksek bir yüzdesine sahipti (n = 5; Tek yönlü ANOVA Tukey testi), e, f Vacc MP'lerle tedavi edilen farelerde, diğer tedavi gruplarına kıyasla önemli ölçüde daha yüksek sayıda Tc ve aktifleştirilmiş ve çoğalan Tc vardı (n = 4 veya 5; Tek yönlü ANOVA Tukey testi), g Tedavi grupları arasında Treg sayısında anlamlı bir farklılık gözlenmedi (n = 5; Tek yönlü ANOVA Tukey testi), h-k Vacc MP'lerle tedavi edilen farelerde önemli ölçüde daha yüksek sayıda Tc, Tc1, aktifleştirilmiş ve çoğalan Tc1 ve Tc17 hücreleri vardı (n = 4; Tek yönlü ANOVA Tukey testi), l Kontrol gruplarına kıyasla Vacc MP'lerle tedavi edilen farelerde önemli ölçüde daha yüksek Tc1/Treg oranı gözlendi (n = 4; Tek yönlü ANOVA Tukey testi). Veriler ortalama ± standart hata olarak temsil edilir.
F16BP aşıları in vivo DC ve T hücresi metabolik fonksiyonunu korur
DC'lerin veya T hücrelerinin tedaviden sonra metabolik işlevlerini sürdürüp sürdürmediğini test etmek için tümörlü farelere ötenazi uygulandı ve tümör, dalak ve kasık LN'lerinden gelen hücreler izole edildi. Bu hücreler daha sonra 2NBDG ile kültürlendi ve glikoliz seviyesini temsil eden 2NBDG'nin alımını belirlemek için akış kullanıldı. Tümörde, CD2+ DC'lerde ve makrofajlarda 80NBDG'nin gMFI'sinin, PFK15 + F16BP(polyIC) MP'lerde, yalnızca PFK15 koşuluyla karşılaştırıldığında önemli ölçüde daha yüksek olduğu, ancak bunların, tedavi uygulanmayan kontrolden önemli ölçüde farklı olmadığı gözlendi (Şekil XNUMX). S11a–g). Dalakta, DC'lerde, CD2+ DC'lerde (ancak CD80+ DC'lerde değil) 206NBDG'nin gMFI'si, tüm kontrollerle karşılaştırıldığında PFK15 + F16BP(polyIC) MP'lerle tedavi edilen farelerde önemli ölçüde daha yüksekti (Şekil XNUMX). S11h–j). Bu eğilimler, tüm kontrollerle karşılaştırıldığında PFK15 + F16BP (polyIC) MP'lerle tedavi edilen farelerin dalağından izole edilen makrofajlarda tersine döndü (Şekil XNUMX). S11k–m). Bu veriler, sistemik olarak MP'lerin, DC'lerin ve makrofajların glikolizini farklı şekilde modüle ettiğini göstermektedir. Kasık LN'lerinde, 2NBDG'nin gMFI'si, aktifleştirilmiş CD80+ DC'lerde ve CD206+ DC'lerde de yukarı doğru düzenlenmiştir (Şekil XNUMX). S11n–s). Böylece 2NBDG tahlili, DC ve makrofaj glikolizinin bir tümörde, dalakta ve boşaltılan kasık LN'lerinde hala muhafaza edildiğini gösterdi. Bu hücrelerdeki glikolitik plastisiteyi anlamak için adaptif T hücreleri için de benzer bir çalışma yapıldı. Özellikle, tümörden izole edilen CD45 hücrelerinin, tedavi uygulanmayan kontrol ile karşılaştırıldığında PFK2, PFK15+ çözünür F15BP + çözünür poli(IC) ve PFK16 + F15BP(poliIC) MP'lerle tedavi edilen farelerde önemli ölçüde daha düşük 16NBDG gMFI'ye sahip olduğu gözlendi. (İncir. S12a). Bu veriler, MP'lerin veya MP'lerin çözünür kısımlarının, immün olmayan hücrelerin glikolizini büyük ölçüde modüle edemediğini veya bu hücrelerin, immün hücrelerle karşılaştırıldığında daha yüksek bir metabolik plastisite seviyesine sahip olduğunu göstermektedir. Ayrıca, tümördeki T yardımcı hücrelerinde 2NBDG'nin gMFI'si, tedavi uygulanmayan kontrol ile karşılaştırıldığında PFK15 + F16BP (poliIC) MP'lerde önemli ölçüde farklı değildi ve bu iki koşul, diğer kontrollerden önemli ölçüde daha yüksekti (Şekil XNUMX). S12b). Tümördeki CD2 + T hücrelerinde 8NBDG'nin gMFI'si, tedavi uygulanmayan kontrolle karşılaştırıldığında PFK15 + F16BP (polyIC) MP'lerde önemli ölçüde farklı değildi (Şekil XNUMX). S12C), ancak PFK15+ çözünür F16BP + çözünür poli(IC) koşulundan daha yüksekti. Dalakta, CD4+ T hücrelerinde önemli bir fark gözlenmedi, ancak CD8+ T hücreleri, PFK2 + F15BP(polyIC) MP'lerle tedavi edilen farelerdeki kontrollerle karşılaştırıldığında daha yüksek 16NBDG gMFI'ye sahipti ancak tedavi uygulanmayan kontrolden farklı değildi. (İncir. S12d, e). Ayrıca kasık lenf düğümlerinde, PFK15 + F16BP(polyIC) MP'lerle tedavi edilen fareler, tedavi uygulanmayan kontrole kıyasla 2NBDG gMFI'yi düşürmüştür (Şekil XNUMX). S12f, g). T hücresi 2NBDG tahlili, tümörde hem CD4+ hem de CD8+ T hücrelerinin ex vivo kültürden sonra bile glikolizlerini koruduklarını ve dolayısıyla in vivo anti-tümör yanıtlarını destekleyebileceğini öne sürmektedir. Genel olarak bu veriler, F16BP sağlayan ve DC'leri kurtarabilen aşı MP'lerinin, melanom tümörlerinin agresif bir formuna karşı güçlü bağışıklık tepkileri oluşturabildiğini gösterdi.
F16BP, farelerde benimsenerek aktarılan DC metabolizmasını kurtarır
Subkutan aşı stratejisine ek olarak DC'lerin adaptif transferi prostat kanseri tedavisine yönelik kliniklerde test edilmiştir.26,27,28. Ancak bu stratejiler, kısmen sağkalımı iyileştirmedeki düşük etkinlikleri nedeniyle kliniklerde çok başarılı olmamıştır. F16BP-PFK15 sisteminin çok yönlülüğünü test etmek için başka bir agresif B16F10 melanom modeli seçildi ve MP'lerle yüklenen DC'lerin uyarlayıcı transfer yeteneği bir tedavi yöntemi olarak kullanıldı (Şekil XNUMX). 4a). Bu modelde DC'ler, B16F16 kanser hücrelerinden izole edilen mRNA ve poli(IC) (Vacc DC'ler) ile birleştirilen F10BP MP'ler ile yüklendi ve B16F10 tümörleri içeren farelere adaptif olarak aktarıldı. Bu hücresel tedavinin adaptif bağışıklık tepkilerini modüle etme, tümör büyümesini azaltma ve hayatta kalmayı iyileştirme yeteneği ölçüldü.
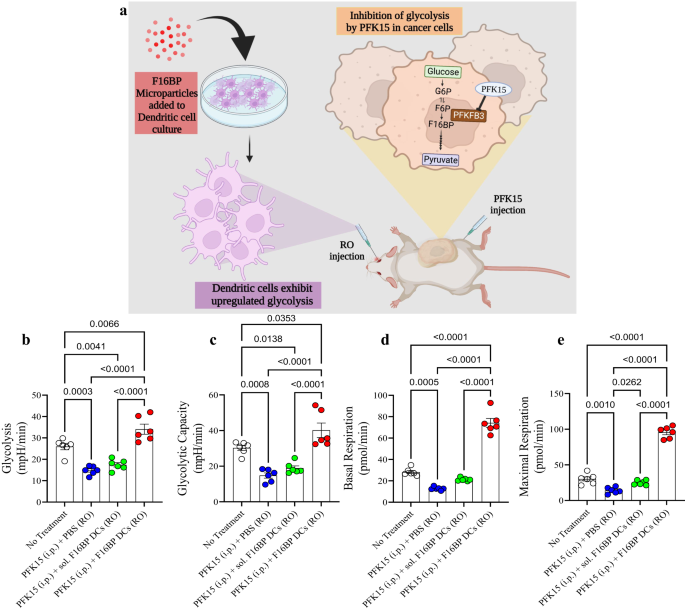
a Kullanılan uyarlayıcı hücresel terapi modelinin şematik gösterimi. b, c F16BP MP'lerle birlikte adaptif olarak aktarılan DC'lerin enjekte edildiği fareler, in vivo olarak glikolizi ve glikolitik kapasiteyi glikolitik inhibisyondan (PFK15) kurtarabildi (n = 6; Tek yönlü ANOVA Tukey testi), d, e F16BP MP'lerle birlikte adaptif olarak aktarılan DC'lerin enjekte edildiği fareler, in vivo olarak glikolitik inhibisyon (PFK15) altında bile bazal ve maksimum solunumu hızlandırdı (n = 6; Tek yönlü ANOVA Tukey testi). Veriler ortalama ± standart hata olarak temsil edilir.
İlk olarak, F16BP MP'lerin (poli(IC) veya mRNA olmadan) DC'leri in vivo kurtarıp kurtaramayacağını test etmek için F16BP MP'ler, bu parçacıkların DC'lerle 2 saat boyunca inkübe edilmesiyle DC'lere yüklendi. Daha sonra bu DC'ler farelere intravenöz olarak uyarlanarak aktarıldı ve PFK15 intraperitoneal olarak enjekte edildi. DC'ler dalaktan izole edildi ve bu hücreler üzerinde hücre dışı akış analizleri yapıldı. Dalaktan izole edilen bu DC'lerin, hem endojen dalak DC'lerin hem de adaptif olarak aktarılan DC'lerin bir karışımı olması beklenir. F16BP MP'lerin, kontrollere kıyasla PFK15 varlığında artan ECAR değerlerinde gözlemlendiği gibi DC'lerin glikolizi ve glikolitik kapasitesini kurtarabildikleri gözlendi (Şekil XNUMX). 4b, c). Dahası, F16BP milletvekilleri, kontrollere kıyasla PFK15 varlığında DC'lerin bazal ve maksimum solunumunu da kurtarabildi (Şekil XNUMX). 4d, e). Bu veriler, bu parçacıkların sadece bu hücrelerde glikolizi ve mitokondriyal solunumu in vitro olarak kurtarmakla kalmayıp aynı zamanda in vivo olarak da kurtarabildiğini ve dolayısıyla fonksiyonel immünoterapötik yanıtlar üretebileceğini gösterdi.
DC'lerin metabolik kurtarılması, sağlam bir adaptif hücre immünoterapisi üretir
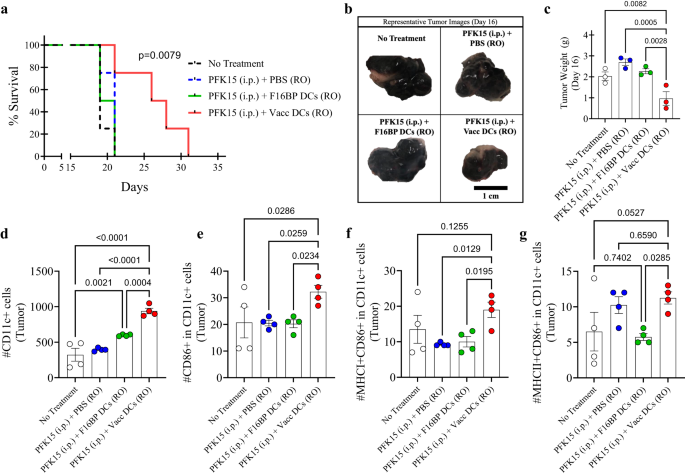
DC'lerdeki metabolik kurtarmanın uyarlayıcı hücre terapisine uygulanıp uygulanamayacağını test etmek için DC aşılarının uyarlayıcı transferi farelerde test edildi (Şekil XNUMX). S13). İlk olarak in vitro olarak PFK15'in B16F10 kanser hücrelerinin çoğalmasını önlemede etkili olduğu belirlendi (Şekil XNUMX). S14). Özellikle, 0.75 × 106 B16F10 hücreleri, C57BL/6j bağışıklığı yeterli farelere enjekte edildi ve PFK15, çalışma süresince her iki günde bir enjekte edildi (Şekil XNUMX). S13). Ayrıca, F16BP (mRNA + poli (IC)) (Vacc DC'ler) ile yüklenen ex vivo DC'ler veya F16BP MP'lerle yüklenen DC'ler, 6. ve 19. günlerde retro-orbital enjeksiyonlar (RO) kullanılarak benimsenmiş bir şekilde aktarıldı (Şekil XNUMX). S13). Vacc DC'ler + PFK15 alan farelerin hayatta kalma oranının, tüm kontrollerle karşılaştırıldığında dramatik bir şekilde arttığı ve kontrollere kıyasla Vacc DC'ler alan farelerde tümörün daha yavaş büyüdüğü gözlendi (Şekil XNUMX). 5a; S15). Bu veriler, 16. günde çalışmanın yarı noktasında elde edilen tümör ağırlıkları ve görüntülerle de desteklendi (Şekil XNUMX). 5b, c). Bu veriler, Vacc DC'lerin yalnızca iki enjeksiyonundan sonra tümöre karşı güçlü bir tepki oluştuğunu ve bunun da farelerde tümör büyümesini azalttığını gösteriyor.
a Kaplan-Meir eğrisi, adaptif olarak aktarılan Vacc MP'lerle tedavi edilen farelerin hayatta kalma oranının önemli ölçüde daha yüksek olduğunu göstermektedir (n = 10, p <0.001), b 16. günde farklı tedavi gruplarının temsili tümör görüntüleri. c Adaptif olarak transfer edilen Vacc DC'lerle tedavi edilen farelerde, in vivo olarak diğer tedavi gruplarına kıyasla önemli ölçüde daha düşük tümör ağırlıkları vardı (n = 3; Tek yönlü ANOVA Tukey testi). d, e Diğer tedavi grupları ile karşılaştırıldığında, in vivo olarak adaptif olarak transfer edilen Vacc DC'lerle tedavi edilen farelerde önemli ölçüde daha yüksek toplam ve aktifleştirilmiş DC'ler gözlendi (n = 4; Tek yönlü ANOVA Tukey testi). f Diğer tedavi grupları ile karşılaştırıldığında, in vivo olarak adaptif olarak transfer edilen Vacc DC'lerle tedavi edilen farelerde önemli ölçüde daha yüksek MHCI+ ile aktifleştirilmiş DC'ler gözlendi (n = 4; Tek yönlü ANOVA Tukey testi). g F16BP DC'lerle karşılaştırıldığında, in vivo olarak adaptif olarak aktarılan Vacc DC'lerle tedavi edilen farelerde önemli ölçüde daha yüksek MHCII+ aktif DC'ler gözlendi (n = 4; Tek yönlü ANOVA Tukey testi). Veriler ortalama ± standart hata olarak temsil edilir.
Daha sonra, Vacc DC'lerin uygulandıktan sonra bağışıklık tepkilerini modüle edip edemediğini test etmek için 16. günde dalak, lenf düğümleri ve tümörler farklı koşullardan izole edildi ve DC'lerin ve T hücrelerinin aktivasyon profili açısından boyandı. Vacc DC'ler için tümörlerdeki toplam DC ve aktif DC sayısının, tüm kontrollerle karşılaştırıldığında önemli ölçüde daha yüksek olduğu gözlendi (Şekil XNUMX). 5d, e). Ayrıca Vacc DC'ler ayrıca diğer tedavi gruplarına kıyasla tümörde MHCI + CD86 + CD11c+ olan DC'lerin sayısını da yukarı doğru düzenledi; bu da Vacc DC'lerin DC'lerin in vivo aktivasyonunu desteklediğini ortaya koydu (Şekil XNUMX). 5f). Ayrıca, Vacc DC'ler ayrıca, adaptif olarak aktarılan F86BP DC'lere kıyasla tümörde MHCII + CD11 + CD16c + olan DC'lerin sayısını da yukarı doğru düzenledi; bu, Vacc DC'lerin in vivo MHCII ile ilişkili tepkilere doğru eğildiğini ortaya koydu (Şekil XNUMX). 5g). Bu veriler, DC'lerin dalak ve tümördeki potansiyel infiltrasyonu için glikolizin gerekli olabileceğini ve F16BP MP'lerin, glikolizin meydana gelmesi için DC'lere yetenek sağladığını gösterir.
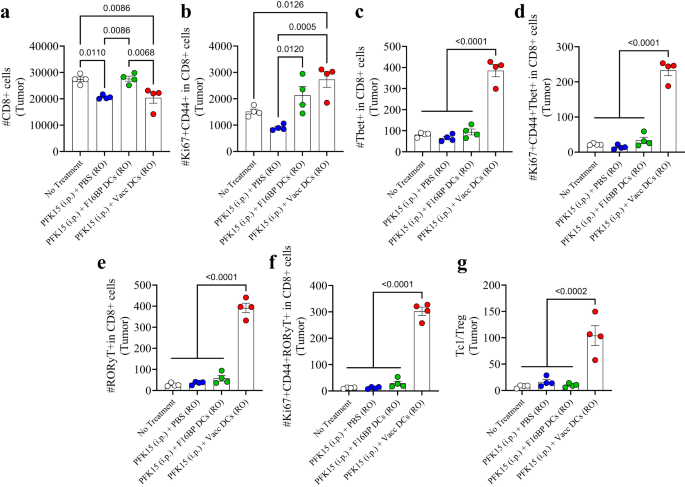
Tümördeki adaptif T hücresi tepkileri, proinflamatuar tepkilere doğru eğildi (Şekil XNUMX). 6a-g; S16). Tek başına PFK15 tedavisinin, tümördeki toplam CD8+ T hücresi sayısını önemli ölçüde azalttığı ve F16BP yüklü DC'lerin bu sayıyı, tedavi uygulanmayan kontrole eşitleyebildiği gözlendi (Şekil XNUMX). 6a). Bu CD8+ T hücre sayılarında, Vacc DC grubunda tümördeki aktif ve çoğalan (CD2+'da Ki3+CD67+) T hücrelerinde kontrol gruplarına göre 44-8 kat artış olduğu gözlendi (Şekil XNUMX). 6b). Ayrıca Vacc DC grubundaki CD4+ T hücrelerinde (Tc8) sitotoksik Tbet+'da diğer tüm gruplarla karşılaştırıldığında 1 kat anlamlı artış vardı (Şekil XNUMX). 6c). Ayrıca, aktive edilmiş ve çoğalan Tc1 hücrelerinin sayısı, diğer tüm tedavi koşullarıyla karşılaştırıldığında Vacc DC grubunda> 10 kat daha yüksekti (Şekil XNUMX). 6d). Benzer şekilde, kanser hücresi ölümünü indükleyen önemli bir proinflamatuar hücre tipi olarak ortaya çıkan Tc17 hücrelerinin (CD8+'da RORγt+) ve aktive olan ve çoğalan Tc17'nin (CD67+'da RORγt+Ki44+CD8+) sayısı da >10- idi. Tümörlerdeki kontrollerden önemli ölçüde daha yüksek katlar (Şekil XNUMX). 6e, f). Vacc DC'ler, Tc popülasyonlarına ek olarak T yardımcı hücrelerinin (Th), aktive olan ve çoğalan Th hücrelerinin, Th1'in (CD4+'da Tbet+), Th2'nin (CD3+'da GATA4+), aktive olan ve çoğalan Th1'in sayısında da azalmaya yol açtı. (CD44+'da Tbet+CD67+Ki4+) ve Vacc DC grubunda aktive olan ve çoğalan Th2 hücreleri (CD3+'da GATA44+CD67+Ki4+) sayıları (Şekil XNUMX). S16). Vacc DC'lerle tedavi edilen farelerde, tedavi edilmeyen farelerle karşılaştırıldığında tümör içindeki Treg sayısında (CD25+'da CD3+Foxp4+) önemli bir azalma vardı (Şekil XNUMX). S16). Ayrıca, Vacc DC ile tedavi edilen farelerde tüm diğer gruplarla karşılaştırıldığında tümör içindeki Th17'de (CD4+'da RORγt+) ve tümör içindeki aktifleştirilmiş ve çoğalan Th17 hücrelerinde (CD67+'da RORγt+Ki44+CD4+) önemli bir artış vardı (Şekil . S16). Ayrıca, Vacc DC ile tedavi edilen farelerin tümöründe Tc1'in Treg hücrelerine oranı, kontrollere kıyasla 5-10 kat daha yüksekti (Şekil XNUMX). 6g). Bu veriler, Vacc DC'lerin, esas olarak Tc1 ve Tc17 hücre popülasyonlarındaki artışlardan kaynaklanabilecek, tümörlere karşı güçlü bir adaptif bağışıklık tepkisi oluşturabildiğini göstermektedir.
a, b Diğer tedavi gruplarıyla karşılaştırıldığında in vivo olarak adaptif olarak aktarılan Vacc DC'lerle tedavi edilen farelerde toplam (CD8+) ve aktifleşen ve çoğalan (CD67+'da Ki44+CD8+) sitotoksik T hücrelerinde anlamlı modülasyon gözlendi (n = 4; Tek yönlü ANOVA Tukey testi). c-f Tedavi edilen farelerde önemli ölçüde daha yüksek toplam Tc1 (CD8+'da Tbet+), aktive edilmiş ve çoğalan Tc1 (CD67+'da Tbet+Ki44+CD8+), toplam Tc17 (CD8+'da RORɣT+), aktive edilmiş ve çoğalan Tc17 (CD67+'da RORɣT+Ki44+CD8+) gözlendi diğer tedavi gruplarıyla karşılaştırıldığında, in vivo olarak benimsenerek aktarılan Vacc DC'lerle (n = 4; Tek yönlü ANOVA Tukey testi). g Adaptif olarak transfer edilen Vacc DC'lerle tedavi edilen farelerde, in vivo olarak diğer tedavi gruplarıyla karşılaştırıldığında önemli ölçüde daha yüksek sitotoksik/düzenleyici T hücreleri (Tc1/Treg) oranı gözlendi (n = 4; Tek yönlü ANOVA Tukey testi). Veriler ortalama ± standart hata olarak temsil edilir.
Vacc DC'ler sistemik olarak uygulandığından, dalak ve servikal lenf düğümleri de doğuştan gelen ve kazanılmış bağışıklık tepkilerindeki değişiklikler açısından analiz edildi (Şekil XNUMX). S17-S20). Özellikle DC'lerin (CD11c+) ve aktive DC'lerin genel frekansı (CD86c+'da MHCII+CD11+, CD86c+'da MHCI+CD11+, CD86c+'da CD11+, CD11c+'da MHCI+, CD11c+'da MHCII+) kontrollerle karşılaştırıldığında dalakta önemli ölçüde daha yüksekti; ancak bu fark servikal lenf düğümlerinde gözlenmedi (Şekil XNUMX). S17 ve S18). Bu bulgular, DC'lerin adaptif transferinin öncelikle dalaktaki doğuştan gelen bağışıklık tepkilerini modüle ederek bağışıklık tepkileri ürettiğini göstermektedir. Tümörden farklı olarak Vacc DC gruplarında dalaktaki Th17 frekansında tüm kontrollere göre anlamlı azalmalar olduğu gözlendi (Şekil XNUMX). S19), tüm kontrollerle karşılaştırıldığında Th2 frekansında önemli artışlar (Şekil XNUMX). S19) ve tek başına PFK17 ve PFK15 + F15BP DC kontrollerine kıyasla Tc16 frekansında önemli bir azalma (Şekil XNUMX). S20). Bu bulgular, Vacc DC'lerin sistemik olarak uygulanmasına rağmen, proinflamatuar adaptif bağışıklık tepkilerinin dalakta değil esas olarak tümörde bulunduğunu göstermektedir. Ek olarak, farelerin dalağından izole edilen Vacc DC'ler de kontrollerle karşılaştırıldığında daha yüksek ECAR ve OCR'yi korumuştur (Şekil XNUMX). S21). Formülasyonun F16BP bileşeninin, doğal ve edinsel bağışıklık yanıtları üretmek açısından önemli olup olmadığını test etmek için Çözünür mRNA + çözünebilir poli (IC) ile yüklenen DC'ler, farelere retro-orbital olarak enjekte edildi ve doğal ve edinsel bağışıklık yanıtları iLN, dalak ve tümörlerde oluşturuldu test edildi ve tedavi uygulanmayan kontrolle karşılaştırıldı. Bu organlarda tedavi uygulanmayan kontrol ile çözünür mRNA + çözünür poli (IC) ile yüklenmiş DC'ler arasında gözlenen önemli bir fark olmadığından, pro-inflamatuar hem DC'lerin hem de T hücresi tepkilerinin arttırılması için DC'lere yüklenen F16BP'nin gerekli olduğu gözlendi. (İncir. S22).
- SEO Destekli İçerik ve Halkla İlişkiler Dağıtımı. Bugün Gücünüzü Artırın.
- PlatoData.Network Dikey Üretken Yapay Zeka. Kendine güç ver. Buradan Erişin.
- PlatoAiStream. Web3 Zekası. Bilgi Genişletildi. Buradan Erişin.
- PlatoESG. Otomotiv / EV'ler, karbon, temiz teknoloji, Enerji, Çevre, Güneş, Atık Yönetimi. Buradan Erişin.
- PlatoSağlık. Biyoteknoloji ve Klinik Araştırmalar Zekası. Buradan Erişin.
- ChartPrime. Ticaret Oyununuzu ChartPrime ile yükseltin. Buradan Erişin.
- Blok Ofsetleri. Çevre Dengeleme Sahipliğini Modernleştirme. Buradan Erişin.
- Kaynak: https://www.nature.com/articles/s41467-023-41016-z