Biyofilm özellikleri
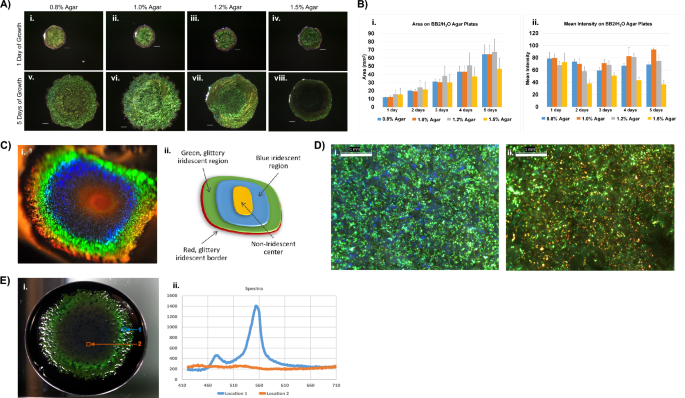
selulophaga lytica BB7489/H'de 24 saat büyütülen 2 biyofilm2Çeşitli agar konsantrasyonları içeren O besiyeri karşılaştırıldı (Şek. 1A, B). Renk desenleri, daha parlak kolonileri destekleyen %5 agar ile 1.0 gün sonra farklılık gösterdi. %1.2'den fazla agar içeren kültür ortamı, kolonilerin yayılmasının %1 veya daha az agar içerenlere kıyasla kısıtlanmış olmasına rağmen, büyümeye izin verdi. %1.5 agardan elde edilen biyofilmler, daha düşük ortalama piksel yoğunluğuyla daha küçüktü. Özel olarak belirtilmedikçe, bu çalışmadaki geri kalan veriler, BB1/H içeren %2 agar plakalarından elde edilen biyofilmlere dayanmaktadır.2O. %1 agar üzerinde devam eden inkübasyon, eşmerkezli, gradyan renklenmeye sahip biyofilmlerle sonuçlandı (Şek. 1C). Bu bölgelerin nispi boyutları ve yoğunlukları numuneler arasında farklılık gösterse de, olgun biyofilmlerdeki renklenme sırası değişmedi. Ek olarak, biyofilm merkezleri, muhtemelen içinde bulunduğu bilinen zeaksantin pigmenti nedeniyle genellikle altın-turuncu bir renge dönüştü. C. litika29. Radyal olarak dışa doğru ilerleyen sonraki renk bantları maviydi, ardından parlak bir yeşil ve biyofilmlerin çevresinde dar bir kırmızı bant vardı. Büyütme, renklerin, bu milimetre alanlarındaki baskın rengin algılanan makroskopik rengi belirlediği mozaikler olduğunu ortaya çıkardı (Şekil XNUMX). 1D). Daha da önemlisi, mozaikler C. litika bir renk yelpazesini yansıtan biyofilmler.
Belirli büyüme koşulları göz önüne alındığında, C. litika 7489, daha önce renksiz olduğu bildirilmiş olmasına rağmen, yoğun yanardöner biyofilmler oluşturur. (A) Temsilci C. litika 7489 biyofilm 27°C'de BB2/H üzerinde büyütüldü2%0.8, %1.0, %1.2 veya %1.5 agar içeren O agar plakaları. Biyofilmler 5 gün boyunca her gün görüntülendi. Agar konsantrasyonu, DSM 7489'un renk doygunluğunu ve genişlemesini etkiler C. litika biyofilmler. Ölçek çubuğu = 1 mm. (B) A'daki biyofilmlerin alanları (i) ve ortalama yoğunluk (ii) ölçümleri ImageJ kullanılarak günlük olarak kaydedildi. Veriler, standart sapma ±hata (her zaman noktası için n = 10) olarak gösterilen her bir zaman noktası için ortalamalar olarak sunulur. (C) C. litika 7489, eğik bir görüntüleme açısından (i) elde edilen bir biyofilmin bu fotoğrafında ve eşmerkezli renklenmeyi gösteren şemada (ii) gösterildiği gibi bir dizi yoğun renk üretme yeteneğine sahiptir. (D) Biyofilmin makroskopik olarak yeşil (i) ve kırmızı (ii) görünen bölgelerinin noktasal renklerin mozaikleri olduğunu gösteren optik görüntüler. (çubuk = 1 mm) (E) Temsili bir hiperspektral veri küpü, olgun biyofilmlerde sinyal yoğunluğunda bölgeye özgü varyasyonları ortaya çıkarır. (i) Biyofilm, siyah mürekkep içeren besleyici agar üzerinde 10 cm'lik bir petri kabında büyütüldü. Dedektörün biyofilm yüzeyine normal olduğunu unutmayın. Konumu, biyofilme kıyasla yansıma yoğunluğunun azalmasının nedenidir (C-Ben). Biyofilmin dış bölgeleri, biyofilm boyunca yapıcı ve tutarlı bir yansıma olduğunu düşündüren, 550 nm'ye yakın merkezli, özellikle keskin bir tepe noktası oluşturur. (ii, konum 1) Buna karşılık, merkez bölgedeki yansımalar temel çizgiye yakın kalır. (ii, konum 2)
Canlıların toplu optik tepkilerini temsil eden veri küpleri oluşturmak için bir Resonon masaüstü hiperspektral sistemi kullanıldı. C. litika biyofilmler (Şek. 1E). Görünür aralığı kapsayan spektrumlar toplandı ve 550 nm civarında ortalanmış artan yoğunluklar gösterdi. Keskin tepe noktası, biyofilm aracılığıyla yapıcı ve tutarlı yansımaların meydana geldiğini gösterir. Buna karşılık, biyofilmin merkezi ile ilişkili yoğunluklar temel seviyelere yakın kalır. Diğer deneylerde, geri saçılmış geometri ve değişken uyarma açıları kullanılarak, algılama açısına bir bağımlılık kurulmuştur (Ek Şekil XNUMXa). 1).
Hücresel düzenleme, paketlenme ve morfoloji C. litika 7489 biyofilm
Önceki çalışmalar flavobakteri biyofilmler, hücresel aralığın ve morfolojinin yansıyan dalga boylarını etkilediğini ortaya çıkardı21,30. Renk farklılıklarını anlamak için C. litika 7489 biyofilm, tamamlayıcı mikroskopi teknikleri uygulandı. düzenlemesi C. litika biyofilmlerin içinde, SYTO9 ile boyanmış sabit biyofilmlerin konfokal mikroskopisi kullanılarak görselleştirildi (Şekil XNUMXb). 2A). Yanardönerlik ile ilişkili olmayan biyofilm bölgeleri, rastgele yönlendirilmiş hücreler içerir, ancak küçük hizalanmış hücre kümeleri de gözlemlenmiştir. Bu bölgede de bulunan küresel yapıların sayısı, görüntüleme düzlemi alt tabakaya yaklaştıkça arttı (Ek Şekil XNUMXa). 2A). Buna karşılık, yanardöner bölgelerdeki hücreler, yeşil yanardöner bölgenin görüntüsünün hızlı Fourier dönüşümünde (FFT) onaylandığı gibi, yakından paketlendi ve düzlemsel, çok kristalli katmanlar halinde sıralandı (Ek Şekil XNUMXa). 2B). Sıralama, hücrelerin yönlerindeki bir değişiklikle gösterilen tanecik sınırlarıyla onlarca mikron üzerinde devam etti.
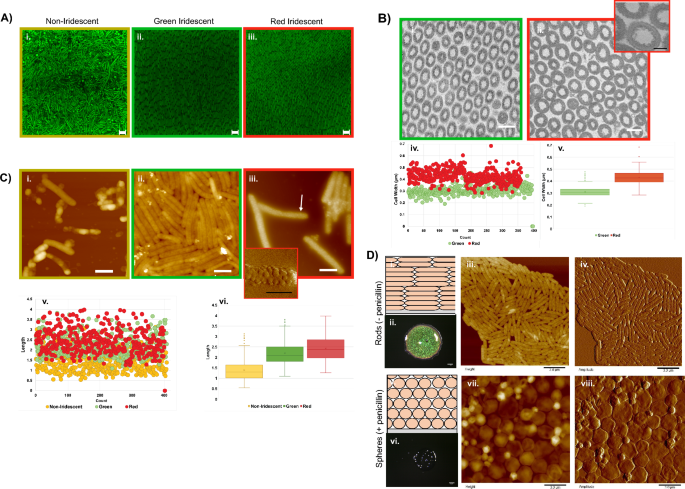
Biyofilm hücrelerinin mikroskopisi. (A) Hücresel organizasyonun yanardöner olmayan (i) ve yanardöner bölgeler (ii, iii) (bar = 9 µm) arasında farklılık gösterdiğini gösteren SYTO2.0 ile boyanmış biyofilmlerin konfokal görüntüleri. (B) Yeşil (i) ve kırmızı bölgelerin (ii) Geçirgen Elektron Mikroskobu (TEM) kesit görüntüleri. (bar = 0.5 µm) Ek (iii) hücre duvarlarını çevreleyen küçük çıkıntıları gösterir (bar = 200 nm). Genişlik ölçüleri (iv, v) de bölgeye göre farklılık gösterir. (C) Yanardöner olmayan (i), yeşil yanardöner (ii) ve kırmızı yanardöner (iii) bölgelerin Atomik Kuvvet Mikroskobu (AFM) yükseklik görüntüleri, farklı hücresel morfolojilerin her bir bölgeyle ilişkili olduğunu gösterir (bar = 1.0 µm). Ek (iv), okla gösterilen bölgenin bir AFM genlik görüntüsüdür (çubuk = 0.5 µm). Belirtilen biyofilm bölgelerinden (v, vi) uzunluk ölçümleri. (D) BB2/H'de ortam koşullarında büyütülen 2 günlük biyofilmler2O agar (optik ölçek çubukları = 1 mm; AFM çubukları = 3 µm). Yanardöner biyofilmlerdeki hücrelerin tipik düzenini gösteren şematik (i). Yanardöner biyofilmin optik görüntüsü. (ii) tipik çubuk şekli morfolojisini gösteren yanardöner biyofilmden hücrelerin AFM yüksekliği (iii) ve genlik (iv) görüntüleri. Ölümcül olmayan penisilin eklendiğinde gelişen biyofilmlerdeki hücrelerin öngörülen düzenini gösteren şematik (v). Ölümcül olmayan penisilinin yapısal renklenmeyi bozduğunu gösteren biyofilmin optik görüntüsü. (vi) Hücrelerin AFM yüksekliği (vii) ve genlik (viii) görüntüleri, penisilin tedavisi nedeniyle kürelere dönüştüğünü doğrulamaktadır.
Ökaryotlar, çalışma sırasında işlenebilen ve manipüle edilebilen dokulara yanardönerliğe katkıda bulunan bileşenleri yerleştirir. C. litika bununla birlikte yanardönerlik, aşırı hidrasyondan kaynaklanan türbülans da dahil olmak üzere mekanik rahatsızlıklarla kolayca ayrılan bağımsız, gevşek bir şekilde ilişkili hücrelerden elde edilir. Hücrelerin glutaraldehit ile çapraz bağlanması, yanardönerliği korudu ve bozulmamış biyofilmlerin transmisyon elektron mikroskobu (TEM) ile karakterizasyon için agardan çıkarılmasına izin verdi. Sabit kesitli elektron mikrografları C. litika 7489 biyofilm, yanardöner alanlarda periyodikliği doğruladı (Şekil XNUMX). 2B). Yeşil ve kırmızı bölgelerdeki hücreler sırasıyla 310 nm ve 428 nm ortalama genişliğe sahipti, bu da hücre genişliğindeki değişikliklerin renk varyasyonlarına katkıda bulunduğunu gösterir. Ayrıca, kırmızı bölgeden alınan hücrelerin daha yüksek büyütmeli TEM görüntüleri, hücre duvarlarını çevreleyen küçük çıkıntılar ortaya çıkardı (Şekil XNUMXb). 2B-iii). Taramalı elektron mikroskobu (SEM) kullanılarak elde edilen biyofilmlerin yanal görüntüleri, sıralamanın 15 ila 60 µm arasında değişen biyofilmlerin tam kalınlığı boyunca gerçekleştiğini göstermektedir (Ek Şekil XNUMXa). 2C).
TEM verilerinde gözlemlenen genişlik farklılıkları ve biyofilmin belirli bölgeleriyle olan ilişki göz önüne alındığında, atomik kuvvet mikroskobu (AFM) kullanarak hücrelerin morfolojilerini karşılaştırmaya çalıştık (Şekil XNUMX). 2C). Yanardöner olmayan bölgeden gelen hücreler düzensizdi, küresel çıkıntılarla ilişkiliydi ve sıklıkla sönük görünüyordu. Aksine, hem kırmızı hem de yeşil yanardöner bölgelerden gelen hücreler, sağlıklı çubuk şeklindeki bakterilerden beklendiği gibi düzenli morfolojileri ve boyutları korudu. Agregaları bozmak için tekrarlanan girişimlere rağmen, yeşil yanardöner bölgelerden gelen hücreler, hücre yüzey özelliklerinin de bölgeye göre değiştiğini gösteren, yakından ilişkili kaldı (Şekil XNUMXb). 2C-ii). Tam tersine, kırmızı bölgeden gelen hücreler genellikle zar vezikülleriyle kaplıydı (Şekiller. 2C-iii ve iv ve Ek Şekil. 3). Dahil olmak üzere gram negatif bakteriler C. litika dış zar vezikülleri ürettiği bilinmektedir31,32. Bununla birlikte, veziküller tarafından tam yüzey kaplaması dikkat çekiciydi. Daha iyi tanımlanmış AFM görüntüleri, TEM kesitlerinde gözlenen zar çıkıntılarının veziküller olduğunu düşündürdü. Farklı bölgelerdeki hücrelerin uzunluklarının karşılaştırılması, yanardöner olmayan hücrelerin, sırasıyla 1.39 um, 2.20 um ve 2.42 um ortalama değerlerle yeşil veya kırmızı bölgelerdekilerden daha kısa olduğunu ortaya çıkardı (Şekil XNUMXa). 2Özgeçmiş, vi). Birlikte ele alındığında, görüntüleme verileri, hücrelerin biyofilm içindeki konumuna bağlı olarak farklı boyut ve yüzey topolojileri gösterdi.
Gram-negatif bakterilerde bulunan peptidoglikan, hücrenin mekanik stabilitesini sağlayan kafes benzeri bir polimerdir. Sitoplazmik zar ile dış zar arasında yer alan şekli, bakterilerin morfolojisini belirler. Lizozim ve beta laktam antibiyotiklerin peptidoglikanı bozduğu ve hücre lizisine neden olduğu yaygın olarak bilinmektedir. Bununla birlikte, ölümcül olmayan dozlarda, dahil olmak üzere Gram-negatif bakteriler E. coli tedaviden sağ kurtulur ancak çubuklardan kürelere dönüştürülür33,34,35. Renklenmenin intakt peptidoglikan gerektirip gerektirmediğini belirlemek için, inokülasyondan önce agar plakalarına 30 µg/mL penisilin eklendi. C. litika (İncir. 2D). 48 saat sonra, işlenmiş biyofilmler, dönüşümü nedeniyle yanardönerlikten yoksundu. C. litika peptidoglikanın yanardönerlik için önemini gösteren küreler halinde. Bu sonuçlar ayrıca eksojen şekil değiştirici reaktiflerin biyofilm optik özelliklerini etkilemek için kullanılabileceğini gösterdi.
Üretim için biyofilmlerin ölçeklenebilirliği ve ayarlanabilirliği
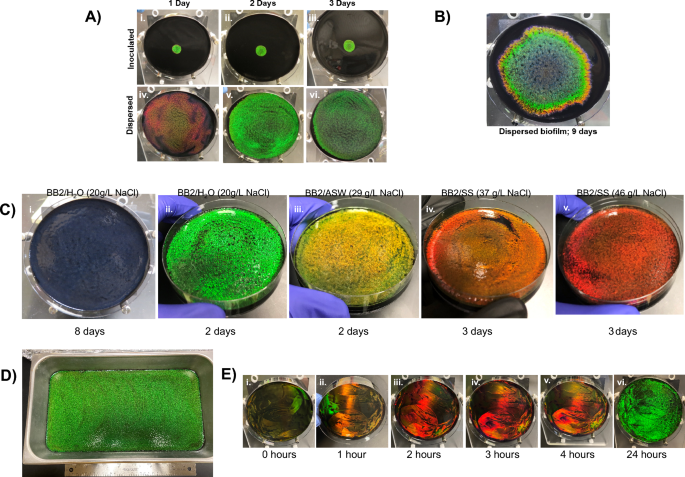
selulophaga lytica biyofilmler aşılama noktasından radyal olarak genişledi ve bantlı renkler sergiledi (Şekil XNUMXb). 1A). Bu modellenme muhtemelen, hücre büyümesi sırasında yerel ortamdaki değişikliklerin (örn. besin mevcudiyeti, pH, metabolitler, vb.) neden olduğu hücre morfolojilerindeki zamansal farklılıkların bir sonucuydu. Tek renkli biyofilmler tutarlı morfolojiler gösterdiğinden, tüm agar yüzeyine bir kerede yeterli hücre eklemenin tüm hücreleri aynı anda aynı ortama maruz bırakacağını ve yansıyan rengi senkronize edeceğini düşündük. Bu hipotez, lokalize 100µL inokulumla başlatılan biyofilmler ile aynı hacimdeki inokulumun bir hücre yayıcı kullanılarak agar üzerine dağıtıldığı biyofilmler karşılaştırılarak test edildi. (İncir. 3A) Temsili fotoğraflar, ortam koşullarında 1 günlük büyümeden sonra, aşılanmış biyofilmlerin plakanın merkezi çevresinde parlak yeşil yanardönerliği yansıttığını, oysa dağılmış biyofilmlerin plaka yüzeyi boyunca dağınık şekilde kırmızı olduğunu göstermektedir. 2 günlük büyütmeden sonra, her iki preparat da parlak yeşil yanardönerlik verdi, ancak dağılmış biyofilmler agarın tüm yüzeyini kapladı. Dağınık biyofilmlerdeki yanardönerlik 3 gün sonra önemli ölçüde azaldı. Ek zamanla, aşılanmış biyofilmler, agar yüzeyinin çoğunu kaplayacak şekilde genişledi (Şekil XNUMXa). 3B). Bu nedenle, hücrelerin dağıtılması, hem optimum yanardönerlik süresini kısalttı hem de düzenli monokromatik bakterilerle kaplı plaka alanını genişletti.
Kientz ve ark. tuzluluğun CECT 8139 biyofilmlerinin renklenmesini etkilediğini gösterdi, DSM 7489 biyofilmleri de benzer şekilde test edildi27 (İncir. 3C). Ortam, Instant Ocean (BB2/ASW) veya Lake Products Sea Salt ASTM D1141-98 (BB2/SS) deniz tuzu analogu ile zenginleştirildi. BB2/H'deki dağınık biyofilmlerle karşılaştırıldığında2O, BB2/ASW ve BB2/SS'deki büyüme, ortama eklenen deniz tuzu analoğunun miktarıyla ilişkili kırmızı kaymalara sahip neredeyse monokrom koloniler üretti. Analogların temel olarak NaCl konsantrasyonlarında farklılık gösterdiği göz önüne alındığında, NaCl konsantrasyonunun arttırılmasının, BB2/H üzerinde biyofilmler büyüterek kırmızıya kaymış renkleri oluşturmak için yeterli olup olmadığını test ettik.2Değişken miktarlarda NaCl ile desteklenmiş O plakaları (Ek Şekil XNUMXa). 4A). Lokalize plakalarda artan NaCl konsantrasyonları kırmızıya kaymış renklere yol açarak biyofilmin özelliklerinin dışsal olarak manipüle edilmesine izin verdi. Şekil l'de gösterilen bantlar 1 yansıtmak menzil tarafından üretilebilen renklerin C. litika biyofilmler. Burada, BB2/H'de erken bir renk olan kırmızıyı gösteriyoruz.2O agar plakaları, yetiştirme ortamının tuzluluğunun arttırılmasıyla, mavi ise yetiştirme süresinin uzatılmasıyla oluşturuldu. Birlikte ele alındığında, renklenmenin zamansal yönünün, yerel çevreye verilen hücresel tepkilerden türetildiği sonucuna vardık.
Tek renkli biyofilmler. (A) Ortam sıcaklığında aşılanmış (i–iii) ile dağılmış (iv–vi) biyofilmlerin karşılaştırması. Dağınık biyofilmler tek renkli renkte zirve yapar ve 2. günde (v) plakayı doldurur. (B) Oysa aşılanmış biyofilmler bantlı renklenme geliştirir ve yüzeyi kaplamak için önemli ölçüde daha fazla zaman gerektirir. (C) Dağıldığını gösteren fotoğraflar C. litika hücreler, muhtemelen tüm hücreleri aynı anda homojen büyüme koşullarına (besinler, metabolitler, vb.) maruz bırakarak çeşitli renklerde tek renkli biyofilmlere yol açar. Deniz suyu benzerleri kullanılarak büyüme periyodunu uzatarak (i) veya ortam tuzluluğunu değiştirerek (ii – v) renk aralığına erişilebilir. Parantez içinde verilen tarifte etkili NaCl. Plakalar, belirtilen süre boyunca ortam koşullarında büyütüldü. (D) 3 x 41 cm'lik bir tepsinin yüzeyine orantılı bir inokulum dağıtılarak ortam koşullarında 23 gün içinde büyük bir yeşil biyofilm üretildi. (E) 50 kat konsantre kültür alikotlarının sıralı uygulaması ve dağıtılması, tek renkli biyofilm oluşumunu 24 saat veya daha kısa bir süreye düşürür, bu da hücrelerin hemen organize olmaya başladığını ve hücre yoğunluğunun endüstriyel üretim uygulamaları için önemli bir husus olacağını düşündürür. Plakalar, hücre uygulamaları arasında 27 °C'de inkübe edildi. Ek şekilde gösterilen ek denemeler 4E, F.
41 cm x 23 cm'lik bir agar yüzeyine orantılı olarak daha büyük bir inokulum dağıtmak, oda sıcaklığında 3 günlük inkübasyondan sonra yüzeyi dolduran tek renkli bir biyofilm oluştururken, lokalize bir inokulum sınırlı bir yanardöner alana yol açtı (Şekil XNUMXa). 3D, Tamamlayıcı 4B). Geniş alanlı tek renkli biyofilmler oluşturma süresini daha da azaltmak için, inokülumdaki hücrelerin artmasının daha hızlı yanardönerliğe yol açıp açmadığını test ettik. Spesifik olarak, gece boyunca kültürler, hücreler agar üzerinde dağıtılmadan önce konsantre edildi. Yanardönerliğin ortaya çıkma hızı, yüzey boyunca dağılmış inokulumun kat konsantrasyonu ile ilişkilidir (Ek Şekil XNUMXa). 4C). Katmanlama stratejisi, agar plakalarına seri olarak 50 kat konsantre hücrelerin uygulandığı yanardöner oluşumunu daha da hızlandırdı (Şekiller. 3E, Ek Şekiller. 4E, 4F, 5, 6) Özellikle canlı sarı ve kırmızı yansımalar, aşılanmış plakanın çevresinde geçici olarak kırmızının ve ardından yeşilin görüldüğü aşılanmış biyofilmlerdeki renklendirme dizisiyle tutarlı olarak erken ortaya çıktı. 24 saatte tüm plaka yeşil yansıdı. Birlikte, bu sonuçlar, hücrelerin hızla fotonik yapılar halinde organize olabildiğini ve hücre sayısının yanardöner biyofilmlerin oluşumu için sınırlayıcı bir faktör olduğunu göstermektedir.
Biyofilmlerin malzemelere dahil edilmesi
Kalitatif filtre kağıdı (Whatman, Grade 2), polyester track-etch membranlar (Sterlitech), pamuklu kumaş ve besleyici agar üstünde ipek dahil olmak üzere gözenekli substratlar üzerinde büyüme test edildi. Medya tutma ve besin difüzyonu, bu substratlar üzerinde biyofilm büyümesine ve genişlemesine izin verdi. Daha da önemlisi, yansıyan renk desenleri, doğrudan agar plakaları üzerinde büyüyen biyofilmlerinkine benzerdi (Şekil XNUMXb). 4). Test edilen substratlardan, yanardöner biyofilmin kalitesi, düşük substrat maliyeti ve esnekliği nedeniyle daha fazla çalışma için filtre kağıdı seçildi. Büyüdükten sonra, kağıtla ilişkili biyofilmler (PAB'ler), yanardönerliği korumak için fiksasyon için glutaraldehit içeren agar'a aktarıldı. Kağıt, karakterizasyon ve sonraki işlemler sırasında biyofilmin işlenmesini kolaylaştırdı. PAB'lerin yanardönerliği kuruduktan sonra kayboldu, ancak su ilavesiyle hızla eski haline döndü (Şekil 4C). PAB'ler, minimum yanardönerlik kaybıyla çoklu kurutma ve rehidrasyon döngülerini tolere etti. Sabit kağıt biyofilmlerin AFM görüntülemesi, hücrelerin kristal düzenini doğruladı (Ek Şekil XNUMXa). 7B).
Kağıt da dahil olmak üzere gözenekli alt tabakalar üzerinde yanardöner biyofilmlerin ortam büyümesi, karakterizasyon ve sonraki işlemler için kullanımı kolaylaştırır. (A) C. litika biyofilmler, çeşitli gözenekli substratlar üzerinde ortam koşullarında büyütüldü. (B) Besin agarının üzerine yerleştirilen Whatman 2 filtre kağıdı, izin veren birkaç gözenekli substrattan biridir. C. litika yanardöner koloniler oluşturmak için. Agar plakalarında olduğu gibi, canlı kağıtla ilişkili biyofilmler (PAB'ler), BB3/H üzerinde 2 günlük büyümeden sonra yeşil renktedir.2O agar (Ai) ve BB2/SS'de (A-ii) olduğu gibi tuzluluk arttığında kırmızıya kayar. (C) PAB'ler, agardan çıkarıldıktan ve glutaraldehit (Bi) ile sabitlendikten sonra yanardönerliklerini korurlar. Sabit PAB'lerin nitrojenle kurutulması, yanardönerliklerini (B-ii) kaybetmelerine neden olur. Ancak rehidrasyon (B-iii) üzerine yapısal renk geri yüklenir. (D) Yaşayan PAB'ler, çevresel ipuçlarına yanıt verme yeteneklerini korurlar. BB2/H'den gelen PAB'ler2O agar, yansımaların kırmızıya kaydırıldığı BB2/SS plakalarına taşınana kadar çoğunlukla yeşili yansıtır (sırasıyla Ci ve C-ii). Benzer şekilde, BB2/SS agar plakalarından kaynaklanan PAB'ler kırmızıdır ancak BB2/H üzerine yerleştirildiklerinde yeşile dönerler.2O (sırasıyla C-iv ve Cv). Her iki durumda da, biyofilmler orijinal ortam durumuna (C-iii ve C-vi) geri döndüklerinde orijinal renge geri dönebilir. Sabit biyofilmler bu dinamik davranışı göstermezler (C-vii ve C-viii).
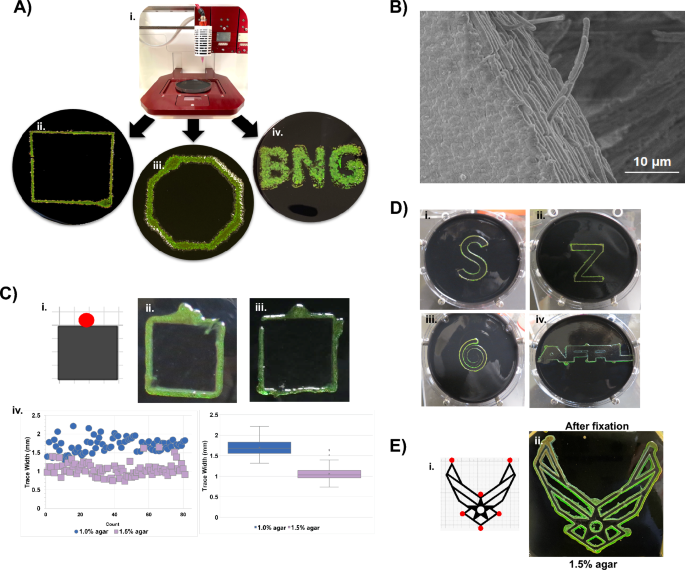
C. litika yanardöner bir bioink olarak kullanılabilir. (A) içeren 3D baskılı tasarımlar C. litika bir Allevi 3 Bioprinter düzeneği (Ai ila A-iv) kullanılarak agar üzerinde üretildi. Dağınık biyofilmler için daha önce gösterildiği gibi, artan tuzluluk kırmızıya kayar. C. litika mürekkebin yansıması. (Ek şek. 9()B) Basılı biyofilmin sıralı hücrelerini gösteren 3D baskılı biyofilmin kenarının SEM görüntüsü. (C, D) C. litika bir kağıt şablonun kenarlarını izleyin (örn. Ci'de şematik). Şablon tasarımındaki kırmızı daire, aşılama bölgesini gösterir. Hücreler, ortam koşullarında çeşitli desenler yazmak için kendi kendini yazdıran bir biyo-mürekkep gibi davranır. (B) Agar konsantrasyonunun %1.0'dan (C-ii) %1.5'e (C-iii) arttırılması, Keyence ölçümlerinde (C-iv) ortaya konulduğu gibi izleme genişliğini azaltır. Bu sonuç, kayma motilitesinin, hücreleri daha yüksek konsantrasyonlu agarda kalıba daha yakın sınırlayacak şekilde modüle edildiğini göstermektedir. (D) Ek izlemeler, BACTracing'in değişen karmaşıklıktaki şekiller, açılar ve bağlantılarla kullanılabileceğini göstermektedir. Agar konsantrasyonu, Hava Kuvvetleri Sembolü gibi karmaşık desenlerde olduğu gibi, özellikler arasındaki mesafe küçük olduğunda izleri sınırlamak için kullanılabilir (ek Şekil XNUMX). 6C). (E) Yanardöner desenin korunabileceğini gösteren sabitleme sonrası karmaşık bir modelin şablonu (i) ve bunun BACTraced muadili (ii).
Canlı PAB'ler (yani fiksasyon olmadan), çevresel ipuçlarına yanıt verme yeteneklerini korudu. Örneğin, BB2/H'deki PAB'ler2O agar plakaları, yansımanın kırmızıya kaydırıldığı ve bunun tersinin olduğu BB2/SS plakalarına taşınana kadar çoğunlukla yeşili yansıtıyordu (Şek. 4D). Her iki durumda da, biyofilmler, orijinal ortam durumuna geri döndüklerinde orijinal renklerine geri döndüler (Ek Şekil XNUMXa). 8A). Bu geri dönüş, hücreler glutaraldehit ile sabitlendiğinde gerçekleşmedi, bu da canlı hücrelerin renk değişiklikleri için algılama ve tepki verme yeteneğinin gerekli olduğunu doğruladı. Lokalize ve dağılmış biyofilmlerde olduğu gibi, penisilin ve lizozim gibi eksojen reaktifler, biyofilm özelliklerini kontrol etmek için kağıt substrat yoluyla biyofilme iletilebilir (Ek Şekil XNUMXa). 8B).
selulophaga lytica yanardöner mürekkepler olarak biyofilmler
dayalı sıralı bakteriyel mürekkepler geliştirmek isteyen C. litika, hücreleri önceden programlanmış kalıplarda biriktirmek için bir Allevi 3™ biyoyazıcı kullanıldı ve şekillerden harflere kadar değişen STL tasarım dosyaları oluşturmak için Google SketchUp kullanıldı. Basılı kültürler, BB2/H'de istenen kalıpları korudu227 °C'de inkübasyon ve büyümeden sonra O plakaları (Şek. 5A). Desenler aynı zamanda, artan tuzluluğun rengi yeniden kırmızıya kaydırdığı BB2/ASW agar plakalarına da basılmıştır. (Ek Şekil. 9A) Çapraz bağlanmış biyofilmlerin müteakip SEM görüntüleri, bakterilerin basılı şekillerde sıkıca paketlendiğini ve sıralandığını gösterdi (Şekil XNUMXb). 5B).
Yanardöner biyofilmler oluşturmak için bakteriyodetlerde hareketlilik gereklidir20,30. Bu çalışmadan elde edilen konfokal görüntüler, muhtemelen arayüz etkileşimleriyle birlikte agar yüzeyindeki hücrelerin yönlü akışından kaynaklanan hücreler arasındaki hizalamayı göstermektedir. Kayan hücrelerin yolundaki engellerin hücre akışının yönünü değiştireceğini ve bu engelleyici yönlendirmenin bir tür "kendi kendine basan" bakteri mürekkebi ile sonuçlanabileceğini varsaydık. Bu fikri test etmek için, kağıda bitişik bir inokulum eklenmeden önce besleyici agar plakalarına kağıt şablonlar yerleştirildi (Şek. 5C, Ek Şekil. 9B) Kuluçka sırasında hücreler, bakteriyel otonom toplu izleme ("BACTracing" olarak da bilinir) dediğimiz bir işlemle şablonların kenarları boyunca yanardöner izler oluşturdu. BACTracing, hem %1 hem de %1.5 agar plakalarında gerçekleşti, ancak daha yüksek agar konsantrasyonu daha dar izlere yol açtı. Sıcaklık ayrıca BACTracing ile oluşturulan kalıpların kalitesini de etkiler (Ek Şekil XNUMX). 10). BACTracing'in canlı materyalin gelişmiş baskısı için kolay bir yaklaşım olabileceğini düşündüren, az sayıda aşılama bölgesi kullanılarak giderek daha karmaşık desenler basılmıştır (Şekil XNUMXa). 5E).
- SEO Destekli İçerik ve Halkla İlişkiler Dağıtımı. Bugün Gücünüzü Artırın.
- PlatoData.Network Dikey Üretken Yapay Zeka. Kendine güç ver. Buradan Erişin.
- PlatoAiStream. Web3 Zekası. Bilgi Genişletildi. Buradan Erişin.
- PlatoESG. Otomotiv / EV'ler, karbon, temiz teknoloji, Enerji, Çevre, Güneş, Atık Yönetimi. Buradan Erişin.
- PlatoSağlık. Biyoteknoloji ve Klinik Araştırmalar Zekası. Buradan Erişin.
- ChartPrime. Ticaret Oyununuzu ChartPrime ile yükseltin. Buradan Erişin.
- Blok Ofsetleri. Çevre Dengeleme Sahipliğini Modernleştirme. Buradan Erişin.
- Kaynak: https://www.nature.com/articles/s41598-023-38797-0