17 Ocak 2024
(Nanowerk Haberleri) Kanazawa Üniversitesi Nano Yaşam Bilimleri Enstitüsü'ndeki (WPI-NanoLSI) araştırmacılar, Nano Letters (“E6AP E3 ligaz HECT alanının yapısal dinamikleri ve esnek menteşe halkasının ubikuitin zincir sentez mekanizmasına katılımı”) bir protein menteşesinin esnekliğinin, anahtar hücre süreçlerinde proteinlerin transferinde nasıl önemli bir rol oynadığı.
Göz alıcı görüntü: E6AP HECT alanının konformasyonel değişikliklerinin gerçek zamanlı gözlemi ve simülasyonu.
HECT alanı, esnek bölge boyunca küresel ve eliptik konformasyonları tekrarlar. Bilgisayar simülasyon sonuçları, küresel şeklin katalitik yapıya, oval şeklin ise L şeklindeki yapıya karşılık geldiğini göstermektedir. Ubikitin dimerinin (Ub2) oluşum verimliliği, esnek menteşe bölgesinin konformasyonel durumuna bağlı olarak önemli ölçüde değişir. Ubikitinasyon (ubikuitin proteininin eklenmesi) protein bozulması, DNA onarımı ve sinyal iletimi gibi birçok hücre sürecinde önemli bir aşamadır. WPI-NanoLSI, Kanazawa Üniversitesi'nden Hiroki Konno ve Holger Flechsig liderliğindeki araştırmacılar, yüksek hızlı atomik kuvvet mikroskobu (HS-AFM) ve moleküler modellemeyi kullanarak, her yerde bulunmayla ilgili bir enzim menteşesinin hareketliliğinin, her yerde bulunmanın gerçekleşmesine nasıl izin verdiğini belirlediler. Önceki çalışmalar, ubikuitini aktive eden bir enzim (E1), onu konjuge eden bir enzim (E2) ve ubikuitin proteininin hedef proteine bağlanmasını (yani bir ligaz, E3) katalize eden bir enzim dahil olmak üzere, ubikuitinasyonu kolaylaştıran bir dizi enzim tanımlamıştır. Şekil 1).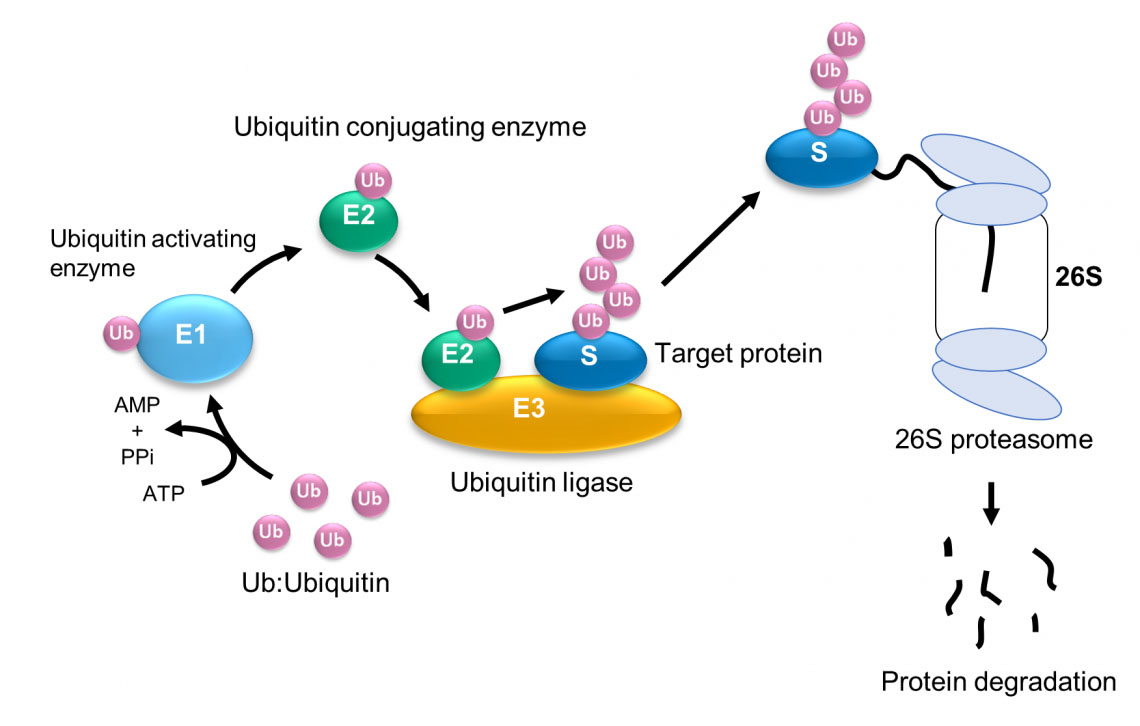 Şekil 1: Ubikitinasyon ve proteinin ubikuitin-proteazom sistemi tarafından bozunması. (© 2023 Takeda)
HECT tipi E3 ligaz, E2 bağlama bölgesine sahip bir N lobu ve katalitik Cys kalıntısına sahip bir C lobu içeren bir HECT alanı ile karakterize edilir. Esnek bir menteşe iki lobu birbirine bağlar ve bu da her yerde bulunmanın şu şekilde kolaylaştırıldığı hipotezine yol açar: proteinin bu menteşe etrafında yeniden düzenlenmesi. Konno ve işbirlikçileri, durumun böyle olduğuna dair kanıt bulmak için yüksek hızlı atomik kuvvet mikroskobunu kullandılar.
Araştırmacılar, HECT alanı bir tür E2 enzimi ile kristalleştirildiğinde, HECT alanının katalitik Cys kalıntısı ile E2 enziminin katalitik Cys'si arasındaki mesafenin 41 Å olacak şekilde bir L şekli oluşturduğunu belirtti. ubikuitin transferi. Bununla birlikte, katalitik konformasyonunda HECT alanı, iki katalitik Cys kalıntısı arasındaki mesafenin çok daha yakın olduğu (sadece 8 Å) farklı bir şekle sahiptir, dolayısıyla bunun bir "katalitik konformasyon" olduğu düşünülmektedir.
E6AP'nin vahşi tip HECT alanının HS-AFM görüntülerinin analizi, biri küresel, diğeri oval görünen iki konformasyonu ortaya çıkardı (Şekil 2). AFM simülasyonları kullanarak oval şekilleri L konformasyonuna bağladılar ve küresel şekiller ya katalitik konformasyon ya da Cys kalıntıları arasındaki mesafenin 16 Å olduğu başka bir HECT alanı tipinde gözlemlenen ters T konformasyonu olarak adlandırıldı ( İncir. 2). Görüntülemenin uzay-zamansal çözünürlük sınırlamalarının üstesinden gelmek için deneyler, HECT alanı konformasyonel hareketlerini atomistik seviyede görselleştirmek üzere moleküler modelleme ile tamamlandı. Simülasyon AFM, küreselden oval şekilli topoğrafyaya geçişi açıkça gösteren, karşılık gelen bir sahte AFM filmi oluşturmak için kullanıldı (Şekil 2).
Şekil 1: Ubikitinasyon ve proteinin ubikuitin-proteazom sistemi tarafından bozunması. (© 2023 Takeda)
HECT tipi E3 ligaz, E2 bağlama bölgesine sahip bir N lobu ve katalitik Cys kalıntısına sahip bir C lobu içeren bir HECT alanı ile karakterize edilir. Esnek bir menteşe iki lobu birbirine bağlar ve bu da her yerde bulunmanın şu şekilde kolaylaştırıldığı hipotezine yol açar: proteinin bu menteşe etrafında yeniden düzenlenmesi. Konno ve işbirlikçileri, durumun böyle olduğuna dair kanıt bulmak için yüksek hızlı atomik kuvvet mikroskobunu kullandılar.
Araştırmacılar, HECT alanı bir tür E2 enzimi ile kristalleştirildiğinde, HECT alanının katalitik Cys kalıntısı ile E2 enziminin katalitik Cys'si arasındaki mesafenin 41 Å olacak şekilde bir L şekli oluşturduğunu belirtti. ubikuitin transferi. Bununla birlikte, katalitik konformasyonunda HECT alanı, iki katalitik Cys kalıntısı arasındaki mesafenin çok daha yakın olduğu (sadece 8 Å) farklı bir şekle sahiptir, dolayısıyla bunun bir "katalitik konformasyon" olduğu düşünülmektedir.
E6AP'nin vahşi tip HECT alanının HS-AFM görüntülerinin analizi, biri küresel, diğeri oval görünen iki konformasyonu ortaya çıkardı (Şekil 2). AFM simülasyonları kullanarak oval şekilleri L konformasyonuna bağladılar ve küresel şekiller ya katalitik konformasyon ya da Cys kalıntıları arasındaki mesafenin 16 Å olduğu başka bir HECT alanı tipinde gözlemlenen ters T konformasyonu olarak adlandırıldı ( İncir. 2). Görüntülemenin uzay-zamansal çözünürlük sınırlamalarının üstesinden gelmek için deneyler, HECT alanı konformasyonel hareketlerini atomistik seviyede görselleştirmek üzere moleküler modelleme ile tamamlandı. Simülasyon AFM, küreselden oval şekilli topoğrafyaya geçişi açıkça gösteren, karşılık gelen bir sahte AFM filmi oluşturmak için kullanıldı (Şekil 2).
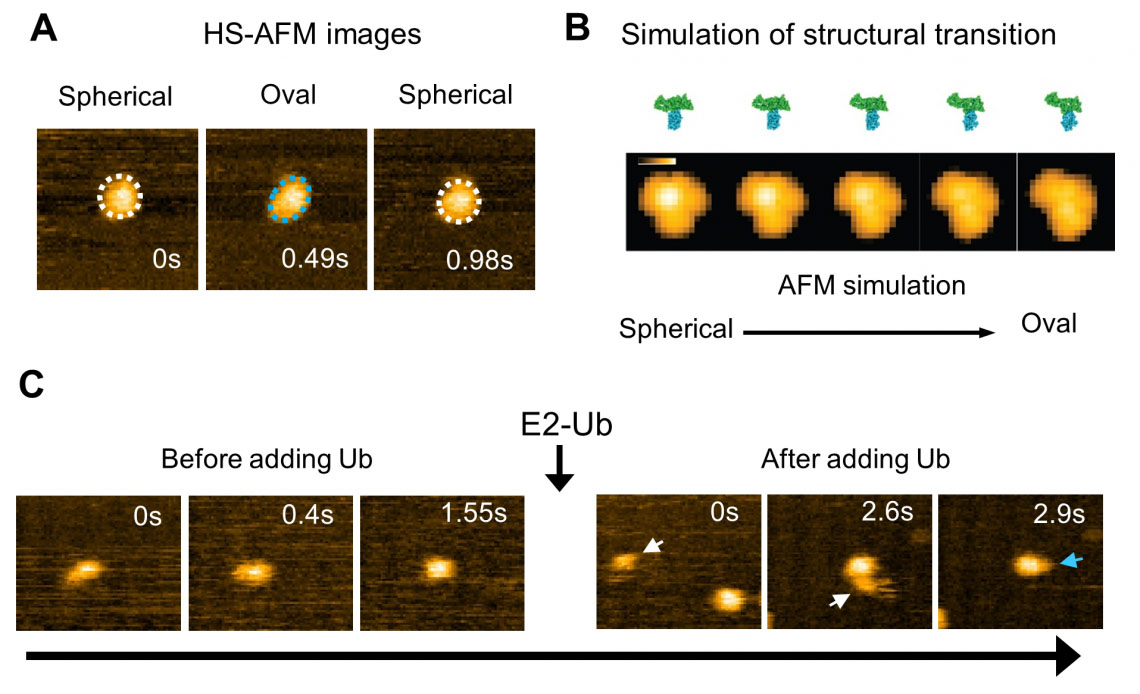 Şekil 2: E6AP'nin HECT alanının yapısal dinamiklerinin yüksek hızlı AFM gözlemi ve simülasyonu. (A) HECT alanının HS-AFM görüntüsü. Küresel (beyaz noktalı çizgi) ve oval (mavi noktalı çizgi) konformasyonel durumlar gözlendi. (B) HECT alanının yapısal durumunun ve sahte AFM görüntüsünün simüle edilmiş geçiş süreci. (C) Ubiquitin (Ub), E2'den E3'e (HECT alanı) aktarılır. Ubikuitin içeren E2'nin (E2-Ub) eklenmesinden sonra, E2-Ub (beyaz ok) HECT alanına bağlanır ve E2 ayrıştıktan sonra, ubikuitin gibi görünen küçük bir parçacık (mavi ok) HECT alanına eklenir. . (© 2023 Takeda)
Araştırmacılar çalışma raporlarında "Deneysel sınırlamalar ara konformasyonları çözmemize izin vermese de" diye açıklıyor. "Gerçekleştirilen modelleme, HS-AFM altında gözlemlenen küresel ve oval HECT alanı şekilleri arasındaki geçişlerin, C-lobunun N-lobuna göre döndüğü fonksiyonel konformasyonel hareketlere karşılık geldiğine ve böylece katalitik ve L-şekli arasında değişime izin verdiğine dair kanıt sağlar. HECT konformasyonları.”
Menteşede daha az esnekliğe sahip mutant HECT alanlarıyla yapılan daha sonraki deneyler, konformasyonlar arasında herhangi bir geçiş olmadığını ortaya çıkardı; mutant HECT alanları, katalitik konformasyonda kilitlendi. Ayrıca, bu mutant HECT alanlarının, vahşi tipten daha verimli bir şekilde bir araya getirilen iki ubikuitin proteini oluşturabildiğini de buldular.
Bu çalışmadaki HECT tipi E6 olan E3AP, insan papilloma virüsünden (HPV) türetilen E6 proteini ile etkileşime girer ve bir tümör baskılayıcı protein olan p53'ü her yerde çoğaltır. Ayrıca p53'ün E6AP ve E6 tarafından her yerde bulunmasının rahim ağzı kanserinin önemli bir nedeni olduğu bilinmektedir. Bununla birlikte, E53AP ve E6 proteinlerinin etkileşimi yoluyla p6'ün çoğalmasının mekanizması belirsizliğini koruyor. Gelecekte, E6AP/E6'nın ve HS-AFM'li E6AP/E6/p53 kompleksinin yapısal dinamiklerini açıklayacağız ve E6'nın, E53AP tarafından p6'ün her yerde çoğaltılması aktivitesini nasıl arttırdığını açıklığa kavuşturacağız.
Şekil 2: E6AP'nin HECT alanının yapısal dinamiklerinin yüksek hızlı AFM gözlemi ve simülasyonu. (A) HECT alanının HS-AFM görüntüsü. Küresel (beyaz noktalı çizgi) ve oval (mavi noktalı çizgi) konformasyonel durumlar gözlendi. (B) HECT alanının yapısal durumunun ve sahte AFM görüntüsünün simüle edilmiş geçiş süreci. (C) Ubiquitin (Ub), E2'den E3'e (HECT alanı) aktarılır. Ubikuitin içeren E2'nin (E2-Ub) eklenmesinden sonra, E2-Ub (beyaz ok) HECT alanına bağlanır ve E2 ayrıştıktan sonra, ubikuitin gibi görünen küçük bir parçacık (mavi ok) HECT alanına eklenir. . (© 2023 Takeda)
Araştırmacılar çalışma raporlarında "Deneysel sınırlamalar ara konformasyonları çözmemize izin vermese de" diye açıklıyor. "Gerçekleştirilen modelleme, HS-AFM altında gözlemlenen küresel ve oval HECT alanı şekilleri arasındaki geçişlerin, C-lobunun N-lobuna göre döndüğü fonksiyonel konformasyonel hareketlere karşılık geldiğine ve böylece katalitik ve L-şekli arasında değişime izin verdiğine dair kanıt sağlar. HECT konformasyonları.”
Menteşede daha az esnekliğe sahip mutant HECT alanlarıyla yapılan daha sonraki deneyler, konformasyonlar arasında herhangi bir geçiş olmadığını ortaya çıkardı; mutant HECT alanları, katalitik konformasyonda kilitlendi. Ayrıca, bu mutant HECT alanlarının, vahşi tipten daha verimli bir şekilde bir araya getirilen iki ubikuitin proteini oluşturabildiğini de buldular.
Bu çalışmadaki HECT tipi E6 olan E3AP, insan papilloma virüsünden (HPV) türetilen E6 proteini ile etkileşime girer ve bir tümör baskılayıcı protein olan p53'ü her yerde çoğaltır. Ayrıca p53'ün E6AP ve E6 tarafından her yerde bulunmasının rahim ağzı kanserinin önemli bir nedeni olduğu bilinmektedir. Bununla birlikte, E53AP ve E6 proteinlerinin etkileşimi yoluyla p6'ün çoğalmasının mekanizması belirsizliğini koruyor. Gelecekte, E6AP/E6'nın ve HS-AFM'li E6AP/E6/p53 kompleksinin yapısal dinamiklerini açıklayacağız ve E6'nın, E53AP tarafından p6'ün her yerde çoğaltılması aktivitesini nasıl arttırdığını açıklığa kavuşturacağız.
HECT alanı, esnek bölge boyunca küresel ve eliptik konformasyonları tekrarlar. Bilgisayar simülasyon sonuçları, küresel şeklin katalitik yapıya, oval şeklin ise L şeklindeki yapıya karşılık geldiğini göstermektedir. Ubikitin dimerinin (Ub2) oluşum verimliliği, esnek menteşe bölgesinin konformasyonel durumuna bağlı olarak önemli ölçüde değişir. Ubikitinasyon (ubikuitin proteininin eklenmesi) protein bozulması, DNA onarımı ve sinyal iletimi gibi birçok hücre sürecinde önemli bir aşamadır. WPI-NanoLSI, Kanazawa Üniversitesi'nden Hiroki Konno ve Holger Flechsig liderliğindeki araştırmacılar, yüksek hızlı atomik kuvvet mikroskobu (HS-AFM) ve moleküler modellemeyi kullanarak, her yerde bulunmayla ilgili bir enzim menteşesinin hareketliliğinin, her yerde bulunmanın gerçekleşmesine nasıl izin verdiğini belirlediler. Önceki çalışmalar, ubikuitini aktive eden bir enzim (E1), onu konjuge eden bir enzim (E2) ve ubikuitin proteininin hedef proteine bağlanmasını (yani bir ligaz, E3) katalize eden bir enzim dahil olmak üzere, ubikuitinasyonu kolaylaştıran bir dizi enzim tanımlamıştır. Şekil 1).
 Şekil 1: Ubikitinasyon ve proteinin ubikuitin-proteazom sistemi tarafından bozunması. (© 2023 Takeda)
HECT tipi E3 ligaz, E2 bağlama bölgesine sahip bir N lobu ve katalitik Cys kalıntısına sahip bir C lobu içeren bir HECT alanı ile karakterize edilir. Esnek bir menteşe iki lobu birbirine bağlar ve bu da her yerde bulunmanın şu şekilde kolaylaştırıldığı hipotezine yol açar: proteinin bu menteşe etrafında yeniden düzenlenmesi. Konno ve işbirlikçileri, durumun böyle olduğuna dair kanıt bulmak için yüksek hızlı atomik kuvvet mikroskobunu kullandılar.
Araştırmacılar, HECT alanı bir tür E2 enzimi ile kristalleştirildiğinde, HECT alanının katalitik Cys kalıntısı ile E2 enziminin katalitik Cys'si arasındaki mesafenin 41 Å olacak şekilde bir L şekli oluşturduğunu belirtti. ubikuitin transferi. Bununla birlikte, katalitik konformasyonunda HECT alanı, iki katalitik Cys kalıntısı arasındaki mesafenin çok daha yakın olduğu (sadece 8 Å) farklı bir şekle sahiptir, dolayısıyla bunun bir "katalitik konformasyon" olduğu düşünülmektedir.
E6AP'nin vahşi tip HECT alanının HS-AFM görüntülerinin analizi, biri küresel, diğeri oval görünen iki konformasyonu ortaya çıkardı (Şekil 2). AFM simülasyonları kullanarak oval şekilleri L konformasyonuna bağladılar ve küresel şekiller ya katalitik konformasyon ya da Cys kalıntıları arasındaki mesafenin 16 Å olduğu başka bir HECT alanı tipinde gözlemlenen ters T konformasyonu olarak adlandırıldı ( İncir. 2). Görüntülemenin uzay-zamansal çözünürlük sınırlamalarının üstesinden gelmek için deneyler, HECT alanı konformasyonel hareketlerini atomistik seviyede görselleştirmek üzere moleküler modelleme ile tamamlandı. Simülasyon AFM, küreselden oval şekilli topoğrafyaya geçişi açıkça gösteren, karşılık gelen bir sahte AFM filmi oluşturmak için kullanıldı (Şekil 2).
Şekil 1: Ubikitinasyon ve proteinin ubikuitin-proteazom sistemi tarafından bozunması. (© 2023 Takeda)
HECT tipi E3 ligaz, E2 bağlama bölgesine sahip bir N lobu ve katalitik Cys kalıntısına sahip bir C lobu içeren bir HECT alanı ile karakterize edilir. Esnek bir menteşe iki lobu birbirine bağlar ve bu da her yerde bulunmanın şu şekilde kolaylaştırıldığı hipotezine yol açar: proteinin bu menteşe etrafında yeniden düzenlenmesi. Konno ve işbirlikçileri, durumun böyle olduğuna dair kanıt bulmak için yüksek hızlı atomik kuvvet mikroskobunu kullandılar.
Araştırmacılar, HECT alanı bir tür E2 enzimi ile kristalleştirildiğinde, HECT alanının katalitik Cys kalıntısı ile E2 enziminin katalitik Cys'si arasındaki mesafenin 41 Å olacak şekilde bir L şekli oluşturduğunu belirtti. ubikuitin transferi. Bununla birlikte, katalitik konformasyonunda HECT alanı, iki katalitik Cys kalıntısı arasındaki mesafenin çok daha yakın olduğu (sadece 8 Å) farklı bir şekle sahiptir, dolayısıyla bunun bir "katalitik konformasyon" olduğu düşünülmektedir.
E6AP'nin vahşi tip HECT alanının HS-AFM görüntülerinin analizi, biri küresel, diğeri oval görünen iki konformasyonu ortaya çıkardı (Şekil 2). AFM simülasyonları kullanarak oval şekilleri L konformasyonuna bağladılar ve küresel şekiller ya katalitik konformasyon ya da Cys kalıntıları arasındaki mesafenin 16 Å olduğu başka bir HECT alanı tipinde gözlemlenen ters T konformasyonu olarak adlandırıldı ( İncir. 2). Görüntülemenin uzay-zamansal çözünürlük sınırlamalarının üstesinden gelmek için deneyler, HECT alanı konformasyonel hareketlerini atomistik seviyede görselleştirmek üzere moleküler modelleme ile tamamlandı. Simülasyon AFM, küreselden oval şekilli topoğrafyaya geçişi açıkça gösteren, karşılık gelen bir sahte AFM filmi oluşturmak için kullanıldı (Şekil 2).
 Şekil 2: E6AP'nin HECT alanının yapısal dinamiklerinin yüksek hızlı AFM gözlemi ve simülasyonu. (A) HECT alanının HS-AFM görüntüsü. Küresel (beyaz noktalı çizgi) ve oval (mavi noktalı çizgi) konformasyonel durumlar gözlendi. (B) HECT alanının yapısal durumunun ve sahte AFM görüntüsünün simüle edilmiş geçiş süreci. (C) Ubiquitin (Ub), E2'den E3'e (HECT alanı) aktarılır. Ubikuitin içeren E2'nin (E2-Ub) eklenmesinden sonra, E2-Ub (beyaz ok) HECT alanına bağlanır ve E2 ayrıştıktan sonra, ubikuitin gibi görünen küçük bir parçacık (mavi ok) HECT alanına eklenir. . (© 2023 Takeda)
Araştırmacılar çalışma raporlarında "Deneysel sınırlamalar ara konformasyonları çözmemize izin vermese de" diye açıklıyor. "Gerçekleştirilen modelleme, HS-AFM altında gözlemlenen küresel ve oval HECT alanı şekilleri arasındaki geçişlerin, C-lobunun N-lobuna göre döndüğü fonksiyonel konformasyonel hareketlere karşılık geldiğine ve böylece katalitik ve L-şekli arasında değişime izin verdiğine dair kanıt sağlar. HECT konformasyonları.”
Menteşede daha az esnekliğe sahip mutant HECT alanlarıyla yapılan daha sonraki deneyler, konformasyonlar arasında herhangi bir geçiş olmadığını ortaya çıkardı; mutant HECT alanları, katalitik konformasyonda kilitlendi. Ayrıca, bu mutant HECT alanlarının, vahşi tipten daha verimli bir şekilde bir araya getirilen iki ubikuitin proteini oluşturabildiğini de buldular.
Bu çalışmadaki HECT tipi E6 olan E3AP, insan papilloma virüsünden (HPV) türetilen E6 proteini ile etkileşime girer ve bir tümör baskılayıcı protein olan p53'ü her yerde çoğaltır. Ayrıca p53'ün E6AP ve E6 tarafından her yerde bulunmasının rahim ağzı kanserinin önemli bir nedeni olduğu bilinmektedir. Bununla birlikte, E53AP ve E6 proteinlerinin etkileşimi yoluyla p6'ün çoğalmasının mekanizması belirsizliğini koruyor. Gelecekte, E6AP/E6'nın ve HS-AFM'li E6AP/E6/p53 kompleksinin yapısal dinamiklerini açıklayacağız ve E6'nın, E53AP tarafından p6'ün her yerde çoğaltılması aktivitesini nasıl arttırdığını açıklığa kavuşturacağız.
Şekil 2: E6AP'nin HECT alanının yapısal dinamiklerinin yüksek hızlı AFM gözlemi ve simülasyonu. (A) HECT alanının HS-AFM görüntüsü. Küresel (beyaz noktalı çizgi) ve oval (mavi noktalı çizgi) konformasyonel durumlar gözlendi. (B) HECT alanının yapısal durumunun ve sahte AFM görüntüsünün simüle edilmiş geçiş süreci. (C) Ubiquitin (Ub), E2'den E3'e (HECT alanı) aktarılır. Ubikuitin içeren E2'nin (E2-Ub) eklenmesinden sonra, E2-Ub (beyaz ok) HECT alanına bağlanır ve E2 ayrıştıktan sonra, ubikuitin gibi görünen küçük bir parçacık (mavi ok) HECT alanına eklenir. . (© 2023 Takeda)
Araştırmacılar çalışma raporlarında "Deneysel sınırlamalar ara konformasyonları çözmemize izin vermese de" diye açıklıyor. "Gerçekleştirilen modelleme, HS-AFM altında gözlemlenen küresel ve oval HECT alanı şekilleri arasındaki geçişlerin, C-lobunun N-lobuna göre döndüğü fonksiyonel konformasyonel hareketlere karşılık geldiğine ve böylece katalitik ve L-şekli arasında değişime izin verdiğine dair kanıt sağlar. HECT konformasyonları.”
Menteşede daha az esnekliğe sahip mutant HECT alanlarıyla yapılan daha sonraki deneyler, konformasyonlar arasında herhangi bir geçiş olmadığını ortaya çıkardı; mutant HECT alanları, katalitik konformasyonda kilitlendi. Ayrıca, bu mutant HECT alanlarının, vahşi tipten daha verimli bir şekilde bir araya getirilen iki ubikuitin proteini oluşturabildiğini de buldular.
Bu çalışmadaki HECT tipi E6 olan E3AP, insan papilloma virüsünden (HPV) türetilen E6 proteini ile etkileşime girer ve bir tümör baskılayıcı protein olan p53'ü her yerde çoğaltır. Ayrıca p53'ün E6AP ve E6 tarafından her yerde bulunmasının rahim ağzı kanserinin önemli bir nedeni olduğu bilinmektedir. Bununla birlikte, E53AP ve E6 proteinlerinin etkileşimi yoluyla p6'ün çoğalmasının mekanizması belirsizliğini koruyor. Gelecekte, E6AP/E6'nın ve HS-AFM'li E6AP/E6/p53 kompleksinin yapısal dinamiklerini açıklayacağız ve E6'nın, E53AP tarafından p6'ün her yerde çoğaltılması aktivitesini nasıl arttırdığını açıklığa kavuşturacağız.
- SEO Destekli İçerik ve Halkla İlişkiler Dağıtımı. Bugün Gücünüzü Artırın.
- PlatoData.Network Dikey Üretken Yapay Zeka. Kendine güç ver. Buradan Erişin.
- PlatoAiStream. Web3 Zekası. Bilgi Genişletildi. Buradan Erişin.
- PlatoESG. karbon, temiz teknoloji, Enerji, Çevre, Güneş, Atık Yönetimi. Buradan Erişin.
- PlatoSağlık. Biyoteknoloji ve Klinik Araştırmalar Zekası. Buradan Erişin.
- Kaynak: https://www.nanowerk.com/news2/biotech/newsid=64429.php



