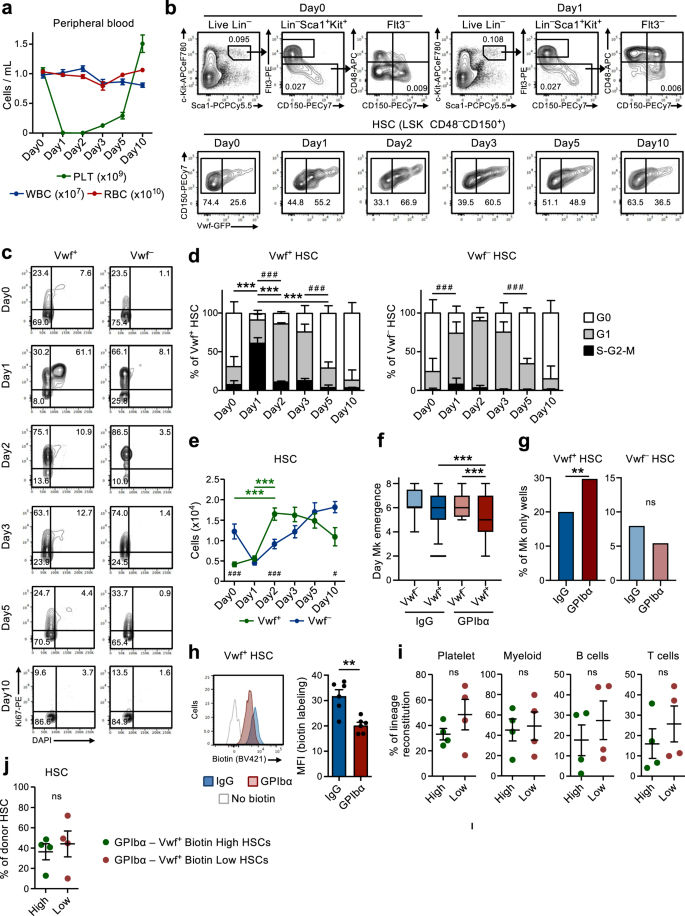
Akut trombosit tükenmesi, hareketsiz HSC'leri hızla çoğalmaya yönlendirir
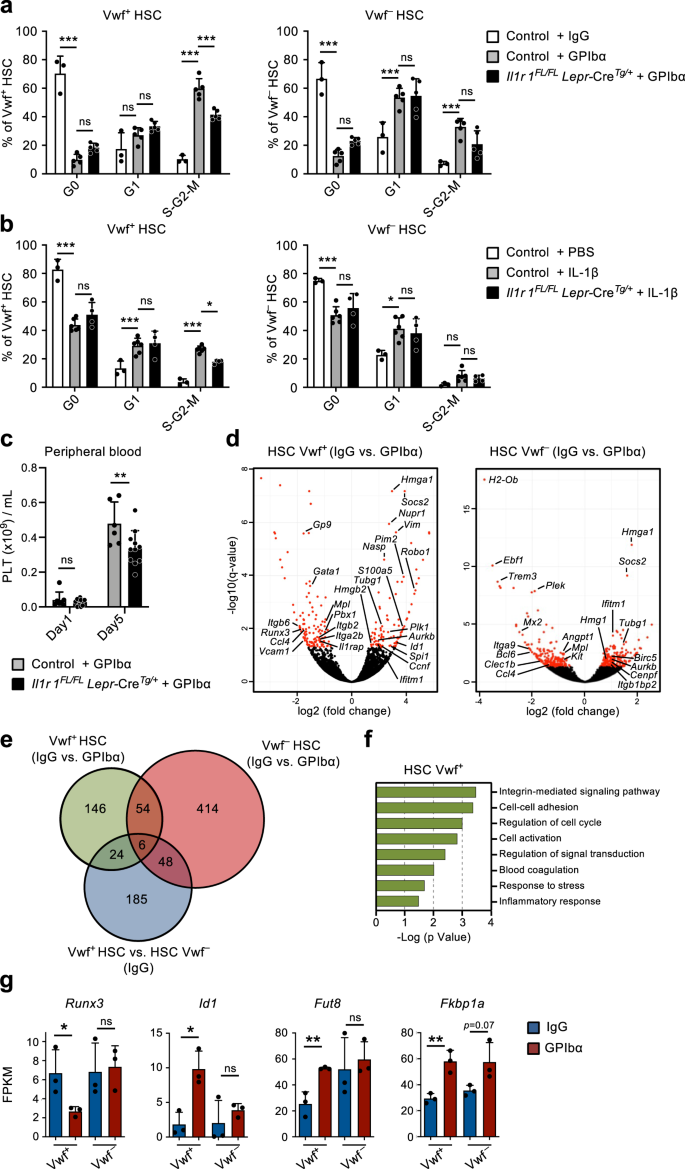
Önceki çalışmaları doğrultusunda9, tek doz anti-GPIba antikorunun uygulanması Vwf-GFP fareleri, immün trombositopeni purpuralı (ITP) hastalarda gözlenen trombositopeniyi taklit etmek için, diğer kan hücresi soylarını önemli ölçüde etkilemeden 1 gün içinde hızlı ve etkili bir şekilde trombositleri tüketti (Şekil XNUMX). 1a). Buna Lin'in hızlı (1 gün içinde) hücre döngüsü aktivasyonu eşlik etti.-Ölçek1+c-Kit+ (LSK) Flt3-CD48-CD150+ HSC'ler. Aktif hücre döngüsüne alım tercihen Vwf-GFP+ (Vwf+) HSC bölmesi (Şek. 1b-d), trombosit taraflı HSC'lerde zenginleştirilmiştir, ancak ağırlıklı olarak çok soylu yeniden oluşturulan HSC'leri içerir9,18. Vwf'nin %60'ından fazlası+ LSKFlt3-CD48-CD150+ HSC'ler hücre döngüsünün S-G2-M fazına girdiler; Vwf-GFP- (Vwf-) HSC'ler S-G2-M'ye girdi. Bununla birlikte çoğu Vwf- HSC'ler hareketsiz bir durumdan (G0) daha aktif bir G1 aşamasına geçti (Şekil XNUMX). 1c, d).
(Ek Şek. 1 ve 2). a Anti-GPIba antikorunun uygulanmasından sonra periferik kan hücresi parametrelerinin kinetik analizi. 0. gün fareleri, IgG izotip kontrol antikoru ile tedavi edildi. Veriler, 10 bağımsız deneyden elde edilen 0 (Gün13), 1 (Gün10), 2 (Gün9), 3 (Gün8), 5 (Gün7) ve 10 (Gün14) farenin ortalama ± SEM'sini temsil eder. PLT trombositleri, WBC beyaz kan hücreleri, RBC kırmızı kan hücreleri. b Temsilci FACS profilleri ve geçiş stratejisi Vwf-GFP+ (Vwf+) Ve Vwf-GFP- (Vwf-) LSKFlt3-CD150+CD48- Trombosit tükenmesinden sonra belirtilen zaman noktalarında HSC'ler. Kapılardaki/çeyreklerdeki sayılar, toplam canlı hücreler (üst paneller) veya HSC'ler (alt paneller) arasındaki kapılı hücre popülasyonunun sıklığını (analiz edilen tüm farelerin ortalaması) gösterir. c, d Vwf'nin hücre döngüsü analizi+ ve Vwf- LSKFlt3-CD150+CD48- Belirtilen zaman noktalarındaki HSC'ler trombosit tükenmesinden sonra. c Vwf'nin temsili hücre döngüsü FACS profilleri+ (solda) ve Vwf- (sağ) G0'daki (DAPI) HSC'ler-Ki67-) G1 (DAPI-Ki67+) veya S-G2-M (DAPI+Ki67+) hücre döngüsünün aşamaları. Kapılardaki sayılar, toplam HSC'lerin frekanslarını (analiz edilen tüm farelerin ortalaması) temsil eder. d Vwf'nin ortalama ± SD hücre döngüsü faz dağılımı+ (solda) ve Vwf- (sağda) HSC'ler. 5 bağımsız deneyden elde edilen 0 (Gün5), 1 (Gün3), 2 (Gün5), 3 (Gün5), 5 (Gün4) ve 10 (Gün6) fareden elde edilen veriler. ***p <0.001; **p S-G0.01-M hücre döngüsü fraksiyonu için < 2; # # #p G0.001 hücre döngüsü fraksiyonu için < 1 (her ikisi de Tukey'in çoklu karşılaştırmalarıyla 2 yönlü ANOVA kullanılarak); e Mutlak Vwf sayıları+ ve Vwf- HSC'ler (2 ayak başına, yöntemlere bakın). 8 bağımsız deneyden elde edilen 0 (Gün8), 1 (Gün7), 2 (Gün5), 3 (Gün6), 5 (Gün5) ve 10 (Gün9) farenin ortalama ± SEM verileri. ***p Vwf için < 0.001+ HSC (Tukey'in çoklu karşılaştırmalarıyla 2 yönlü ANOVA); #p < 0.05 ve ###p Vwf karşılaştırması için < 0.001+ Vwf'ye karşı- HSC'ler (Sidak'ın çoklu karşılaştırmalarıyla 2 yönlü ANOVA). İlk Mk'nin ortaya çıkma zamanı (f) ve yalnızca Mk hücreli kolonilerin sıklığı (g) kültürlenmiş tek Vwf'de-veya Vwf+ IgG veya GPIbα tedavisinden 16 saat sonra farelerden izole edilen HSC'ler. 138, 364, 147 ve 451 tek hücreden türetilmiş koloniden elde edilen veriler, 5 bağımsız deneyde 4 biyolojik kopyadan sırasıyla analiz edildi. f Orta çizgi medyanı, kutu sınırları 25-75 yüzdelik dilimleri, bıyıklar ise 5-95 yüzdelik dilimleri temsil eder. 5-95 yüzdelik dilimin dışındaki hücreler aykırı değerler olarak işaretlenir. P Dunn'ın çoklu karşılaştırmaları ile Kruskal-Wallis testi ile hesaplanan değerler. g P değeri iki taraflı Fisher kesin testiyle hesaplanmıştır. ***p <0.001; **p < 0.01; *p < 0.05; ns, anlamlı değil (p > 0.05). h Biyotin çoğalma analizi Vwf-GFP+ HSC'ler IgG veya GPIbα tedavisinden 2 gün sonra. 6 bağımsız deneyde grup başına 3 fareden alınan temsili grafik (solda) ve ortalama ± SD MFI (biyotin etiketleme kontrolü olmayan MFI için normalize edilmiştir; sağda). **p < 0.01; iki taraflı t testi ile hesaplanmıştır. Kandaki trombosit, miyeloid ve lenfoid hücre soylarının uzun süreli (16 hafta) yeniden yapılandırılması (i) ve BM HSC bölmesinin (j) biyotin yüksek ve biyotin düşük Vwf-GFP+ HSC fraksiyonları trombosit tükenmesinden 2 gün sonra. Fare başına 50 hücre nakledildi. Veriler, 4 bağımsız deneydeki 2 donörün ortalama ± SEM'sini temsil eder. Her nokta, donör başına nakledilen 2 alıcı farenin ortalamasını temsil eder. ns, anlamlı değil (p > 0.05); iki taraflı t testleri ile hesaplanmıştır. Ayrıca bkz. Ek Şekiller. 1 ve 2.
Daha sonra trombosit tükenmesinden sonra gözlemlenen HSC aktivasyonunun mekanik temelini daha fazla araştırmaya çalıştık. Anti-GPIba antikoru, trombin ve VWF reseptörü olan GPIba'ya (CD42b) bağlanır19Fc reseptöründen bağımsız bir şekilde trombosit aktivasyonuna, desialilasyona ve ardından temizlenmeye yol açar20. GPIbα, MkP'ler de dahil olmak üzere megakaryositik (Mk)-trombosit soyunda spesifik olarak ifade edilir, ancak bizim çalışmalarımız için ve daha önce başkaları tarafından bildirildiği gibi önemlidir.21, GPIbα ifadesi HSC'lerde neredeyse tespit edilemez (Ek Şekil 1). 1a). İlk trombosit tükenmesinin ardından, trombosit sayıları yavaşça düzeldi ve normal trombosit sayıları, tükenmeden sonraki 5. ve 10. günler arasında yeniden belirlendi (Şekil XNUMX). 1a). Dikkat çekici bir şekilde, bu trombosit azalması Vwf sayısında 4 kat artışa yol açtı.+ LSKFlt3-CD48-CD150+ HSC'ler 2 gün, Vwf ise- HSC'ler, ilk azalmanın ardından daha yavaş kinetiklerle arttı (Şekil 1). 1e). Daha sonra Vwf+/Vwf- HSC oranı ve mutlak sayılar, trombosit sayımlarının normalleşmesiyle eş zamanlı olarak yavaş yavaş normale döndü (Şekil 1). 1a, e). Vwf'deki artış+ HSC'lere ayrıca LSK Flt3 sayılarında seçici bir artış da eşlik etti-CD48+CD150+ MPP'lerin alt kümesi (Şek. 1b ve Ek Şekil. 1b) Mk taraflı olduğu gösterilmiştir22. Ayrıca MKP'ler23 Vwf'deki artıştan birkaç gün sonra da önemli ölçüde arttı+ HSC'ler, eritroid (CFU-E Öncesi) ve miyeloid (GMP) progenitörleri önemli ölçüde etkilenmezken (Ek Şekil 1). 1c, d). Güçlü GPIbα ifadelerine rağmen ve antikorun trombosit tükenmesine yol açtığı Fc'den bağımsız mekanizmayla uyumlu olmasına rağmen dikkat çekicidir.20MkP'ler başlangıçta hafifçe (önemli ölçüde olmasa da) azalırken Mks, BM'de antikor uygulamasıyla tükenmedi (Ek Şekil 1). 1d-g). Hızlı ilk aktivasyonun ardından HSC'ler, trombosit tükenmesinden 5 gün sonra zaten gözlemlenen normalleştirilmiş bir hücre döngüsü faz dağılımı ile hızlı bir şekilde sessizliğe geri döndü (Şekil XNUMX). 1c, d). Alternatif bir monoklonal antikor (NIT E)20 tükenmiş trombositler ve aktive edilmiş Vwf+ ve Vwf- HSC hücre döngüsü, anti-GPIba antikoruna benzer şekilde (Ek Şekil 1). 2a, b). GPIbα antikor tedavisine, artan Vwf sayısıyla birlikte hafif ve geçici bir splenomegali eşlik etti+ ama Vwf değil- Dalaktaki HSC'ler (Ek Şekil 1). 2c, d).
Hareketsiz LSKFlt3'ün işe alımı-CD48-CD150+ Akut trombosit aktivasyonu ve tükenmesi üzerine BM hücrelerinin çoğalması, Mk ve trombosit homeostazisini yeniden kurmak için hareketsiz HSC'lerin görevlendirildiği bir geri bildirim mekanizmasının varlığını ima eder. Trombositleri tükenmiş farelerden alınan HSC'lerin Mks üretmede daha etkili olup olmadığını araştırmak için tek hücreli Mk/GM in vitro farklılaşma tahlili kullandık. Tek Vwf'nin klonojenliği+ veya Vwf- LSKFlt3-CD48-CD150+ Homeostazda (IgG) veya trombosit tükenmesinden sonra (GPIbα) farelerden izole edilen HSC'ler benzerdi (~% 80; Ek Şekil XNUMX). 2e). Ancak tek Vwf+ Trombositleri tükenmiş farelerden izole edilen HSC'ler, Vwf'den daha hızlı Mks'ye farklılaştı- Trombositleri tükenmiş farelerden veya Vwf'den alınan HSC'ler+ Homeostazdaki farelerden izole edilen HSC'ler (Şekil 1). 1f) ve ayrıca yalnızca Mks'den oluşan daha fazla sayıda koloni oluşturdu (Şekil 1). 1g ve Ek Şekil. 2f, g). Fenotipik olarak HSC'lere benzeyen kök benzeri Mk'ye bağlı progenitörlerin, poli(I:C) kaynaklı trombositopeniye yanıt olarak çoğaldığı daha önce gösterilmiştir.24. Bu nedenle, LSKFlt3'ün daha kesin olarak belirlenmesi için-CD48-CD150+ Anti-GPIba kaynaklı trombosit tükenmesine yanıt olarak çoğalmaya teşvik edilen BM hücreleri, gerçek uzun vadeli yeniden popülasyonlu HSC'leri içerir; doksisiklinle indüklenebilir (tet-ON) H2B-mCherry fareleri kullandık6,25. Bu sistemde, bir doksisiklin tedavisi darbesi, mCherry etiketli histonların, hücreler çoğaldığında yavru hücreler arasında eşit olarak bölünen nükleozomlara dahil edilmesiyle sonuçlanır. Hücre döngüsü analiziyle uyumlu olarak (Şekil 1). 1c, d), anti-GPIba'nın neden olduğu trombosit tükenmesi, 3 gün sonra mCherry etiketlemesinin artan seyreltilmesiyle kanıtlandığı gibi, HSC'lerin çoğalmasının artmasına neden oldu (Ek Şekil XNUMX). 2h). Daha da önemlisi, FACS mCherry'yi sıraladılo (proliferatif) LSKFlt3-CD48-CD150+ Trombosit tüketen farelerden ayrılan hücreler, in vivo uzun vadeli (LT; 16 hafta) çok soylu yeniden yapılandırma potansiyeline sahipti (Ek Şekil XNUMX). 2i), anti-GPIbα'nın neden olduğu trombosit tükenmesinin, güçlü LT-HSC'leri çoğalmaya dahil ettiğini gösterir. Vwf'yi daha doğrudan karşılaştırmak için+ Trombosit tükenmesinin ardından aktif hale gelen veya çoğalmayan bir durumda kalan HSC'ler, tüm BM hücrelerinin membran proteinlerini etkili bir şekilde etiketleyen N-hidroksilsülfosüksinimit biyotin türevinin (Biotin) enjeksiyonuna dayanan invaziv olmayan bir etiketleme yöntemi kullandık.26. Hücreler bölündüğünde, etiketli membran proteinleri kardeş hücreler arasında eşit olarak dağıtılır ve hücre bölünmesi geçmişinin in vivo analizine olanak tanır. H2B-mCherry modeline benzer şekilde trombosit tükenmesi, Vwf'nin biyotin etiketlemesinin azalmasına neden oldu+ HSC'ler (Şek. 1h) ve ayrıca Vwf'den- HSC'ler (Ek Şek. 2j). Vwf'nin hücre döngüsü ve proliferasyon analizlerinde gözlenen farklılıklar- HSC'ler potansiyel olarak daha önce açıklanan Vwf arasındaki hiyerarşik ilişkiyi yansıtabilir.+ ve Vwf- HSC'ler9. Böylece Vwf'nin çoğalması+ HSC'ler Vwf'ye farklılaşabilir- Biyotin etiket seyreltmesinin geçmişini taşıyan HCS. Daha da önemlisi, FACS Vwf'yi sıraladı+Biotinlo (proliferatif) LSKFlt3-CD48-CD150+ trombositleri tükenmiş farelerden ayrılan hücreler (Ek Şekil 1). 2 bin, ben) in vivo uzun vadeli (LT; 16 hafta) çok soylu yeniden yapılandırma potansiyeline sahipti (Şekil XNUMX). 1i), anti-GPIbα'nın neden olduğu trombosit tükenmesinin, güçlü LT-HSC'leri çoğalmaya dahil ettiğini gösterir. Trombositleri güçlü bir şekilde yenilerken, Vwf'de önemli bir trombosit yanlılığı gözlenmedi+ Proliferatif olmayan (Biotin) ile karşılaştırıldığında, trombosit tükenmesine tepki olarak çoğalan HSC'lerHi) Vwf+ HSC'ler (Şek. 1i). Ne olursa olsun, Vwf'nin her iki biyotin fraksiyonu da+ HSC'ler benzer LT-HSC sulandırmasını gösterdi (Şekil 1). 1j) ve genel olarak Vwf'yi oluşturmada eşit derecede verimliydi+ ve Vwf- HSC bölmeleri (Ek Şekil 1). 2m). Bu, işlevsel olarak tanımlanmış LT-HSC'lerin çoğalmaya dahil edilmesiyle ve Vwf'nin göreceli oranlarının+ ve Vwf- Homeostaz yeniden kurulduğunda HSC'ler büyük ölçüde normale döner (Şekil 1). 1b, e).
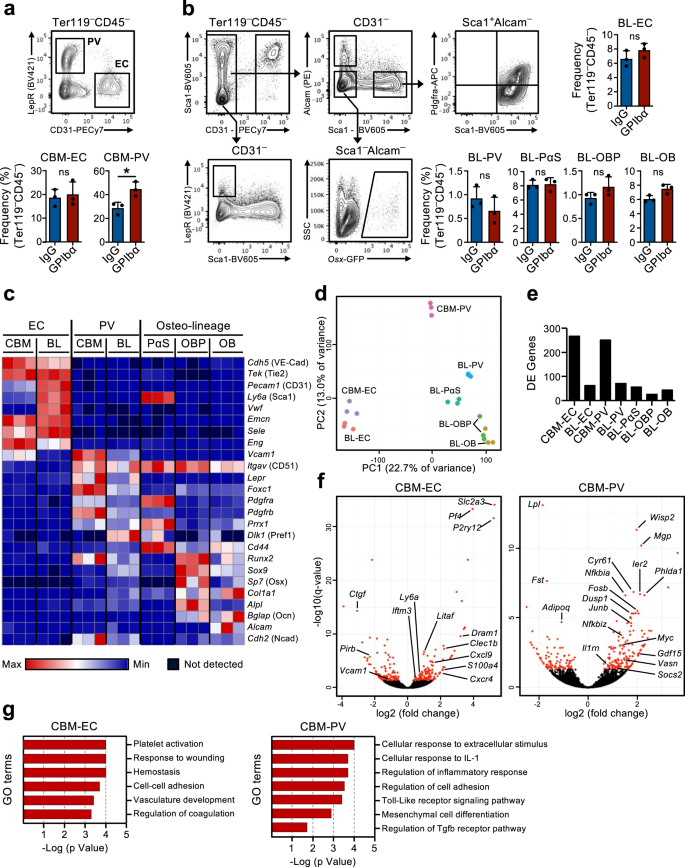
Akut trombosit tükenmesine yanıt olarak HSC nişinin transkripsiyonel yeniden programlanması
Trombosit tükenmesine yanıt olarak hareketsiz HSC'lerin çoğalmaya dahil edildiği bir geri bildirim mekanizmasının varlığı, BM'deki HSC'lerin trombosit üretimine olan talebi algılayabilmesi gerektiği anlamına gelir. Kemik iliğindeki stromal niş hücrelerin bu sürece dahil olabileceğini varsaydık. Aslında, trombosit tükenmesinden sonra BM nişinde meydana gelen değişiklikler daha önce öne sürülmüştü.16,17 ancak bu bağlamda HSC fonksiyonunun düzenlenmesinde spesifik niş hücrelerin katılımı doğrudan gösterilmemiştir. Bu nedenle, trombosit tükenmesine karşı HSC tepkisinde yer alan bu hücreler arasındaki olası moleküler etkileşimleri araştırmak için önceden karakterize edilmiş BM niş hücre popülasyonlarının yanı sıra HSC'lerin global RNA dizileme analizini kullandık. Bunun için tarif edilen iki hücreden hematopoietik olmayan hücreler izole edildi.27,28,29 BM'deki farklı anatomik bölgeler: merkezi BM (CBM) hücreleri ve kemik astarı (BL) hücreleri (Ek Şekil 1). 3a). CD45'in içinde-Ter119- Hem BL hem de CBM fraksiyonlarında hematopoietik olmayan hücreler, farklı niş hücre popülasyonları CD31 olarak tanımlanırHi endotel hücreleri (EC) ve CD31-Cüzam+ perivasküler hücreler (PV). BL fraksiyonunda ayrıca CD31'i tanımladık.-Alcam-Pdgfra+Ölçek1+ (PαS) mezenkimal progenitörlerin yanı sıra CD31-Alcam-Ölçek1-osx-GFP+ osteoblast progenitörleri (OBP) ve CD31-Alcam+Ölçek1- osteoblastlar (OB) (Şek. 2a, b). Homeostazda ve trombosit tükenmesinden 1 gün sonra farelerden izole edilen bu hücrelerin akış sitometrik analizi, CBM-PV hücrelerinde küçük ama anlamlı bir artışın yanı sıra hücresel bileşimde büyük değişiklikler ortaya çıkarmadı (Şekil XNUMX). 2a, b). RNA sıralama analizi, farklı endotel, mezenkimal ve HSC popülasyonlarının farklı kümelendiğini gösterdi (Ek Şekil 1). 3b). Farklı niş hücre popülasyonlarını tanımlayan bilinen belirteçlerin ifadesi (Şekil 1). 2c ve Ek Veriler 1) ve gen ekspresyonu düzenine göre kümelenmiş farklı hematopoietik düzenleyicilerin (Ek Şekil 1). 3c ve Ek Veriler 1), ayrıca farklı hücre kimliklerini doğruladı. Ek olarak, niş hücre popülasyonlarının temel bileşen analizi (PCA), endotelyal ve mezenkimal soy hücrelerinin ana bileşen (PC)1 ekseni boyunca ayrıldığını ve farklılaşma aşamasına bağlı olarak PC2 ekseni boyunca mezenkimal popülasyonların daha da ayrıldığını gösterdi (Şekil XNUMX). 2d). Homeostazdaki ve trombosit tükenmesinden 1 gün sonraki farelerden izole edilen niş hücreleri karşılaştıran diferansiyel gen ekspresyon analizi, CBM-EC (266 gen) ve CBM-PV (249 gen) hücrelerinde yüksek sayıda diferansiyel olarak eksprese edilmiş (DE) gen gösterdi (Şekil XNUMX). . 2e, f ve Ek Veriler 2, 3). Buna karşılık, karşılık gelen kemikle ilişkili BL-EC ve BL-PV dahil olmak üzere diğer niş popülasyonlarda çok daha az sayıda DE geni tespit edildi (Şekil 1). 2e, f, Ek Şekil. 3d, e ve Ek Veriler 2-4), trombositopeniye yanıtta tercihli bir CBM niş katılımını öne sürüyor. CBM-EC'den DE genleri üzerinde gerçekleştirilen gen ontolojisi (GO) analizi, trombosit aktivasyonu/pıhtılaşması ile ilişkili biyolojik süreçleri vurguladı (Pf4, Clec1b, P2ry12), strese tepki (Iftm3, Litaf, S100a4) ve hücre yapışması (Vcam1, Ctgf) (İncir. 2g ve Ek Veriler 5). CBM-PV DE genleri üzerindeki GO analizi, inflamasyonla ve özellikle pro-inflamatuar Interlökin-1'e (IL-1) verilen hücresel tepkiyle ilişkili biyolojik süreçleri ortaya çıkardı (Şekil XNUMX). 2g ve Ek Veriler 5). CBM-PV hücrelerinde vurgulanan diğer biyolojik süreçler, reseptörün aşağısındaki sinyal yollarının kısmen IL-4 sinyallemesi ile paylaşıldığı Toll benzeri reseptör (TLR)-1 sinyallemesi ve ayrıca mezenkimal farklılaşma ve TGFβ sinyallemesidir (XNUMX).Vasn, Fst, Wisp2, Cyr61) (İncir. 2f, g).
(Ek Şek. 3). Merkezi kemik iliğinde endotel ve stromal hücrelerin sınıflandırılmasına yönelik FACS analizi ve geçitleme stratejileri (CBM; a) ve kemik astarı (BL; b) trombosit tükenmesinden 1 gün sonra farelerin hücre bölmeleri (GPIba antikor tedavisi). Kontrol farelerine izotip (IgG) kontrol antikoru verildi. Çubuk diyagramlar, toplam hematopoietik olmayan CD45 arasında her hücre popülasyonunun ortalama ± SD frekanslarını (%) temsil eder-Ter119- hücreler. Veriler 3'teki grup başına 3 fareden alınmıştır (a) ve 2 (b) bağımsız deneyler. *p < 0.05; ns anlamlı değil (p > 0.05); iki taraflı t testi ile değerlendirildi. c-g Trombosit tükenmesinden 1 gün sonra farelerin endotel/stromal hücre bölümlerinin RNA dizilimi analizi. c Farklı niş hücre popülasyonlarını karakterize eden genlerin ifadesi (FPKM). d Araştırılan farklı hücre popülasyonlarının normalleştirilmiş gen ekspresyonunun temel bileşen analizi. e IgG ve GPIbα ile tedavi edilen fareler arasındaki diferansiyel olarak eksprese edilen (DE) genlerin sayısı (düzeltilmiş) p değer (q)<0.05), incelenen her niş hücre popülasyonunda. f Volkan arazileri ve g gen ontolojisi (GO), CBM endotel hücrelerinde (EC) ve Lepr'de farklı şekilde ifade edilen genlerin analizini ifade eder+ perivasküler (PV) hücreler. İçinde fkırmızı noktalar önemli ölçüde DE genlerini gösterir (q < 0.05. Tüm paneller için veriler, 3 bağımsız deneyden elde edilen 2 biyolojik kopyanın ortalama ± SD FPKM'sini temsil eder. OB osteoblastları, OBP osteoblast progenitörleri, PαS Pdfgra+Ölçek1+ mezenkimal progenitörler. Ayrıca bkz. Ek Şek. 3.
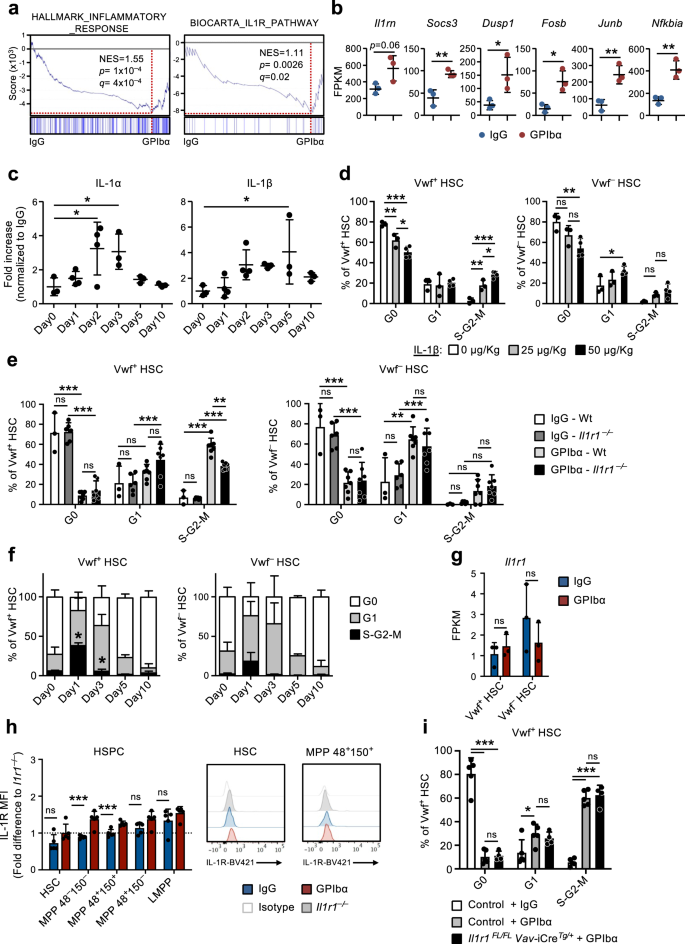
Hematopoietik olmayan hücrelerde IL-1 sinyali, trombosit tükenmesine karşı HSC tepkisi için kritik öneme sahiptir
Gen seti zenginleştirme analizi (GSEA), GPIba ile tedavi edilen farelerden izole edilen CBM-PV hücrelerinde gözlenen inflamatuar yanıt ve IL-1 reseptör sinyali ile bağlantılı genlerin zenginleşmesini doğruladı (Şekil XNUMX). 3a). Bu genler dahil Il1rn (IL-1 hedef geni ve IL-1 sinyal yolu antagonisti), Socs3 ve Dusp1 (IL-1 sinyal yolunun düzenleyicileri) ve FosB, Haziran ve Nfkbia (IL-1 sinyal zincirinin aşağısında aktive edilen yolların bileşenleri) (Şekil XNUMX). 3b). Bu süreçte steril enflamasyonun rolünü daha fazla araştırmak için GPIba ile tedavi edilen farelerin BM hücre dışı sıvısındaki farklı pro-inflamatuar sitokinlerin seviyelerini analiz ettik. Bu analiz, trombosit tükenmesi sonrası hem IL-1α hem de IL-1β seviyelerinin önemli ölçüde arttığını ortaya çıkardı (Şekil XNUMX). 3c), Vwf'nin genişlemesine ve ardından normalleşmesine paralel kinetiklerle+ HSC (Şek. 1e). Benzer bir başlangıç artışı TNFa için de görüldü, ancak bu Vwf'nin kullanılmaya başlandığı zamanın ötesinde de devam etti.+ HSC hücre döngüsü durumu normalleşti (Ek Şekil 2). 4a). Diğer inflamatuar sitokinler büyük ölçüde değişmedi (IL-6 ve IL-12) veya trombosit tükenmesi sonrası sonraki aşamalarda (INFγ) azaldı (Ek Şekil XNUMX). 4a). Kararlı durumda, IL-1'in esas olarak dolaşımdaki T hücreleri (IL-1α) ve granülositler (IL-1β) tarafından üretildiği gösterilmiştir.30. IL-1 ifadesini analiz eden veri kümelerimizde hem Il1a ve Il1b farklı niş hücre popülasyonlarında ve HSC'lerde çoğunlukla tespit edilemezdi (Ek Şekil 1). 4b), oysa birincil Mks (Ek Şekil 1). 4c, d) özellikle yüksek ifade gösterdi Il1a (Ek Şekil. 4b).
(Ek Şek. 5). a Belirtilen gen setleri için CBM-PV hücrelerinden alınan global gen ekspresyonu verilerinin gen seti zenginleştirme analizi (GSEA). NES, normalleştirilmiş zenginleştirme puanı (veya ölçekli puan). b Trombosit tükenmesinden 1 gün sonra CBM-PV hücrelerinde IL-1 sinyal yoluna bağlı genlerin ekspresyonu. Veriler, 3 bağımsız deneyden elde edilen 2 biyolojik kopyanın ortalama ± SD FPKM'sini temsil eder. **p < 0.01; *p < 0.05 (iki taraflı t testi). c Trombosit tükenmesinden (GPIba antikor tedavisi) sonra belirtilen zaman noktalarında farelerden izole edilen kemik iliği hücre dışı sıvısındaki IL-1α ve IL-1β'nin ortalama ± SD seviyeleri. Kontrol farelerine (Gün 0), izotip (IgG) kontrol antikoru verildi. Veriler, 3 bağımsız deneyden elde edilen 0 (Gün4), 1 (Gün4), 2 (Gün3), 3 (Gün3), 5 (Gün3) ve 10 (Gün4) fareden alınmıştır. *p < 0.05 (Dunnett'in çoklu karşılaştırmalarıyla 1 yönlü ANOVA). d Vwf'nin hücre döngüsü analizi+ (solda) ve Vwf- (sağda) Belirtilen miktarlarda IL-1β'nın intravenöz uygulanmasından 1 gün sonra farelerden alınan HSC'ler. Veriler, 3 bağımsız deneyde 0 veya 25 μg/Kg alan 4 farenin ve 50 μg/Kg IL-1β alan 2 farenin ortalama ± SD'sidir. Vwf'nin hücre döngüsü analizi+ (solda) ve Vwf- (sağda) Wt'den HSC'ler ve Il1r1- / - fareler 1 gün (e) veya HSC'ler için Il1r1- / - belirtilen zaman noktalarında fareler (f) trombosit tükenmesi sonrası. e 3 (IgG-Wt), 6 (IgG-)'den ortalama ± SD verileriIl1r1- / -) 7 (GPIbα -Wt) ve 7 (GPIbα –Il1r1- / -) 5 bağımsız deneyden elde edilen fareler. f 6 bağımsız deneyde 0 (Gün7), 1 (Gün3), 3 (Gün3), 5 (Gün3) ve 10 (Gün4) fareden alınan ortalama ± SD frekansları. *p < 0.05 (aynı Wt Vwf analiziyle karşılaştırıldığında)+ ve Vwf- Şekil 2'deki HSC'ler. 1d). g, h Il1r1/IL-1R ifade analizi (h) Vwf'de RNA dizilimi (FPKM) ile RNA seviyesinde+ ve Vwf- HSC'ler ve (i) homeostazdaki farelerden veya trombosit tükenmesinden 1 gün sonra izole edilen HSPC alt gruplarında akış sitometrisi ile protein seviyesinde. h Koşul başına 3 biyolojik kopyanın ortalama ± SD FPKM verileri. i Ortalama floresan yoğunluğunun (MFI) ortalama ± SD verileri, eşdeğer hücre popülasyonunun MFI'sine normalize edilmiştir. Il1r1- / - fareler aynı deneyde analiz edildi. Veriler, 5 bağımsız deneyde koşul başına 2 fareden alınmıştır. i Hücre döngüsü analizi Vwf-tdDomates+ Koşullu olarak silinen farelerden alınan HSC'ler Il1r1 tüm hematopoietik hücrelerde (Il1r1FL/FL Vav...KreTg/+) Trombosit tükenmesinden 1 gün sonra. Kontroller şunları içerir: Vwf-tdDomates+ HSC'ler Il1r1FL/+ Vav...KreTg/+, Il1r1+ / + Vav...KreTg/+ ve Vav-Cre+ / + fareler (IL-1R fonksiyon kaybı olmayan genotipleri temsil eder). Veriler 5 (kontrol-IgG), 5 (kontrol-GPIbα) ve 4'ün (kontrol-IgG) ortalama ± SD frekanslarını temsil ederIl1r1FL/FL Vav...KreTg/+3 bağımsız deneyden elde edilen -GPIbα) fareleri. ***p <0.001; **p < 0.01; *p < 0.05; ns anlamlı değil (p > 0.05); iki taraflı t testi kullanarak (b, g, h) veya Tukey'in çoklu karşılaştırmalarıyla 2 yönlü ANOVA (d-f, i). Ayrıca bkz. Ek Şek. 4.
Rekombinant IL-1'in farelere uygulanması, Vwf'nin hücre döngüsü aktivasyonuyla sonuçlandı+ ve Vwf- HSC'ler (Şek. 3d), Vwf ile+ HSC'ler, hücre döngüsünün S-G2-M fazına daha yüksek oranda alınır (Ek Şekil XNUMX). 4e), anti-GPIba kaynaklı trombositopeniye yanıt olarak HSC aktivasyonuna aracılık eden IL-1 ile uyumludur. Bu hipotezi daha spesifik olarak araştırmak için IL-1R eksikliği olan farelerde trombosit tükenmesini indükledik (Il1r1-/-), normal bir HSC bölmesine sahip olan30 ve normal trombosit sayıları. Daha da önemlisi, Il1r1-/- fareler aktif olarak döngü yapma sıklığında önemli bir azalma gösterdi (S-G2-M) Vwf+ Trombosit tükenmesinden sonra HSC'ler (Şekil 1). 3e, f), GPIbα ile tedavi edilen vahşi tip (Wt) farelerle karşılaştırıldığında. Gerçek şu ki Il1r1 eksiklik, GPIbα tedavisine yanıt olarak HSC'lerin hücre döngüsü aktivasyonunu tamamen ortadan kaldırmadı, diğer (IL-1'den bağımsız) mekanizmaların dahil olduğunu göstermektedir. Bununla uyumlu olarak daha önce trombosit tükenmesinden 1 gün sonra serumda THPO seviyelerinin arttığını göstermiştik.9. Trombosit tükenmesi sonrası HSC'lerin aktivasyonunda potansiyel olarak IL-1 ile sinerji oluşturan diğer sinyalleri tanımlamak için, bilinen HSC düzenleyicilerinin ifadesini analiz ettik. Tgfb1 ve Pf4, daha önce HSC sessizliğine karışmıştı31,32; Ve Fgf1, daha önce HSC proliferasyonu ile ilişkiliydi32. Farklı niş hücre popülasyonlarının RNA dizileme analizi, >20 kat yukarı regülasyonu ortaya çıkardı. Pf4 CBM-EC'de (Ek Şekil 1). 4f), ifadesinde herhangi bir değişiklik olmamasına rağmen Tgfb1 ve Fgf1 gözlemlendi. Bu düzenleyicilerin BM hücre dışı sıvısındaki trombosit tükenmesi sonrası protein seviyelerini de araştırdık. Gen ekspresyonu analizine uygun olarak, TGFβ1 ve FGF1 seviyeleri değişmedi, ancak PF4, GPIba aracılı trombosit tükenmesinden 1 gün sonra önemli ölçüde arttı (Ek Şekil XNUMX). 4g). PF4'ün HSC sessizliğini tetiklemede daha önce açıklanan rolü göz önüne alındığında31,33BM hücre dışı sıvısında gözlenen artan PF4 seviyelerinin, trombosit tükenmesi sonrası HSC çoğalmasının aktivasyonunu açıklaması pek mümkün değildir.
RNA dizilimi çok düşük seviyelerde (≈1 FPKM) ortaya çıkardı Il1r1 HSC'lerdeki transkriptler (Şekil 1). 3g). Akış sitometri analizi, HSC'lerde tespit edilemeyen seviyelerde IL-1R proteini ve birkaç MPP alt kümesinde düşük seviyeler gösterdi (Şekil XNUMX). 3h ve Ek Şekil. 5a). Saptanabilir IL-1R ekspresyonunun olmamasına ek olarak, CBM-PV'de yukarı regüle edilen IL-1 sinyallemeyle ilişkili genlerin hiçbirinin Vwf'de yukarı regüle edildiği bulunamadı.+ veya Vwf- GPIbα tedavisi sonrası HSC (Ek Şekil 1). 5b). Fenotipik olarak tanımlanmış HSC'lerde saptanabilir IL-1R ekspresyonunu gözlemlememiş olsak da, IL-1'in daha önce HSC'leri aktive ettiği öne sürülmüştü.30. Bu nedenle, IL-1'in, anti-GPIba kaynaklı trombositopeni sonrası HSC'lerin aktivasyonuna doğrudan aracılık edip edemeyeceğini araştırmak için, trombosit tükenmesini indükledik. Il1r1FL/FL Vav-iCreTg/+ silinmesini hedefleyen fareler Il1r1 HSC'ler dahil tüm hematopoietik hücrelere. Vwf'nin damlacık dijital PCR analizi+ ve Vwf- HSC'ler >%99 silme verimliliğini doğruladı Il1r1 her iki Vwf'de Vav-iCre tarafından alellerin floxed edilmesi+ ve Vwf- HSC alt kümeleri (Ek Şekil 1). 5c). Germline'da gözlemlediklerimizin aksine Il1r1-/- fareler (Şek. 3e, f), Il1r1FL/FL Vav-iCreTg/+ fareler, Vwf'nin eşit derecede etkili anti-GPIba kaynaklı hücre döngüsü aktivasyonunu gösterdi+ HSC, Wt farelerinde olduğu gibi (Şekil 1). 3i). Birlikte, bu sonuçlar, HSC'ler veya diğer hematopoietik hücreler yoluyla doğrudan IL-1R sinyalinin, trombosit tükenmesine yanıt olarak HSC'lerin farklı hücre döngüsü aktivasyonunda yer almadığını ve bunun yerine, bu süreçte hematopoietik olmayan IL-1 sinyallemesinin bir rolünü ima ettiğini gösterir.
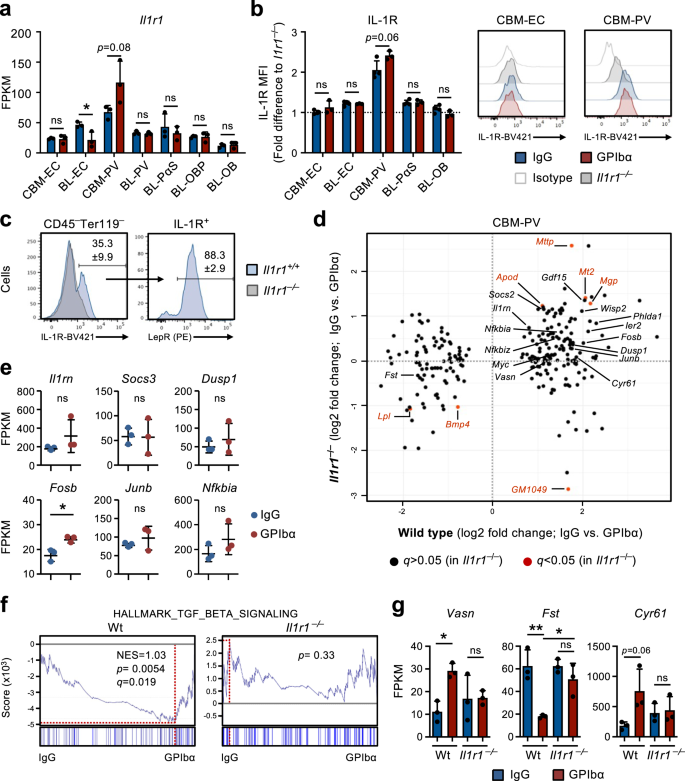
Trombosit tükenmesi, perivasküler hücrelerde IL-1 sinyallemesinin aktivasyonuna neden olur
Çalışmalarımız Il1r1FL/FLVav-iCreTg/+fareler ve BM niş hücrelerinin RNA dizileme analizi, HSC'ler veya diğer hematopoetik hücreler yerine niş hücrelerde IL-1 sinyalinin, trombosit tükenmesinden sonra HSC'lerin geri bildirim aktivasyonunda rol oynayabileceğini öne sürdü. Niş hücreler arasında CBM-PV hücreleri en yüksek transkripsiyonel seviyeleri gösterdi Il1r1'in ifade (Şek. 4a) ve ayrıca farklı IL-1R protein ekspresyonu gösterdi, oysa diğer tüm stromal/endotelyal hücre popülasyonları, saptanabilir IL-1R hücre yüzeyi ekspresyonu açısından neredeyse negatifti (Şekil XNUMX). 4b). Aslında CBM'deki neredeyse tüm IL-1R ifadeleri Lepr'e atanabilir.+ PV hücreleri (Şek. 4cgibi kritik HSC düzenleyicilerinin daha yüksek seviyelerini ifade eden Cxcl12 ve Kitlendosteal IL-1R ile karşılaştırıldığında–/Lo BL-PV hücreleri (Ek Şekil 1). 3c). Önemli olarak, CBM-PV hücrelerinde DE genlerinin Wt ve Il1r1-/- Homeostazdaki ve GPIbα tedavisinden sonra fareler, DE genlerinin çoğunluğunun, trombosit tükenmesinin ardından Wt farelerinde tanımlandığını ortaya çıkardı (Şekil 1). 2f ve 3b) trombosit tüketenlerden CBM-PV hücrelerinde farklı şekilde eksprese edilmedi Il1r1-/- fareler (Şek. 4dIL-1 sinyal yolunun aktivasyonuyla doğrudan ilişkili genler dahil (Şekil XNUMX). 4e). IL-1 sinyallemeyle ilgili genlere ek olarak, TGFβ sinyalleme yolu da dahil olmak üzere HSC çoğalmasının dışsal düzenlenmesinde rol oynayan IL-1R'ye bağımlı DE yolaklarına dair kanıtlar bulduk (Şekil XNUMX). 2g ve 4d, f, g)34. Bu, yukarı regülasyonu içeriyordu Vasn (Vasorin), TGFβ sinyalinin doğrudan inhibitörü35 daha önce HSC aktivasyonuna karışmıştı36. Diğer IL-1R'ye bağımlı DE genleri dahil İlk (Folistatin), BMP/Activin sinyallemesinin doğrudan inhibitörü37 ve daha önce hematopoietik progenitör hücrelerden Mk farklılaşmasını inhibe ettiği gösterilmiştir.38ve hücre yapışması ve integrin bağlanması/düzenlenmesiyle ilişkili genler (Şekil 1). 2f, g ve 4d-g).
a RNA dizileme analizi Il1r1 Homeostazdaki (IgG ile tedavi edilmiş) veya trombosit tükenmesinden 1 gün sonra (GPIbα ile tedavi edilmiş) farelerden izole edilen farklı niş hücrelerde gen ekspresyonu (FPKM). 3 bağımsız deneyden elde edilen 2 biyolojik kopyanın ortalama ± SD FPKM verileri. b, c Homeostazdaki farelerden veya trombosit tükenmesinden 1 gün sonra izole edilen farklı endotel/stromal hücre popülasyonlarında IL-1R ekspresyonunun akış sitometrik analizi. Ortalama floresan yoğunluğunun (MFI) ortalama ± SD verileri, eşdeğer hücre popülasyonunun MFI'sine normalize edilmiştir. Il1r1- / - aynı deneyde analiz edilen fareler (b). c Lepr Sıklığı+ Toplam IL-1R'deki PV hücreleri+ Homeostazdaki farelerden izole edilen hematopoietik olmayan CBM hücreleri. 4 bağımsız deneyde 3 (IgG) ve 2 (GPIbα) fareden elde edilen veriler. d İzole edilen CBM-PV hücrelerinin RNA dizileme analizi Il1r1+ / + ve Il1r1- / - CBM-PV-GPIbα tedavisine yanıt veren genlerin ekspresyonu için homeostazda ve trombosit tükenmesinden sonra fareler. Koşul başına 3 biyolojik kopyadan elde edilen veriler. e IL-1 sinyal yoluna bağlı genlerin izole edilen CBM-PV hücrelerinde ekspresyonu Il1r1- / - trombosit tükenmesinden 1 gün sonra fareler. Koşul başına 3 biyolojik kopyanın ortalama ± SD FPKM verileri. Belirtilen gen seti için global gen ekspresyon verilerinin GSEA'sı (f) ve belirtilen genlerin ekspresyonu (FPKM; Ortalama ± SD) (g), vahşi tipteki CBM-PV hücrelerinde ve Il1r1- / - homeostazda ve trombosit tükenmesinden sonra fareler. Koşul başına 3 fareden elde edilen veriler. NES, normalleştirilmiş zenginleştirme puanı (veya ölçekli puan). *p <0.05; **p < 0.01; ns, anlamlı değil (p > 0.05); iki taraflı t testi kullanarak (a, b, e) ve 2 yönlü ANOVA ile Tukey'a çoklu karşılaştırmalar (g).
Perivasküler hücrelerde IL-1 sinyali, Vwf'nin optimal aktivasyonu için kritik öneme sahiptir+ HSC
Vwf'nin aktivasyonunda CBM-PV hücrelerinde IL-1 sinyallemesinin rolünü daha doğrudan araştırmak için+ Trombositopeniye yanıt olarak HSC'leri kullanarak farelerde trombosit tükenmesini koşullu olarak sildik. Il1r1 özellikle Lepr'de+ PV hücreleri (Ek Şekil 1). 5d). Il1r1FL/FLCüzam-CreTg/+ fareler aktif olarak döngüde (S-G2-M) Vwf'de önemli bir azalma gösterdi+ HSC'ler, anti-GPIbα ile tedavi edilen kontrol fareleriyle karşılaştırıldığında (Şekil 1). 5a). Hücre döngüsü aktivasyonundaki azalma, silinmiş germ hattında gözlemlenenle karşılaştırılabilir düzeydeydi Il1r1-/- fareler (Şek. 3e, f), Lepr'i destekliyor+ CBM-PV hücreleri, Vwf'nin IL-1R'ye bağımlı aktivasyonunda rol oynayan ana hücrelerdir.+ Anti-GPIba kaynaklı trombositopeniye yanıt olarak HSC'ler. Bu bulguları doğrulayan rekombinant IL-1'in uygulanması Il1r1FL/FLCüzam-CreTg/+ fareler Vwf alımının azalmasına neden oldu+ HSC'leri aktif S-G2-M'ye dönüştürün (Şek. 5b). Ayrıca, özel olarak silinmesi Il1r1 Lepr'de+ PV hücreleri, trombosit tükenmesi sonrası trombosit iyileşmesinde küçük ama anlamlı bir gecikmeye neden oldu (Şekil 1). 5c).
(Ek Şek. 6). a-c Koşullu silinen farelerin analizi Il1r1 Lepr'de+ perivasküler hücreler (Il1r1FL/FL Lepr-KreTg/+) trombosit tükenmesinden sonra fareler. Kontroller şunları içerir: Il1r1FL/+ Lepr-KreTg/+, Il1r1+ / + Lepr-KreTg/+, Il1r1FL/FL Lepr-KreTg/+ (yalnızca IgG) ve Cüzam-Cre+ / + fareler. a Vwf'nin hücre döngüsü analizi+ ve VWF- HSC'ler trombosit tükenmesinden 1 gün sonra. Veriler 3 (kontrol-IgG), 5 (kontrol-GPIbα) ve 5'in (kontrol-IgG) ortalama ± SD frekanslarını temsil ederIl1r1FL/FL Lepr-KreTg/+3 bağımsız deneyden elde edilen -GPIbα) fareleri. b Vwf'nin hücre döngüsü analizi+ ve VWF- 1ug/Kg IL-50β'nın intravenöz uygulanmasından 1 gün sonra farelerden alınan HSC'ler. Veriler, 3 (kontrol-IgG), 6 (kontrol-GPIbα) ve 4'ün (kontrol-IgG) ortalama ± SD'sidir.Il1r1FL/FL Lepr-KreTg/+3 bağımsız deneyden elde edilen -GPIbα) fareleri. c Trombosit tükenmesinden sonra belirtilen zaman noktalarında trombosit iyileşmesinin periferik kan analizi. 6 (kontrol) ve 11'den (kontrol) ortalama ± SD trombosit sayılarıIl1r1FL/FL Lepr-KreTg/+) fareler 3 bağımsız deneyde. d-g Vwf'de diferansiyel gen ekspresyonu analizi+ ve Vwf- Trombosit tükenmesinden (GPIbα tedavisi) 1 gün sonra vahşi tip farelerden izole edilen HSC'ler. d Vwf'de farklı şekilde ifade edilen genlerin volkan grafikleri+ ve Vwf- HSC'ler. Kırmızı noktalar, önemli ifade farklılıklarına sahip genleri gösterir (düzeltilmiş p değer (q)<0.05). e Vwf'de diferansiyel olarak eksprese edilen genlerin sayısını gösteren Venn diyagramı+ ve Vwf- HSC'ler trombosit tükenmesinden sonra ve homeostazda (IgG) bu HSC alt kümeleri arasında bulunur. f Vwf'de yukarı regüle edilen biyolojik süreçlerin/yolların GO terimleri analizi+ Trombosit tükenmesinden sonra HSC'ler. g Vwf'de Aktivin/BMP sinyallemesiyle ilişkili genlerin ifadesi (FPKM)+ ve Vwf- Homeostazda ve trombosit tükenmesinden 1 gün sonra Wt farelerinden alınan HSC'ler. Bütün bilgiler (d-g) genotip ve durum başına 3 biyolojik kopyanın ortalama ± SD FPKM verilerini temsil eder. *p <0.05; **p <0.01; ***p < 0.001; ns anlamlı değil (p > 0.05); Tukey'in çoklu karşılaştırmalarıyla 2 yönlü ANOVA'nın kullanılması (a, b), Sidak'ın çoklu karşılaştırmalarıyla 2 yönlü ANOVA (c) ve iki taraflı t testi (g). Ayrıca bkz. Ek Şek. 5.
Vwf'nin nasıl kullanıldığına dair daha fazla bilgi edinmek için+ HSC'ler, anti-GPIba kaynaklı trombosit tükenmesine yanıt olarak çoğalmaya alınır, Vwf'nin RNA dizilimini gerçekleştirdik+ ve Vwf- HSC'ler. Vwf'nin RNA dizilimi+ HSC'ler, trombosit tükenmesinden sonra diferansiyel olarak eksprese edilen 230 gen tanımladı; bunlardan 170'i, Vwf'de yalnızca diferansiyel olarak eksprese edildi.+ ve Vwf değil- HSC'ler ve bunlardan 24'ü zaten seçkin Vwf'dir+ ve Vwf- Trombosit / Mk soyu ile ilişkili genler dahil olmak üzere homeostazdaki HSC'ler (Şekil 1). 5d, e, Ek Şekil. 5e, f ve Ek Veriler 6, 7). Vwf'nin karşılaştırılması+ ve Vwf- Trombositleri tükenmiş farelerden alınan HSC'ler, Vwf'de hücre döngüsü aktivasyon genlerinin zenginleştiğini ortaya çıkardı+ Vwf'nin tercihli aktivasyonunu moleküler düzeyde doğrulayan HSC'ler+ Trombosit tükenmesine yanıt olarak HSC'ler (Ek Şekil 1). 5g ve Ek Veriler 8). Vwf'de farklı şekilde ifade edilen genler+ Trombosit aktivasyonu ve tükenmesinden sonraki HSC'ler esas olarak TGFβ sinyallemesi tarafından düzenlendiği bilinen integrin sinyallemesi ve hücre yapışması ile ilişkilidir.39, aynı zamanda hücre döngüsü, kan pıhtılaşması ve strese/enflamasyona yanıt (Şekil 1). 5d-f). Aşağı regülasyona paralel olarak bu genlerin düzenlenmesinde diğer sinyal yollarının katılımını göz ardı edemeyiz. İlk CBM-PV hücrelerinde (Şek. 4g), aday Aktivin / BMP hedef genleri x3'i çalıştır ve id140 Vwf'de sırasıyla aşağı ve yukarı regüle edildi+ ama Vwf değil- HSC'ler trombosit tükenmesinden sonra (Şekil 1). 5g). Dikkat çekici bir şekilde, α1,6-fukoziltransferaz geni (Fut8) TGFβ ve Aktivin reseptörlerinin aktivitesini farklı şekilde düzenleyen41 ve aynı zamanda integrin sinyallemesinin düzenleyicisidir42 özellikle Vwf'de yukarı regüle edilmiş olarak bulundu+ HSC'ler trombosit tükenmesinden sonra. Ek olarak, anti-GPIbα'nın neden olduğu trombosit tükenmesine yanıt olarak Vwf+ HSC'ler ancak Vwf-HSC'ler yukarı regüle edilmedi Fkbp1aTGFβ, Aktivin ve BMP reseptörlerinin aşağı akışındaki sinyallerin yoğunluğunu ve süresini modüle eden Smad sinyalinin hücre içi bir düzenleyicisi43,44 (İncir. 5g). Aşağı regülasyon ile birlikte İlk CBM-PV hücrelerinde (Şek. 4g), bu veriler, sessizliği güçlendiren TGFβ sinyallemesinden aktive edici Aktivin / BMP sinyallemesine geçişin, akut trombosit aktivasyonu ve tükenmesine yanıt olarak HSC'lerin integrin aktivitesinde, hücre yapışmasında ve hücre döngüsü durumunda değişikliklere yol açabileceğini göstermektedir.
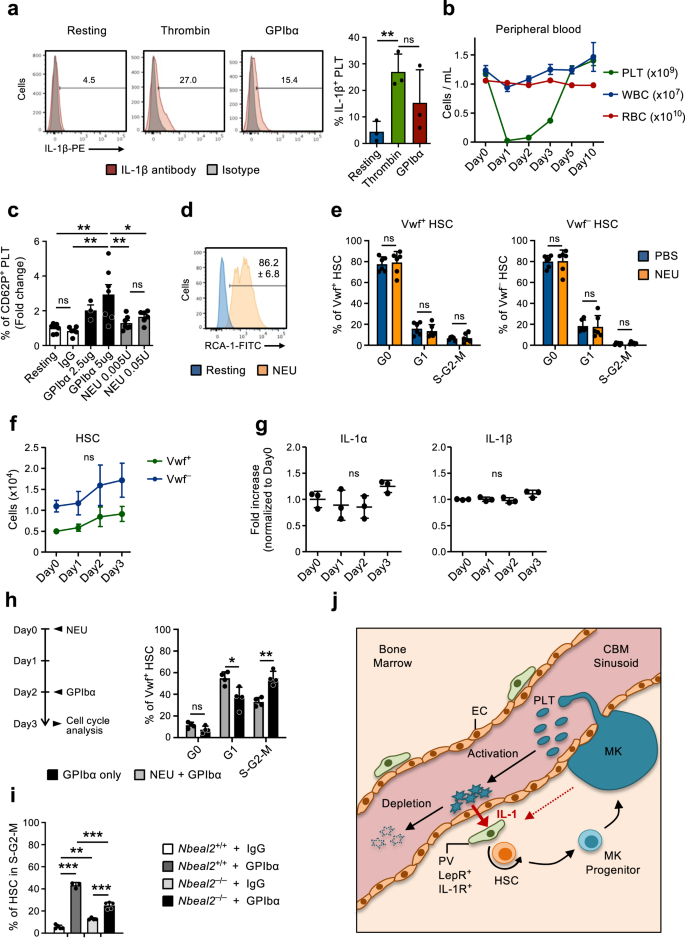
Trombosit aktivasyonu, trombosit tükenmesine HSC yanıtı için gereklidir
CBM-EC'lerin gen ekspresyon analizi, trombosit aktivasyonu ve pıhtılaşmasıyla ilişkili olan trombosit tükenmesi üzerine yukarı doğru düzenlenen birkaç gen ortaya çıkardı (Şekil 1). 2f, g). Bu, trombositlerin sıklıkla tüketildiği mekanizma ile uyumludur.45, burada Fc'den bağımsız trombosit aktivasyonunu indükleyerek işlev gören, trombosit sialidaz nöraminidaz-1'in (NEU) membrana translokasyonuna, desialilasyona ve karaciğerde müteakip temizlenmeye yol açan GPIbα aracılı trombosit tükenmesi tarafından taklit edilir20. Ayrıca trombositler inflamasyonun önemli aracıları olarak kabul edilmektedir.46,47 ve aktivasyon üzerine IL-1 protein ekspresyonunu hızla düzenler (Şekil XNUMX). 6a), daha önce başkaları tarafından gösterildiği gibi48,49,50. Bu, burada gözlemlenen Vwf'nin IL-1'e bağımlı aktivasyonuna aracılık etmede trombosit aktivasyonu ve müteakip tüketimin rolünü destekler.+ Trombositopeniye yanıt olarak HSC'ler. Bu olasılığı daha fazla araştırmak için fareleri NEU ile tedavi ettik.51GPIbα tedavisine benzer şekilde (Şekil 1). 1a) etkili trombosit tükenmesine yol açar (Şekil 1). 6b) ancak trombosit aktivasyonunu atlar20. Yüzey P-Selektin (CD62P) boyama ile ölçüldüğü gibi, GPIbα tedavisi trombositleri in vitro olarak etkili bir şekilde aktive ederken, in vitro NEU tedavisi yalnızca çok hafif bir trombosit aktivasyonuyla ve yalnızca yüksek konsantrasyonlarda sonuçlandı (Şekil XNUMX). 6c). Ancak in vitro NEU aktivitesi şu şekilde doğrulandı: Ricinus communis aglütinin I (RCA-1) etiketlemesi (Şek. 6d), özellikle desialile edilmiş proteinlere bağlanan20. Trombositlerin in vivo olarak aynı verimlilikle tükenmesine rağmen, anti-GPIba tedavisinden farklı olarak NEU tedavisi, HSC hücre döngüsü aktivasyonuyla sonuçlanmadı (Şekil 1). 6e) ve Vwf sayılarını önemli ölçüde artırmadı+ veya Vwf- HSC'ler (Şek. 6f), LSK Flt3-CD48+CD150+ BM'deki MPP'ler, MegE öncesi ve MkP'ler (Ek Şekil 1). 6a, b). Dikkat çekici bir şekilde, NEU ile tedavi edilen farelerde BM'deki IL-1a ve IL-1β seviyeleri büyük ölçüde değişmeden kaldı (Şekil XNUMX). 6g). Bu sonuçlar, HSC'lerin gözlemlenen IL-1'e bağımlı aktivasyonunda, sadece trombosit kaybından ziyade, anti-GPIba aktivasyonunun neden olduğu trombosit tükenmesinin rol oynadığını göstermektedir. Önceki çalışmalar, Mks'nin ve bunların salgıladığı faktörlerin, HSC'nin sessizliği/çoğalmasının düzenlenmesinde bir rol oynadığını ortaya koydu31,32,33,52. Mks aynı zamanda GPIba'yı da eksprese ettiğinden, anti-GPIba antikor tedavisine yanıt olarak gözlemlenen HSC aktivasyonunda trombositlerin rolünü daha spesifik olarak göstermek için, Mks'den bağımsız olarak anti-GPIba antikorunu, trombositlerin NEU ile etkin bir şekilde tüketildiği farelere uyguladık. -tedavi (Şek. 6b), Mks sayısını değiştirmez33. Bu sıralı NEU-GPIbα tedavisi, Vwf'nin hücre döngüsü aktivasyonunun azalmasıyla sonuçlandı+ HSC'ler, tek başına GPIbα tedavisiyle karşılaştırıldığında (Şekil 1). 6h), trombositlerin bu sürece dahil olduğunu doğruluyor. Bununla birlikte, NEU'su tükenmiş trombositleri olan farelerde, normal trombosit sayıları olan kontrol fareleri ile karşılaştırıldığında bir miktar HSC aktivasyonunun gözlemlendiği gerçeği (Şekil 1). 1d ve 3e), ayrıca anti-GPIba antikor tedavisine yanıt olarak gözlemlenen HSC aktivasyonunda Mks'nin rolünü de destekler.
(Ek Şek. 4). a IL-1β'nın dinlenme halindeki trombositlerde veya trombin veya GPIba antikoru ile in vitro aktivasyondan (3 saat) sonra ekspresyonu. (Solda), temsili FACS profilleri. Grafiklerdeki sayılar, 3 bağımsız deneyden elde edilen ortalama frekanslardır. (Sağ) IL-1β Frekansı+ trombositler; 3 bağımsız deneyde koşul başına 3 biyolojik kopyanın ortalama ± SD'si. Her biyolojik kopya, 2-3 fareden toplanan trombositlerden oluşur. b İn vivo Nöraminidaz (NEU) uygulamasını takiben periferik kan hücresi soylarının kinetik analizi. Veriler, 10 bağımsız deneyden elde edilen 0 (Gün7), 1 (Gün8), 2 (Gün9), 3 (Gün6), 5 (Gün3) ve 10 (Gün6) farenin ortalama ± SEM'sini temsil eder. PLT trombositleri, WBC beyaz kan hücreleri, RBC kırmızı kan hücreleri. c Belirtilen konsantrasyonlarda GPIba antikoru veya NEU ile in vitro inkübasyonun ardından akış sitometrisi ile ölçülen trombositler üzerinde yüzey P-selektin (CD62P) ekspresyonu. Veriler CD62P %'sinin ortalama ± SD kat değişikliklerini temsil eder+ 7 (Dinlenme), 6 (IgG), 3 (GPIbα-2,5ug), 7 (GPIbα-5ug), 7 (NEU 0.005U) ve 6 (NEU)'dan oluşan, işlenmemiş (dinlenme) trombositlerle ilişkili olarak her koşuldaki hücreler 0.05U) fareler 3 bağımsız deneyde kullanıldı. d Dinlenme halindeki trombositlerde veya NEU ile 30 dakikalık tedaviden sonra in vitro nöraminidaz (NEU) aktivitesi, RCA-1 bağlanmasıyla analiz edildi. 1 biyolojik kopyadan 3'inden temsili profil. Sayılar ortalama ± SD % RCA-1+ trombositlerini gösterir. e Vwf'nin ortalama ± SD hücre döngüsü faz dağılımı+ (solda) ve Vwf- (sağda) NEU ile trombosit tükenmesinden 1 gün sonra HSC'ler. 6 bağımsız deneyde koşul başına 3 fareden elde edilen veriler. f NEU ile trombosit tükenmesinden sonra belirtilen zaman noktalarında farelerin kemik iliğindeki HSC bölmesinin FACS bazlı değerlendirmesi. Veriler mutlak sayıları temsil eder Vwf-GFP+ (Vwf+) Veya Vwf-GFP- (Vwf-) Trombosit tükenmesinden sonra belirtilen zaman noktalarında HSC'ler (ortalama ±SEM). Veriler, 5 bağımsız deneydeki 0 (Gün4), 1 (Gün5), 2 (Gün6) ve 3 (Gün4) fareden alınmıştır. Vwf sayılarında anlamlı bir değişiklik gözlenmedi+ veya Vwf- HSC'ler herhangi bir zaman noktasında. g Neuraminidase ile trombosit tükenmesinden sonra belirtilen zaman noktalarında farelerden izole edilen kemik iliği hücre dışı sıvısındaki belirtilen sitokinlerin ortalama ± SD seviyeleri (Day0'a göre kat artışı). 3 bağımsız deneyde zaman noktası başına 2 fareden elde edilen veriler. h Fareler 0. günde NEU ile tedavi edildi, ardından 2. günde GPIba antikoru uygulandı ve 3. günde (solda) Vwf'de hücre döngüsü faz dağılımı açısından analiz edildi.+ HSC'ler (sağda). Kontrol fareleri yalnızca GPIba antikoruyla tedavi edildi ve 1 gün sonra analiz edildi. Veriler, 4 bağımsız deneyde grup başına 2 farenin ortalama ± SD frekanslarını temsil eder. i S-G2-M'deki HSC'ler Nbeal2- / - trombosit tükenmesinden (GPIbα) 1 gün sonra fareler. Veriler 5 (Wt-IgG), 3 (Wt-GPIbα), 4 () ortalama ± SD hücre frekanslarını temsil ederNbeal2- / --IgG) ve 5 (Nbeal2- / -3 bağımsız deneyden koşul başına -GPIbα) fareler. j Önerilen geri bildirim mekanizmasını gösteren şema. Aktive edilmiş trombositler tüketilirken, IL-1 salgılar; bu, IL-1R'yi eksprese eden PV hücrelerini aktive ederek HSC proliferasyonunu ve trombosit soyuna doğru farklılaşmayı indükler. Belirtildiği gibi Mks ayrıca, aktivasyona bağlı trombosit tükenmesine yol açan anti-GPIba antikoru ile tedaviye yanıt olarak HSC'lerin tarif edilen çoğalmaya katılımına da katkıda bulunabilir. Tüm veriler için ***p <0.001; **p < 0.01; *p < 0.05 (Yalnızca anlamlı farklar için gösterilir) Tukey'in çoklu karşılaştırmalarıyla 1 yönlü ANOVA kullanılarak (a, c, f, i), Sidak'ın çoklu karşılaştırmalarıyla 2 yönlü ANOVA (e, h) veya Dunnett'in çoklu karşılaştırmaları (g); önemsiz. Ayrıca bkz. Ek Şek. 6.
Trombositler, trombosit aktivasyonu üzerine salınan trombosit granüllerinde çok sayıda inflamatuar modülatör depolar.53,54. GPIbα aracılı HSC aktivasyonu için trombosit granül içeriğinin salınmasının gerekli olup olmadığını daha fazla araştırmak için, GPIbα eksikliği olan farelerde trombosit tükenmesini (GPIbα tedavisi) indükledik. Nbeal2 (Nbeal2-/-), trombosit α-granüllerinden yoksun olan55. Nbeal2-/- Fareler, trombosit sayısında küçük bir azalmaya ve HSC'lerde hafif bir artışa rağmen genel olarak normal hematopoeze sahiptir (Ek Şekil 1). 6c-e). Anti-GPIbα tedavisinden bir gün sonra Nbeal2-/- Fareler, tedaviden önce daha yüksek bir HSC frekansının döngüde olmasına rağmen, Wt farelerine kıyasla aktif olarak bisiklet süren HSC'lerin frekansı önemli ölçüde azaldı (Şekil 1). 6i). Birlikte bu bulgular, trombosit aktivasyonu üzerine salgılanan IL-1 ve diğer düzenleyicilerin, trombositopeniye yanıt olarak HSC'lerin aktivasyonunun düzenlenmesinde rol oynayabileceğini öne sürdü.
- SEO Destekli İçerik ve Halkla İlişkiler Dağıtımı. Bugün Gücünüzü Artırın.
- PlatoData.Network Dikey Üretken Yapay Zeka. Kendine güç ver. Buradan Erişin.
- PlatoAiStream. Web3 Zekası. Bilgi Genişletildi. Buradan Erişin.
- PlatoESG. karbon, temiz teknoloji, Enerji, Çevre, Güneş, Atık Yönetimi. Buradan Erişin.
- PlatoSağlık. Biyoteknoloji ve Klinik Araştırmalar Zekası. Buradan Erişin.
- Kaynak: https://www.nature.com/articles/s41467-023-41691-y