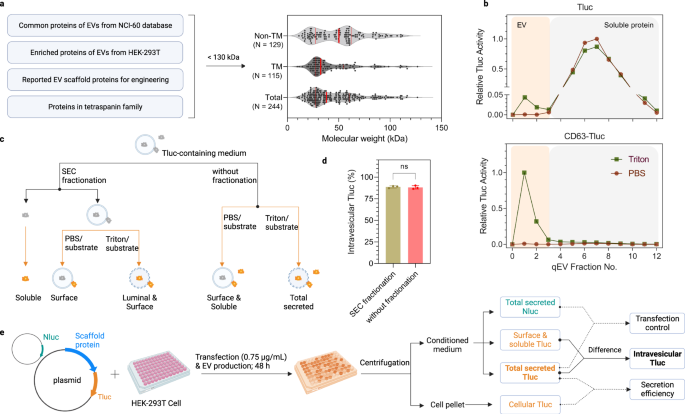
Простой анализ для скрининга EV-сортирующих белков
В поисках эффективных EV-сортирующих белков список кандидатов был составлен на основе обзора литературы и баз данных протеомики. Потенциальные кандидаты были получены из (1) белков, которые, как было обнаружено, обогащены EV в клетках NCI-60.29, (2) белки, обильные в EV, продуцируемые эпителиальными клетками почки эмбриона человека (HEK)-293T34, (3) сообщили о белках, сортирующих EV, в качестве ссылок на предыдущие исследования.32,33, и (4) все белки в суперсемействе тетраспанинов. Белки размером более 130 кДа были исключены, чтобы облегчить сверхэкспрессию/инженерию. Всего было включено 244 кандидата со средним размером 38 кДа, из которых 129 не- и 115 трансмембранных белков (рис. 1a; полный список см. в файле источника данных).
a Критерии выбора и обзор белков-кандидатов, сортирующих EV. Сплошные красные линии обозначают значения процентиля 25%, 50% и 75%. b Профили элюции SEC кондиционированных сред из клеток HEK-293T, экспрессирующих Tluc или CD63-Tluc. Активность Tluc в каждой фракции количественно определяли непосредственно (группа PBS) или после лизиса мембраны (группа Triton) и нормализовали по фракции с самым высоким сигналом. ЭВ и растворимые белки были выделены во фракциях 0-3 и 4-12 соответственно. c Схема дифференциации форм Tluc в кондиционированных средах. d Процент внутривезикулярных Tluc для CD63-Tluc с использованием фракционированных и нефракционированных сред. Результаты представлены как среднее значение ± стандартное отклонение для трех биологических повторов. Двусторонний Студенческий t тестовое задание (P > 0.9999). нс: не имеет значения. e Краткое описание процедуры скрининга и анализа данных. Клетки HEK-293T выращивали в 96-луночных микропланшетах и совместно трансфицировали плазмидой слияния Tluc и плазмидой Nluc. Культуры клеток центрифугировали и измеряли активность Tluc в клеточном осадке и кондиционированной среде. Активность Nluc количественно определяли только в кондиционированных средах. c, e Создано с BioRender.com. Исходные данные предоставляются в виде файла исходных данных. Эксклюзионная хроматография SEC.
Чтобы оценить способность кандидатов в люминальную загрузку в EV, мы разработали анализ на основе репортера люциферазы ThermoLuc (Tluc; 60.5 кДа).18. Вкратце, Tluc был слит с С-концами всех кандидатов, имея в виду, что N-концы обычно являются сайтами для сигнальных пептидов и посттрансляционных модификаций. Плазмиды, кодирующие слитые белки, трансфицировали в клетки HEK-293T. Через 48 часов кондиционированную среду собирали и дополнительно обрабатывали перед измерениями биолюминесценции. Первоначально для оценки осуществимости этого анализа анализировали кондиционированные среды клеток, экспрессирующих только Tluc и CD63-Tluc. Оба были фракционированы на колонках эксклюзионной хроматографии (SEC) для отделения везикул от свободных белков (фиг. 1b)35. Фракции обрабатывали либо PBS для определения растворимых/связанных с поверхностью Tluc, либо детергентом Triton X-100 для определения общего количества секретируемых Tluc (фиг. 1c). По сравнению с одним Tluc, слияние с CD63 приводило к заметному сдвигу Tluc в сторону фракции EV (рис. 1b). Примечательно, что активность Tluc во фракциях EV была обнаружена только при лизисе мембраны, что указывает на то, что субстрат Tluc не может пересекать мембрану EV и реагировать с люминальной люциферазой. Это означает, что SEC фракционирование необязательна для количественного определения люминальных белков. Это дополнительно подтверждается сравнением нефракционированных и фракционированных сред клеток, экспрессирующих CD63-Tluc, которые не выявили существенных различий в процентном содержании внутривезикулярных Tluc (рис. 1d). В совокупности эти данные показывают, что этот анализ можно использовать в формате с высокой пропускной способностью для выявления потенциальных каркасов для загрузки EV.
В дальнейшем принцип отбора всех 244 кандидатов был таким же, как и выше. Для последующих анализов белки в первую очередь оценивали по абсолютному количеству внутривезикулярного Tluc, полученному из разницы в сигнале Tluc, обнаруженном с лизисом мембраны и без него, или по его относительному проценту (фиг. 1e). Информацию об экспрессии слитых белков получали путем измерения Tluc в клетках, продуцирующих EV. Кроме того, если указано, данные были нормализованы к контролю трансфекции в виде плазмиды, кодирующей люциферазу NanoLuc (Nluc), которая была добавлена в смесь для трансфекции для учета возможных вариаций трансфекции.
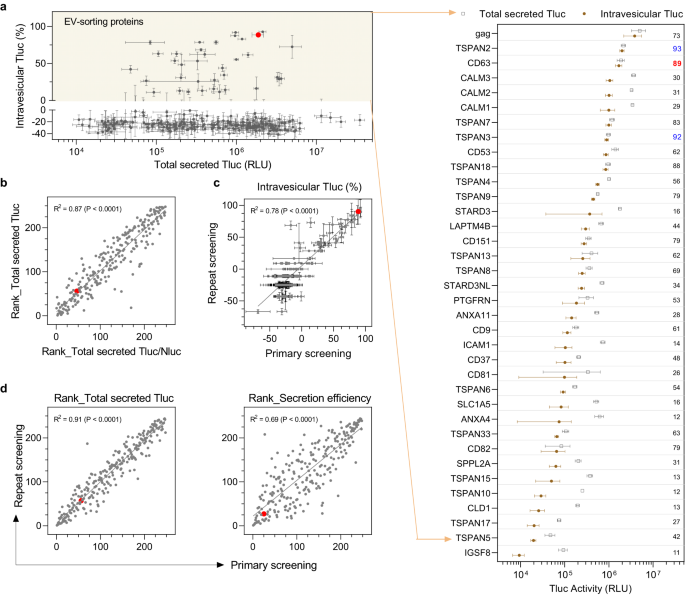
Скрининг идентифицирует десятки белков, сортирующих ЭВ
Скрининг 244 кандидатов в клетках HEK-293T не выявил очевидной корреляции между внутривезикулярным Tluc и клеточным или общим секретируемым Tluc (дополнительная рис. 1a, b), что указывает на то, что ни клеточная экспрессия, ни общая секреция полностью не предсказывают способность EV-сортировать. Для большинства кандидатов процент внутривезикулярных Tluc был ниже нуля, что неожиданно, но может быть связано с ослабленной активностью фермента и/или временем жизни фотона в присутствии детергента Тритона. Тем не менее, это обеспечило разумное и практичное ограничение для белков со способностью сортировать EV. В соответствии с этим определением было обнаружено, что в клетках HEK-36T в общей сложности 293 белков проявляют способность к сортировке EV (рис. 2a). Среди них были пять известных белков, сортирующих ЭВ, включая три маркера ЭВ (CD9, CD63, CD81), один недавно идентифицированный белок (PTGFRN).32, и вирусный гликопротеин кляп, тем самым подтверждая достоверность нашего протокола скрининга. Насколько нам известно, впервые сообщается об оставшихся 31 белке, способных загружать люминальный груз в EV.
a Обзор всех 244 кандидатов с нанесением общего количества секретируемых Tluc в зависимости от процента внутрипузырных Tluc. Было определено, что белки, сортирующие EV, имеют процент внутривезикулярного Tluc выше нуля (желтая область) и показаны на сгруппированном точечном графике. Значение относится к проценту внутрипузырного Tluc. Белки помечены именами генов. b Корреляция между рейтингом общего количества секретируемых Tluc и рейтингом отношения общего секретируемого Tluc/Nluc. c Корреляция процентного содержания внутрипузырных Tluc, полученных при первичном и повторном скрининге. d Корреляция ранга в отношении секретируемого Tluc или эффективности секреции между первичным и повторным скринингом. Результаты в (a, b) были получены при первичном скрининге и показаны как среднее значение ± стандартное отклонение для пяти биологических повторов. Данные повторного скрининга представлены как среднее значение ± стандартное отклонение для трех биологических повторностей. На диаграммах разброса каждая точка относится к одному кандидату, а красная точка указывает на контрольный CD63. Степень корреляции была проанализирована с помощью линейной регрессии и показана как критерий согласия (R2) и значение ненулевого наклона (P). Исходные данные предоставляются в виде файла исходных данных.
Из четырех известных невирусных белков, сортирующих EV, CD63 показал самый высокий процент внутривезикулярных Tluc, при этом 89% общего секретируемого Tluc локализовано внутри EV. Примечательно, что TSPAN2 превосходил CD63 не только с точки зрения относительного внутривезикулярного Tluc (93% против 89%), но и абсолютного количества (2.0e6 против 1.7e6; подробную информацию см. в файле исходных данных). Кроме того, три белка кальмодулина (CALM1, CALM2, CALM3) сортировали значительные количества Tluc в EV, но с умеренным процентом внутривезикулярных Tluc (29–31%).
Чтобы исключить влияние каких-либо нежелательных факторов на секрецию Tluc, были введены соответствующие средства контроля качества. Во-первых, все кандидаты были ранжированы в соответствии с общим количеством секретируемых Tluc и отношением общего количества секретируемых Tluc к Nluc. Нормализация по сигналу Nluc не влияла на секрецию Tluc (рис. 2b), тем самым отбрасывая смешанную роль процедуры трансфекции. Во-вторых, повторение скрининга показало стабильные результаты для процентного содержания внутрипузырных Tluc (рис. 2c), а также ранги общего секретируемого Tluc и эффективности секреции (рис. 2d). Наконец, ранги общего секретируемого Tluc и эффективности секреции показали высокую степень линейной корреляции между двумя различными дозами плазмиды (0.75 мкг/мл против 1 мкг/мл; дополнительная рис. 1c). В совокупности эти результаты подтверждают надежность результатов, полученных с помощью нашего метода скрининга.
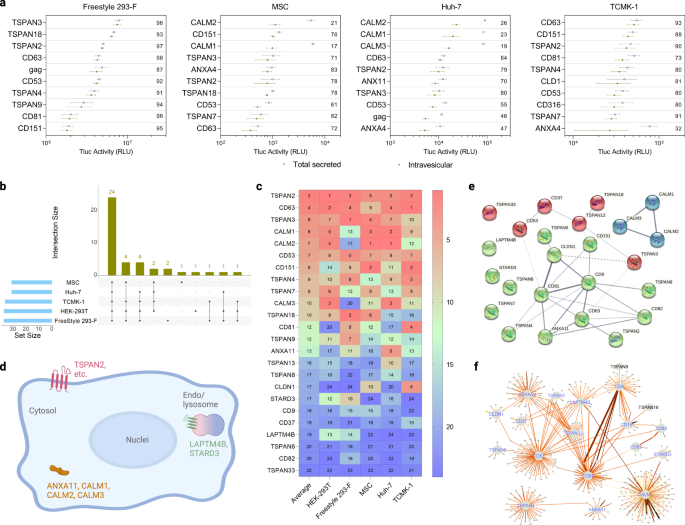
Белки, сортирующие EV, в значительной степени консервативны в разных типах клеток.
Помимо HEK-293T, другие типы клеток регулярно используются в качестве источников EV, что побудило нас проверить способность наших кандидатов сортировать EV в (1) клетках HEK, адаптированных к суспензии (Freestyle 293-F), (2) клетках, полученных из пуповинной крови человека. мезенхимальные стволовые клетки (МСК), (3) клетки карциномы, происходящие из гепатоцитов человека (Huh-7), и (4) эпителиальные клетки почки мыши (TCMK-1). С этой целью 95 кандидатов, показавших многообещающие результаты при начальном скрининге, в любой из этих категорий: процентное содержание внутрипузырных Tluc, общее количество секретируемых Tluc и эффективность секреции (подробную информацию см. в файле исходных данных), были проверены, как указано выше.
В Freestyle 293-F белком с самой высокой способностью к сортировке EV с точки зрения процента внутривезикулярных Tluc был TSPAN3. В МСК и Huh-7 высший ранг занимал CALM2, а в TCMK-1 – CD63 (рис. 3a). Хотя не было обнаружено, что процедура трансфекции существенно влияет на секрецию Tluc во всех протестированных прикрепленных клетках, Freestyle 293-F оказался более склонным к вариациям (дополнительная рис. 2). Для каждого типа клеток было идентифицировано от 30 до 37 белков с EV-сортирующей способностью (процент внутривезикулярных Tluc выше нуля) (рис. 3b). Из них 24 белка были сохранены во всех пяти типах клеток, что указывает на их надежную способность к сортировке в различных клеточных контекстах (полный список см. в файле исходных данных). Белки в консервативной подгруппе были ранжированы в соответствии с их абсолютной внутривезикулярной активностью Tluc (рис. 3c). В среднем TSPAN2, CD63 и TSPAN3 продемонстрировали наилучшие способности к сортировке в разных типах клеток.
a Десять основных каркасных белков в отношении внутривезикулярного Tluc в различных типах клеток-продуцентов. Значение внутри графика относится к проценту внутрипузырного Tluc. Результаты представлены как среднее значение ± стандартное отклонение для трех биологических повторностей. b Количество EV-сортирующих белков, идентифицированных для каждого типа клеток-продуцентов, и их перекрытие между типами клеток. c Ранг 24 консервативных белков, сортирующих EV, относительно внутривезикулярного Tluc в каждом типе клеток. Значение указывает ранг в каждом типе ячеек, а также его среднее значение. d Топология и субклеточное расположение 24 консервативных EV-сортирующих белков. Создано с BioRender.com. (ef) Сеть взаимодействия 24 консервативных белков, сортирующих EV, извлеченных из STRING (e) и IntAct (f) базы данных. Толщина линии в панелях (e, f) указывает на надежность данных, а более толстая линия указывает на более сильные доказательства. Белки помечены именами генов. Исходные данные предоставляются в виде файла исходных данных.
Чтобы получить более глубокое понимание потенциальных механизмов, которые управляют способностью консервативного подмножества к сортировке EV, были проведены биоинформатические исследования. Согласно аннотации, доступной на UniProtKB, только три белка кальмодулина и ANXA11 являются цитозольными, в то время как все остальные белки являются членами надсемейства тетраспанинов и локализованы либо на мембране плазмы, либо на эндосомах/лизосомах (рис. 3d). Затем мы оценили возможные взаимодействия между 24 EV-сортирующими белками. Экспериментальный и предсказанный интерактом, доступный из базы данных STRING, показал слабые доказательства взаимодействия TSPAN2/TSPAN3 с CD63, и белки кальмодулина, по-видимому, действуют независимо от остальных (рис. 3e). Точно так же результаты из базы данных IntAct, которая включает как прямые, так и непрямые взаимодействия, показали, что интерактом TSPAN2 плохо перекрывается с интерактомом трех хорошо охарактеризованных тетраспанинов CD9/CD63/CD81 (рис. 3f). Эти предсказания указывают на то, что TSPAN2 и TSPAN3 действуют в значительной степени независимо друг от друга и других тетраспанинов.
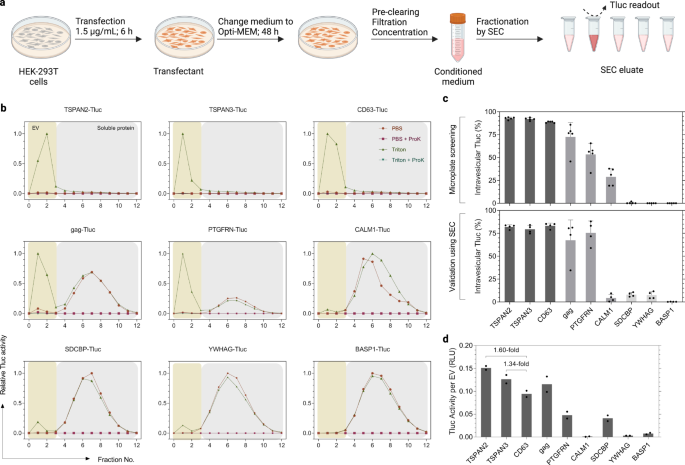
Кандидаты на сортировку электромобилей доказали свою надежность на фоне стандартизированного производства электромобилей
При скрининге клетки HEK-293T выращивали и трансфицировали в 96-луночных микропланшетах с целью повышения производительности. Однако такой масштаб неприемлем для будущих приложений, стремящихся производить большее количество инженерных электромобилей. Кроме того, кондиционированные среды при скрининге анализировали непосредственно после центрифугирования без каких-либо определенных методов разделения. Здесь нас особенно интересовали малые электромобили (sEV, ≤ 200 нм) из-за их терапевтического потенциала при многих заболеваниях.36,37. Имея это в виду, мы производили электромобили в соответствии со стандартизированным протоколом, недавно установленным нашей группой.38. Основными отличиями от первоначального протокола скрининга были (1) более высокая доза плазмид и более короткая продолжительность трансфекции, (2) последующее поддержание в Opti-MEM и (3) фильтрация кондиционированных сред через 200-нм мембрану с последующей концентрацией шаг (рис. 4a). Кроме того, sEV отделяли от растворимых белков с помощью SEC перед измерением активности Tluc и количества везикул (фиг. 4b). Примечательно, что Tluc в элюате был полностью деактивирован протеиназой К, что указывает на то, что устойчивые белковые агрегаты не вызывают беспокойства (рис. 4b).
a Рабочий процесс производства EV и протокол фракционирования SEC. Создано с BioRender.com. b Профили элюции SEC кондиционированных сред из трансфицированных клеток HEK-293T. ЭВ и растворимые белки были выделены во фракциях 0–3 и 4–12 соответственно. Активность Tluc в каждой фракции измеряли с Triton и ProK и без них и нормализовали по фракции с самым высоким сигналом. c Процент внутрипузырных Tluc с использованием протоколов скрининга (верхняя панель; пять биологических повторов) и стандартизированного (нижняя панель; четыре биологических повтора). Среднее ± стандартное отклонение. d Расчетная активность Tluc на везикулу для очищенных препаратов EV. Результаты представлены в виде среднего значения двух биологических повторов. Белки помечены именами генов. Исходные данные предоставляются в виде файла исходных данных. Эксклюзионная хроматография SEC.
Чтобы получить представление о способности sEV-сортировки, были отобраны девять репрезентативных кандидатов на основе их результатов при скрининге (рис. 4c). Процент внутрипузырных Tluc в целом совпадал со скринингом, демонстрируя высокую (>80%; TSPAN2, TSPAN3 и CD63) и низкую (<15%; SDCBP, YWHAG, BASP1) способность к сортировке sEV (рис. 4c). Интересно, что CALM1 отсортировал только 3.7% Tluc в sEV по сравнению с 28.9% при скрининге (P < 0.01, двусторонний Стьюдент t тест). Принимая во внимание количество везикул, мы заметили, что TSPAN2 и TSPAN3 превосходят CD63 по активности Tluc на EV (в 1.60 и 1.34 раза соответственно; рис. 4d). В целом, эти результаты показывают, что способность этих девяти кандидатов к сортировке практически не изменилась при соблюдении стандартизированного протокола производства sEV.
Кандидаты на сортировку электромобилей оказались универсальными для разных грузов
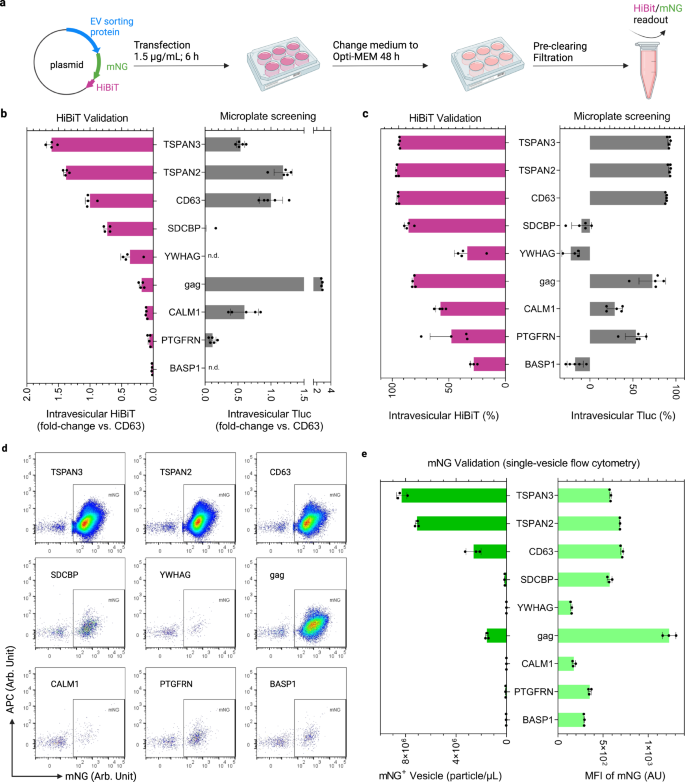
Люцифераза является удобным репортером для количественной оценки сконструированных электромобилей в больших количествах. Тем не менее, чтобы получить больше информации о количестве сконструированных EV и обилии грузовых белков на EV, методом выбора является проточная цитометрия с визуализацией одиночных везикул.39,40. Таким образом, для девяти белков-кандидатов, исследованных выше, Tluc был заменен гибридным репортером, состоящим из флуоресцентного белка mNeonGreen (mNG; 26.6 кДа), слитого с HiBiT.41, 11-мерный пептид расщепленной люциферазы Nluc (фиг. 5a).
a Рабочий процесс производства и анализа электромобилей. Создано с BioRender.com. b Внутривезикулярный HiBiT по сравнению с контрольным CD63. и не обнаружено. c Процент внутрипузырного HiBiT. В b, c, результаты показаны как среднее значение ± стандартное отклонение четырех биологических повторностей. Результаты скрининга клеток HEK-293T были повторно представлены для справки. d Точечные графики проточной цитометрии с одним пузырьком для mNG-HiBiT-меченых EV. e Концентрация и средняя интенсивность флуоресценции (MFI) mNG-положительных EV. Результаты представлены как среднее значение ± стандартное отклонение для трех биологических повторностей. Белки помечены именами генов. Исходные данные предоставляются в виде файла исходных данных.
Сравнение внутрипузырной люциферазной активности HiBiT и Tluc выявило сравнимую эффективность инженерии для TSPAN3, TSPAN2 и CD63 с точки зрения количества (рис. 5b) и в процентах (рис. 5c). Используя mNG для изучения уровня отдельных везикул, TSPAN3 и TSPAN2 продуцировали наибольшее количество сконструированных EV, превосходя CD63 примерно в три раза, при этом достигая аналогичных уровней mNG на сконструированный EV (рис. 5d, e). Кроме того, мы показали, что mNG совместно локализовался с соответствующими сортирующими белками на EV после окрашивания антителами, что свидетельствует об интактных слитых белках (дополнительная рис. 3). Удивительно, но измерения на основе HiBiT и Tluc сильно различались для кляпа (рис. 5b, c); однако его уровни мНГ не показали такого расхождения (рис. 5d, e). Это привело нас к предположению, что стерическая конфигурация gag-mNG-HiBiT не позволяет HiBiT образовывать комплексы со своей партнерской субъединицей с образованием функциональной люциферазы. Кроме того, CALM1 показал низкие уровни везикулярного HiBiT и mNG в соответствии с тенденцией, наблюдаемой для CALM1-Tluc в экспериментах по проверке SEC (рис. 4c). Эти результаты свидетельствуют о том, что CALM1 предпочтительно сортируется в более крупные везикулы (> 200 нм), которые удаляются на этапе фильтрации (дополнительная рис. 4).
Мы дополнительно оценили эффективность этих выбранных белков в клетках Freestyle 293-F, которые являются важным источником продукции EV из-за менее утомительной процедуры размножения. Опять же, TSPAN3 и TSPAN2 превзошли CD63 на 82% и 50% соответственно с точки зрения внутривезикулярного HiBiT (дополнительная рис. 5a). На уровне отдельных везикул самая высокая концентрация mNG-позитивных везикул была произведена клетками Freestyle 3-F, сконструированными TSPAN2 и TSPAN293 (дополнительная рис. 5b). В совокупности результаты согласования, основанные на репортерах mNG-HiBiT и Tluc, усиливают надежность протокола скрининга и подчеркивают надежную способность белков-кандидатов к сортировке EV для различных грузов.
Отличительные молекулярные сигнатуры электромобилей, созданных на основе тетраспанина
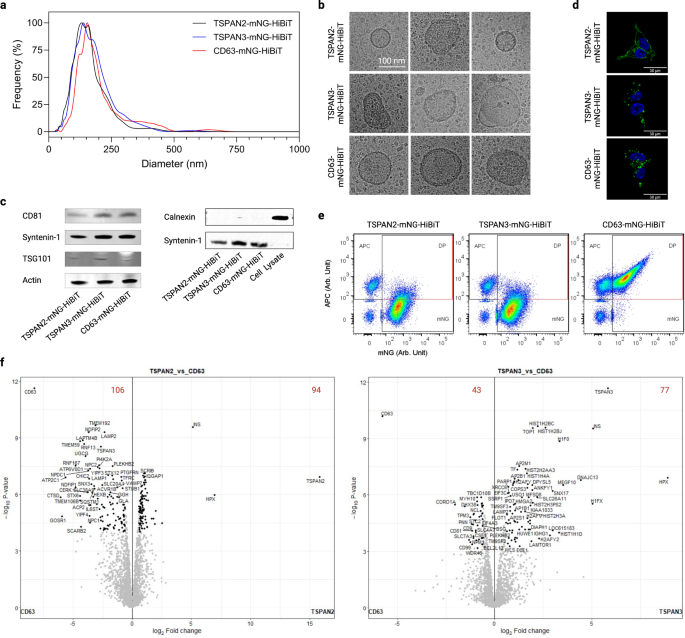
На протяжении всех экспериментов TSPAN2 и TSPAN3 оказались среди лучших белков, сортирующих EV, по-видимому, работая лучше, чем хорошо охарактеризованный тетраспанин CD63. Примечательно, что различные изоформы сплайсинга TSPAN2 и TSPAN3 не смогли сохранить способность к сортировке EV в клетках HEK293-T (дополнительная рис. 6). Поскольку, насколько нам известно, это первое сообщение об этих белках для эндогенной инженерии EV, мы более подробно охарактеризовали физико-химические особенности TSPAN2- и TSPAN3-инженерных EV по отношению к CD63-инженерным EV.
Анализ слежения за наночастицами препаратов EV из трансфицированных клеток HEK-293T выявил узкое распределение по размерам со средним гидродинамическим диаметром примерно 120 нм (рис. 6a). Кроме того, их морфологический вид был типичен для ЭВ, что подтверждается структурой и размером мембраны (рис. 6b). Более того, в ЭВ были обнаружены общие маркеры ЭВ, такие как CD81, синтенин-1 и TSG101, но не негативный маркер кальнексин (рис. 6c). Кроме того, мы исследовали расположение трех белков тетраспанина в трансфицированных клетках, чтобы получить представление о биогенезе EV. В то время как TSPAN2 был локализован как в плазматической мембране, так и в цитозоле клеток-продуцентов, TSPAN3 и CD63 в основном обнаруживались в виде точечных сигналов внутри клеток (рис. 6d). Кроме того, производство всех типов инженерных электромобилей было устойчивым к ингибированию церамидом (дополнительный рис. 7a), который является движущей силой признанного пути производства экзосом1,42.
a Распределение размеров EV из трансфицированных клеток HEK-293T. b Репрезентативные изображения криоэлектронной микроскопии электромобилей. c Вестерн-блоты положительных и отрицательных маркеров ЭВ. d Клеточное расположение тетраспанинов в трансфицированных клетках HEK-293T. e Точечные диаграммы одновезикулярной проточной цитометрии EV после окрашивания APC-конъюгированными антителами к тетраспанину CD9/CD63/CD81. f Графики вулканов, показывающие дифференциально обогащенные белки в EV. Красные цифры указывают количество дифференциально обогащенных белков. Результаты были получены из трех биологических повторов. Исходные данные предоставляются в виде файла исходных данных. Протеомные данные масс-спектрометрии были переданы в Консорциум ProteomeXchange через партнерский репозиторий PRIDE с идентификатором набора данных PXD043840.
Чтобы получить представление об их белковых сигнатурах, EV окрашивали классическими панповерхностными маркерами CD9/CD63/CD81 и анализировали на уровне отдельных пузырьков. Сверхэкспрессия тетраспанинов по-разному влияла на выход всех EV (определяемых как все флуоресцентные события, дополнительная рис. 7b) и спроектированные электромобили (определяемые как mNG+ события, дополнительный рис. 7c). Что еще более интересно, только небольшая часть электромобилей, сконструированных с помощью TSPAN2 и TSPAN3, имела на поверхности три классических маркера электромобилей (рис. 6e). Кроме того, анализ экспрессии 39 белков на поверхности EV с помощью мультиплексной проточной цитометрии на основе шариков.43 выявили, что состав поверхностных эпитопов TSPAN2-положительных EV отличается от состава CD9/CD63/CD81-положительных EV (дополнительная фиг. 7d). Помимо поверхностных белков, углубленный протеомный анализ EV показал множество дифференциально обогащенных белков для TSPAN2 (106 деобогащенных и 94 обогащенных) и TSPAN3 (43 деобогащенных и 77 обогащенных) по сравнению с CD63-инженерными EV. CD9/CD63/CD81 были среди белков, которые были значительно снижены в EV, сконструированных с помощью TSPAN2/TSPAN3, что согласуется с результатами, полученными с помощью проточной цитометрии на основе одиночных пузырьков и шариков. На основании анализа Gene Ontology, по сравнению с EV дикого типа из клеток HEK293T, все три типа сконструированных EV (CD63, TSPAN2 и TSPAN3) были обогащены (> 10%) ферментами взаимопревращения метаболитов, ферментами, модифицирующими белок, и белками метаболизма РНК. , но с истощением (> 10%) белков внеклеточного матрикса (дополнительная рис. 8). Затем мы сравнили общий белковый состав с помощью инструмента основного кластерного анализа и обнаружили, что сконструированные EV отличаются от EV дикого типа и, в меньшей степени, друг от друга (дополнительная рис. 7e). Интересно, что по сравнению с EV дикого типа избыточная экспрессия TSPAN2 негативно влияла на уровни CD63 и TSPAN3, что может указывать на конкурентные отношения. С другой стороны, сверхэкспрессия TSPAN3 привела к небольшому увеличению уровней CD63, что свидетельствует о положительной регуляции (дополнительная рис. 7f). В целом, эти результаты показывают, что инженерия на основе TSPAN2/TSPAN3 приводит к возникновению субпопуляций EV, отличных от CD63.
Электромобили, спроектированные ЦПАН2 и ЦПАН3, как способы доставки
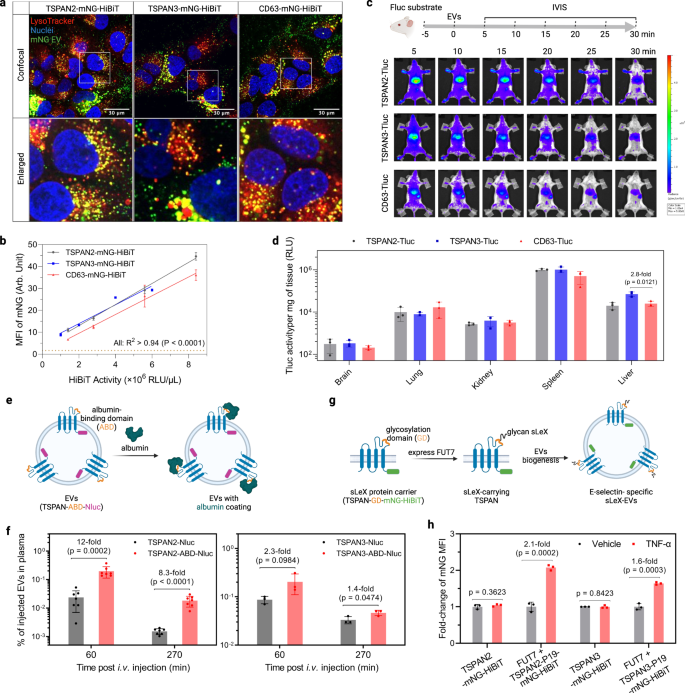
Чтобы выяснить, подходят ли EV, сконструированные с помощью TSPAN2/TSPAN3, для клеточной доставки, мы исследовали их потенциал доставки in vitro и in vivo. Сначала клетки Huh-7 обрабатывали mNG-мечеными EV для изучения их субклеточного расположения в клетках-реципиентах. Сильный точечный желтый сигнал четко указывал на эффективную интернализацию и транспортировку в лизосомы (рис. 7a). Количественная оценка клеточного MFI с использованием проточной цитометрии выявила несколько лучшую эффективность поглощения для ЭВ, сконструированных с помощью TSPAN2/TSPAN3, по сравнению с ЭВ, сконструированными с помощью CD63 (рис. 7b). Для исследований распределения EV у мышей внутривенно вводили равные количества сконструированных EV (на основе активности Tluc) и отслеживали в режиме реального времени с помощью системы визуализации in vivo (дополнительная рис. 9a и рис. 7c). Для всех трех типов сконструированных ЭВ мы наблюдали быстрое распространение в печень и селезенку в течение 5 минут (рис. 7c) и заметное снижение активности всего тела в течение 30 минут (дополнительный рис. 9c, P = 0.0006, критерий Краскела-Уоллиса). ЭВ, сконструированные с помощью TSPAN2 и TSPAN3, по-видимому, обеспечивают несколько более высокое удержание всего тела, чем ЭВ, сконструированные с помощью CD63 (дополнительная рис. 9b). Результаты последующих измерений ex vivo подтвердили преобладающее накопление сконструированных ВВ в печени и селезенке (рис. 7d). В совокупности, как и EV, сконструированные с помощью CD63, EV, сконструированные с помощью TSPAN2 и TSPAN3, эффективно поглощаются клетками in vitro и in vivo.
a Клетки Huh-7 обрабатывали EV в течение 4 часов и окрашивали LysoTracker для визуализации лизосом. Показаны изображения конфокальной микроскопии репрезентативных областей со всей лунки. Эксперимент проводился один раз. b Клетки Huh-7 обрабатывали EV в течение 8 часов. Клеточный mNG MFI количественно определяли с помощью проточной цитометрии. Данные представлены как среднее значение ± стандартное отклонение для трех биологических повторностей. Степень корреляции была проанализирована с помощью линейной регрессии и показана как критерий согласия (R2) и значение ненулевого наклона (P). c Биораспределение ЭВ у мышей. Мышам NMRI внутрибрюшинно вводили d-субстрат люциферина. Через пять минут мышам внутривенно вводили такое же количество сконструированных EV (на основе активности Tluc) и визуализировали с помощью IVIS. Впоследствии были собраны основные органы для измерения биолюминесценции ex vivo. Показаны репрезентативные изображения IVIS. N = 3. d Активность Tluc в органах ex vivo после IVIS. Результаты представлены как среднее значение ± стандартное отклонение для трех мышей. e Схема получения ЭВ, связывающих альбумин. EV собирали из клеток HEK-293T, стабильно экспрессирующих слитые белки. f Связывающие альбумин ЭВ вводили внутривенно и определяли их концентрацию в плазме. Данные представлены как среднее ± стандартное отклонение. N = 7 (для TSPAN2) или 3 (для TSPAN3). g Схема дисплея sLeX на электромобилях. ЭВ собирали из клеток НЕК-293Т, стабильно экспрессирующих компоненты. h Клетки HUVEC активировали TNF-α в течение 2 часов и обрабатывали EV в течение 6 часов. Клеточный mNG MFI был количественно определен с использованием проточной цитометрии и показан как кратное изменение по сравнению с неактивированными клетками. c, e, g Создано с BioRender.com. Данные представлены как среднее значение ± стандартное отклонение для трех биологических повторностей. Двусторонний Студенческий t тест. Исходные данные предоставляются в виде файла исходных данных.
Обширно продемонстрировав возможности загрузки и доставки TSPAN2 и TSPAN3 для световых грузов, мы затем исследовали их потенциал для применения в наземных дисплеях электромобилей. Большие внеклеточные петли (LEL) некоторых тетраспанинов уже использовались для таких приложений, и, учитывая топологическое сходство белков тетраспанина, мы стремились сконструировать LEL TSPAN2 и TSPAN3. Было показано, что вставка альбумин-связывающего домена (ABD) в LEL CD63, CD9 и CD81 резко увеличивает время плазменной циркуляции EV.44. Используя ту же стратегию, ABD был клонирован в LEL TSPAN2 и TSPAN3 с Nluc на С-конце для количественного определения (рис. 7e). ЭВ собирали из клеток HEK-293T, стабильно экспрессирующих слитые белки TSPAN-ABD-Nluc (дополнительная фиг. 9c) и оценивали их способность связывать альбумин. Как и ожидалось, только EV, отображающие ABD, связывались с альбумином (дополнительная рис. 9d). Затем эти ЭВ внутривенно вводили мышам, и концентрации ЭВ в плазме измеряли на основе Nluc в разные моменты времени. По сравнению с EV дикого типа, сконструированными тетраспанином, EV, отображающие ABD, имели значительно более высокую концентрацию в плазме, особенно при использовании TSPAN2 в качестве каркасного белка (рис. 7f).
В другом примере мы стремились достичь специфического нацеливания на активированные эндотелиальные клетки за счет поверхностного отображения гликанового лиганда сиалила Льюиса X (sLeX).45. Поэтому 19-мерный пептидный носитель sLeX (P19) был вставлен в LEL каждого белка тетраспанина с mNG-HiBiT на С-конце. В присутствии фукозилтрансферазы VII (FUT7) Р19 гликозилируется с образованием sLeX (рис. 7g). Основываясь на этом обосновании, sLeX-EV были получены из клеток HEK-293T, стабильно экспрессирующих FUT7 и TSPAN-P19-mNG-HiBiT (дополнительная фиг. 9c). Их поглощение оценивали в эндотелиальных клетках, активированных TNF-α, которые экспрессируют E-селектин, основной рецептор sLeX. ЭВ дикого типа, сконструированные тетраспанином, одинаково поглощались неактивированными и активированными эндотелиальными клетками, в то время как sLeX-EV с использованием либо TSPAN2, либо TSPAN3 в качестве каркаса демонстрировали предпочтительное поглощение активированными эндотелиальными клетками (рис. 7h). В целом, это демонстрирует осуществимость TSPAN2 и TSPAN3 с точки зрения одновременной разработки LEL для отображения на поверхности и C-конца для загрузки груза в просвет, что подчеркивает их потенциал для терапевтического применения.
- SEO-контент и PR-распределение. Получите усиление сегодня.
- PlatoData.Network Вертикальный генеративный ИИ. Расширьте возможности себя. Доступ здесь.
- ПлатонАйСтрим. Интеллект Web3. Расширение знаний. Доступ здесь.
- ПлатонЭСГ. Автомобили / электромобили, Углерод, чистые технологии, Энергия, Окружающая среда, Солнечная, Управление отходами. Доступ здесь.
- Смещения блоков. Модернизация права собственности на экологические компенсации. Доступ здесь.
- Источник: https://www.nature.com/articles/s41467-023-40453-0