Глиобластома (ГБМ) — самая смертоносная и агрессивная форма рака головного мозга. Почти все опухоли рецидивируют после лечения, поскольку выжившие клетки со временем трансформируются в более устойчивые формы, чтобы противостоять дальнейшему лечению. Чтобы решить эту проблему, ученые из Университет Лидса разработали новую двуствольную нанопипетку и использовали ее для исследования траекторий движения отдельных живых клеток ГБМ, когда они изменяются в ответ на лечение.
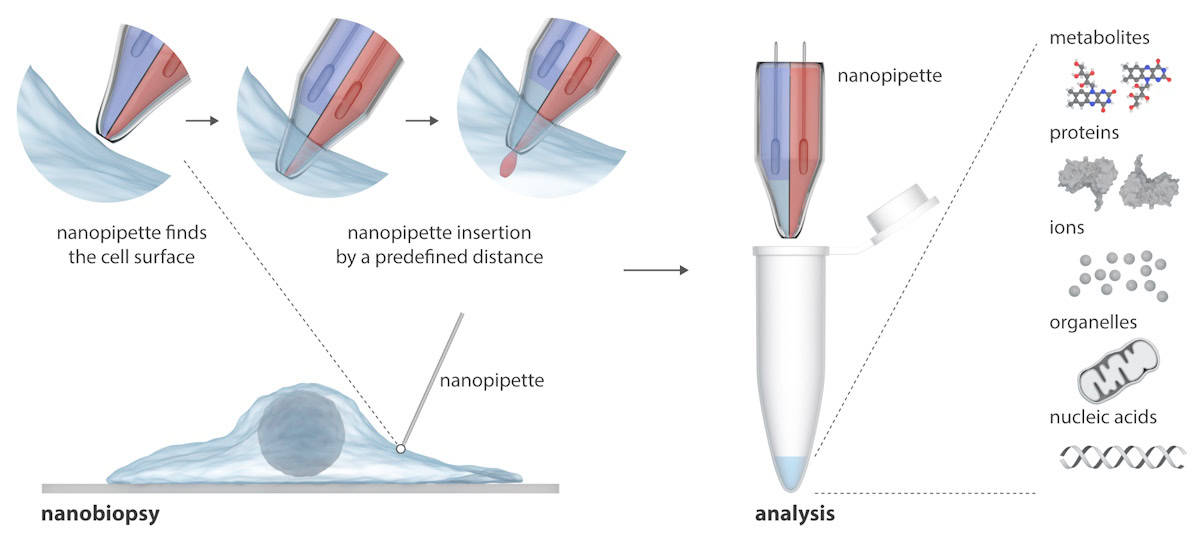
Нанопипетка состоит из двух наноскопических игл, которые могут одновременно вводить экзогенные молекулы в клетку и извлекать образцы цитоплазмы из клетки. Нанопипетка интегрирована в сканирующий микроскоп ионной проводимости (SICM) для выполнения нанобиопсии живых клеток в культуре. В отличие от существующих методов изучения одиночных клеток, которые обычно разрушают клетку, нанопипетка может брать повторные биопсии живой клетки, не убивая ее, что позволяет проводить продольные исследования поведения отдельной клетки с течением времени.
Запись в Наука развиваетсяИсследователи объясняют, что SICM работает путем измерения ионного тока между электродом, вставленным в стеклянную нанопипетку, и электродом сравнения, погруженным в электролитический раствор, содержащий клетки. Нанобиопсия выполняется, когда ионный ток протекает через нанопору на кончике нанопипетки после подачи напряжения между двумя электродами. В их двухцилиндровой нанопипетке один из них действует как электрохимический шприц для экстракции цитоплазмы; второй содержит водный раствор электролита, который обеспечивает стабильный ионный ток для точного позиционирования и наноинъекции перед нанобиопсией.
Полуавтоматическая платформа позволяет извлекать фемтолитровые объемы цитоплазмы и одновременно инъецировать ее в отдельные клетки. Платформа обеспечивает автоматическое позиционирование нанопипетки с помощью управления по принципу обратной связи (ионный ток падает, когда нанопипетка приближается к образцу), а обнаружение определенных токовых сигнатур указывает на успешное проникновение через мембрану отдельной клетки.
Продольные исследования
В качестве доказательства возможностей платформы исследователи провели продольную нанобиопсию клетки GBM (и ее потомства), профилируя изменения экспрессии генов в течение 72 часов. Они проводили нанобиопсию до терапии, во время лечения лучевой терапией и химиотерапией, а также после лечения.
«Наш метод надежен и воспроизводим, он позволяет проникать через мембраны и осуществлять наноинъекции в клетки разных типов с разными механическими свойствами», — пишут соруководители исследователей. Люси Стед и Паоло Актис. «Средний показатель успеха наноинъекций составляет 0.89 ± 0.07. Затем извлекается внутриклеточная мРНК».
Исследователи исследовали реакцию клеток GBM на стандартное лечение 2 Гр радиации и 30 мкМ темозоломида. Они визуально отслеживали отдельные клетки и их потомство в течение 72 часов, при этом 98% из них оставались в поле зрения микроскопа в течение этого периода времени, что является важным фактором при проведении продольного анализа.

В первый день исследователи провели биопсию, ввели флуоресцентный краситель и визуализировали каждую клетку. На второй день половина клеток получила облучение и химиотерапию, а остальные служили контролем. Все клетки визуализировали на 1-й и 2-й день, а на 2-й день проводили биопсию и снова вводили.
В клетках, подвергшихся нанобиопсии в первый день, выживаемость обработанных и необработанных клеток была одинаковой, а скорость деления клеток была сопоставима в двух группах. Через 1 часа выжило 72% необработанных контрольных (не биопсированных) клеток по сравнению с 63% обработанных биопсийных клеток. Не было различий в последующих показателях смертности подтипов клеток в первый день, независимо от лечения. Однако гораздо большая часть необработанных клеток со временем сменила подтип или произвела потомство с другим подтипом, чем обработанные клетки.
«Это говорит о том, что необработанные клетки в течение трех дней становятся значительно более пластичными, чем обработанные», — пишут исследователи. «Оценки клеточного фенотипа парных образцов в первый день и продольных образцов показали, что обработанные клетки имеют тенденцию сохранять тот же фенотип во время терапии, в то время как необработанные клетки с большей вероятностью переключают состояние транскрипции в течение 1 часов, что позволяет предположить, что лечение либо индуцирует, либо отбирает высокую стабильность транскрипции. в этой устоявшейся клеточной линии GBM».
«Это значительный прорыв», — говорит Стед. «Впервые у нас есть технология, позволяющая реально отслеживать изменения, происходящие после лечения, а не просто предполагать их. Этот тип технологии обеспечит уровень понимания, которого у нас просто никогда раньше не было. И это новое понимание и понимание приведут к появлению в нашем арсенале нового оружия против всех видов рака».
Механическая нанохирургия атакует агрессивный рак мозга
Команда убеждена, что способность этих универсальных нанозондов получать доступ к внутриклеточной среде с минимальными нарушениями потенциально может «совершить революцию в молекулярной диагностике, генной и клеточной терапии».
«Наша будущая работа будет сосредоточена на увеличении пропускной способности технологии, чтобы можно было анализировать больше клеток», — говорит Актис. Мир физики. «Мы работаем над улучшением протоколов анализа РНК, извлеченной из клеток, чтобы можно было собрать больше биологической информации. Мы также очень заинтересованы в изучении более продвинутых биологических моделей рака мозга, основанных на клетках и органоидах, полученных от пациентов».
- SEO-контент и PR-распределение. Получите усиление сегодня.
- PlatoData.Network Вертикальный генеративный ИИ. Расширьте возможности себя. Доступ здесь.
- ПлатонАйСтрим. Интеллект Web3. Расширение знаний. Доступ здесь.
- ПлатонЭСГ. Углерод, чистые технологии, Энергия, Окружающая среда, Солнечная, Управление отходами. Доступ здесь.
- ПлатонЗдоровье. Биотехнологии и клинические исследования. Доступ здесь.
- Источник: https://physicsworld.com/a/single-cell-nanobiopsy-explores-how-brain-cancer-cells-adapt-to-resist-treatment/



