(Wiadomości NanowerkNaukowcy od dawna poszukiwali wszechstronnych narzędzi umożliwiających precyzyjną manipulację i identyfikację DNA i innych nanocząstek biologicznych. Pęsety optyczne, które wykorzystują lasery do wychwytywania małych cząstek, zapewniają kontrolę bezdotykową, ale brakuje im możliwości rozpoznawania określonych sekwencji DNA.
Jednocześnie edycja genów CRISPR okazała się niezwykle czułą metodą wykrywania, ale wymaga udoskonalenia i integracji nanotechnologia. Teraz naukowcy z Uniwersytetu w Shenzhen i Chińskiego Uniwersytetu w Hongkongu połączyli CRISPR z pęsetą optotermiczną, tworząc innowację, która przezwycięża wcześniejsze ograniczenia.
W nowym badaniu opublikowanym w Światło: nauka i aplikacje („Optotermiczne nanotweezery zasilane CRISPR: różnorodne manipulacje bionanocząsteczkami i identyfikacja pojedynczych nukleotydów”) zespół przedstawia optotermiczne nanotweezery (CRONT) zasilane CRISPR – platformę umożliwiającą jednoczesne wychwytywanie i identyfikację DNA z dużą dokładnością. Ten przełom toruje drogę postępowi w badaniach przyłóżkowych, biosensorach i podstawowych badaniach z zakresu biofizyki.
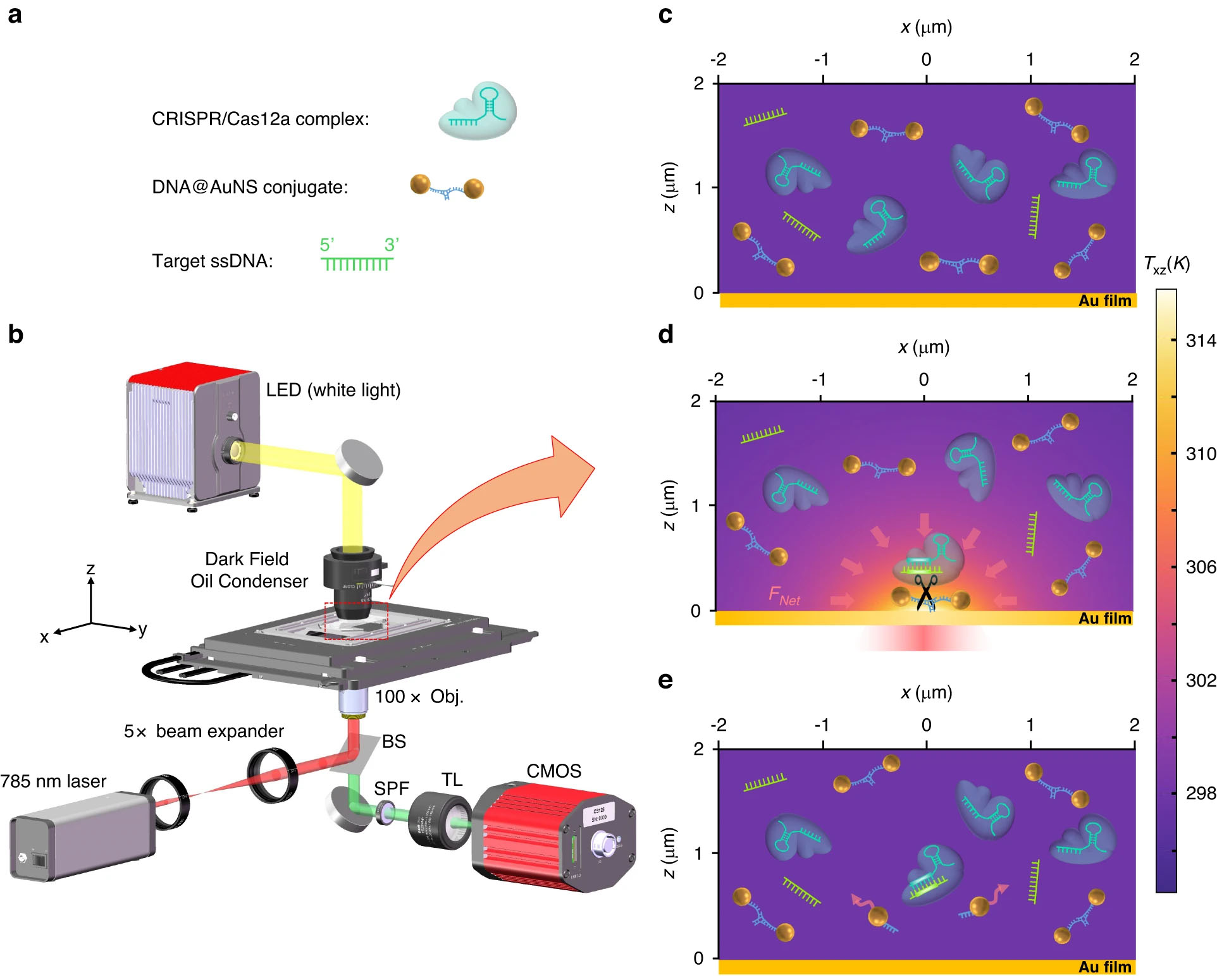 Zasada działania nanorurek optotermicznych zasilanych CRISPR. a Schematyczny szkic trzech składników roztworu: koniugat DNA@AuNS, kompleks CRISPR/Cas12a i docelowy ssDNA. b Układ optyczny, BS, SPF i TL to odpowiednio rozdzielacz wiązki, filtr krótkoprzepustowy i soczewka tubusowa (f=200 mm). Dodatkowe szczegóły konfiguracji podano w części Materiały i metody. c Dyspersja trzech składników w roztworze bez ogrzewania optycznego. d Optotermiczna siła netto (FNetto) indukowana migracja i rozszczepienie koniugatu DNA@AuNS po ogrzewaniu optycznym, moc ogrzewania lasera wynosi 0.5 mW. e Obserwacja rozszczepienia po wyłączeniu ogrzewania optycznego. (© Light: Science & Applications)
Pęseta optyczna stały się nieocenioną techniką od czasu ich wynalezienia w 1986 roku, zapewniając niezrównaną kontrolę czasoprzestrzenną nad mikroskopijnymi cząstkami. Opierają się jednak na przenoszeniu pędu ze ściśle skupionego lasera o dużej mocy, co ogranicza ilość materiałów, które mogą zostać uwięzione i stwarza ryzyko fotouszkodzeń w wyniku lokalnego ogrzewania.
Pęseta optotermiczna została wprowadzona 15 lat temu jako obiecująca alternatywa o znacznie niższej intensywności. Wykorzystują gradienty temperatury w mikroskali i przepływ płynu w pobliżu oświetlonej powierzchni pochłaniającej światło, aby manipulować cząstkami poprzez siły termodyfuzji i konwekcji. Jednak do tej pory zarówno tradycyjna pęseta optyczna, jak i techniki optotermiczne nie były w stanie bezpośrednio identyfikować cząstek biologicznych za pomocą sygnałów optycznych. Możliwość tę udało się osiągnąć jedynie dzięki uciążliwym metodom znakowania fluorescencyjnego.
Jednocześnie diagnostyka CRISPR stała się przełomowym podejściem do wykrywania sekwencji kwasów nukleinowych z niezwykłą specyficznością, aż do pojedynczych par zasad. Jednak przełożenie testów laboratoryjnych na urządzenia przyłóżkowe pozostaje wyzwaniem ze względu na konieczność obszernego przygotowania próbek i wymaganej amplifikacji obiektu docelowego. Zespół Shenzhen-CUHK zdał sobie sprawę z ogromnego potencjału połączenia wykrywania CRISPR z precyzyjną manipulacją pęsetą optotermiczną w jednej platformie.
System CRONT wykorzystuje cienką złotą warstwę do generowania podgrzewanych punktów nieco powyżej temperatury pokojowej po oświetleniu standardowym wskaźnikiem laserowym 785 nm. Tworzy to zlokalizowane prądy konwekcyjne i termodyfuzję, które mogą selektywnie uwięzić ponad 50 różnych sekwencji DNA i nanocząstki funkcjonalizowane DNA. Po uwięzieniu sekwencje identyfikuje się in situ poprzez wprowadzenie kompleksów CRISPR, które rozcinają docelowe nici DNA, co obserwuje się w czasie rzeczywistym, gdy wzór dyfrakcyjny poszczególnych nanocząstek złota zmienia się po fragmentacji. Ten pasywny odczyt optyczny pozwala uniknąć uciążliwych etapów znakowania fluorescencyjnego.
Co godne uwagi, wykorzystując te siły samoorganizacji i integrując sondy CRISPR z mikroskopijnymi przepływami indukowanymi termicznie, pęseta CRONT zwiększa stężenie i współczynniki interakcji, umożliwiając szybkie wykrywanie pojedynczego DNA. Zespół wykazał atomolarną czułość na sekwencję wirusa ospy małpiej – bez jakiejkolwiek amplifikacji celu. Stanowi to aż 10 miliardów-krotną poprawę w porównaniu z konwencjonalnymi testami CRISPR i odpowiada wydajności na poziomie PCR. Taka ultraczuła ocena ilościowa przy użyciu niedrogiego systemu pęsety laserowej mogłaby umożliwić badanie w miejscu opieki zdrowotnej.
Co równie istotne, pęsety CRONT ułatwiają rozpoznawanie polimorfizmów pojedynczych nukleotydów (SNP) – możliwość wcześniej ograniczona do drogich platform sekwencjonowania lub PCR. Otwiera to możliwości optycznego profilowania zmienności genetycznej i mutacji in situ w celu badania różnorodności biologicznej lub mechanizmów chorobowych. Walidacje eksperymentalne wykazały, że CRONT potrafi rozróżnić pojedyncze różnice zasad między wariantami SARS-CoV-2.
Oprócz kwasów nukleinowych badacze zademonstrowali programowalną manipulację białkami, otwierając intrygujące perspektywy badania interakcji białek wywołanych ciepłem. Zauważają także, że platformę można rozszerzyć na różnorodne materiały poprzez funkcjonalizację za pomocą różnych sond.
Choć nadal stanowią dowód koncepcji, łącząc zalety testów CRISPR i manipulacji optotermicznej, pęseta CRONT pokonuje kluczowe bariery hamujące niezależnie obie technologie. Zespół uważa, że oznacza to ważny krok w kierunku bioczujników przyłóżkowych, badań przesiewowych w kierunku chorób, zdalnej manipulacji komórkami i integracji nanofotonika z programowalnymi interakcjami biologicznymi. Planują dalsze zwiększanie wydajności, aby przyspieszyć badania i wykrywanie w zakresie genomiki, epigenetyki i diagnostyki.
Jeśli w miarę rozwoju technologii uda się utrzymać czułość i prostotę, pęsety optotermiczne zasilane CRISPR mogą stać się wszechobecnym narzędziem do analiz laboratoryjnych i klinicznych, wprowadzając zaawansowaną nanotechnologię do biomedycyny w świecie rzeczywistym.
Zasada działania nanorurek optotermicznych zasilanych CRISPR. a Schematyczny szkic trzech składników roztworu: koniugat DNA@AuNS, kompleks CRISPR/Cas12a i docelowy ssDNA. b Układ optyczny, BS, SPF i TL to odpowiednio rozdzielacz wiązki, filtr krótkoprzepustowy i soczewka tubusowa (f=200 mm). Dodatkowe szczegóły konfiguracji podano w części Materiały i metody. c Dyspersja trzech składników w roztworze bez ogrzewania optycznego. d Optotermiczna siła netto (FNetto) indukowana migracja i rozszczepienie koniugatu DNA@AuNS po ogrzewaniu optycznym, moc ogrzewania lasera wynosi 0.5 mW. e Obserwacja rozszczepienia po wyłączeniu ogrzewania optycznego. (© Light: Science & Applications)
Pęseta optyczna stały się nieocenioną techniką od czasu ich wynalezienia w 1986 roku, zapewniając niezrównaną kontrolę czasoprzestrzenną nad mikroskopijnymi cząstkami. Opierają się jednak na przenoszeniu pędu ze ściśle skupionego lasera o dużej mocy, co ogranicza ilość materiałów, które mogą zostać uwięzione i stwarza ryzyko fotouszkodzeń w wyniku lokalnego ogrzewania.
Pęseta optotermiczna została wprowadzona 15 lat temu jako obiecująca alternatywa o znacznie niższej intensywności. Wykorzystują gradienty temperatury w mikroskali i przepływ płynu w pobliżu oświetlonej powierzchni pochłaniającej światło, aby manipulować cząstkami poprzez siły termodyfuzji i konwekcji. Jednak do tej pory zarówno tradycyjna pęseta optyczna, jak i techniki optotermiczne nie były w stanie bezpośrednio identyfikować cząstek biologicznych za pomocą sygnałów optycznych. Możliwość tę udało się osiągnąć jedynie dzięki uciążliwym metodom znakowania fluorescencyjnego.
Jednocześnie diagnostyka CRISPR stała się przełomowym podejściem do wykrywania sekwencji kwasów nukleinowych z niezwykłą specyficznością, aż do pojedynczych par zasad. Jednak przełożenie testów laboratoryjnych na urządzenia przyłóżkowe pozostaje wyzwaniem ze względu na konieczność obszernego przygotowania próbek i wymaganej amplifikacji obiektu docelowego. Zespół Shenzhen-CUHK zdał sobie sprawę z ogromnego potencjału połączenia wykrywania CRISPR z precyzyjną manipulacją pęsetą optotermiczną w jednej platformie.
System CRONT wykorzystuje cienką złotą warstwę do generowania podgrzewanych punktów nieco powyżej temperatury pokojowej po oświetleniu standardowym wskaźnikiem laserowym 785 nm. Tworzy to zlokalizowane prądy konwekcyjne i termodyfuzję, które mogą selektywnie uwięzić ponad 50 różnych sekwencji DNA i nanocząstki funkcjonalizowane DNA. Po uwięzieniu sekwencje identyfikuje się in situ poprzez wprowadzenie kompleksów CRISPR, które rozcinają docelowe nici DNA, co obserwuje się w czasie rzeczywistym, gdy wzór dyfrakcyjny poszczególnych nanocząstek złota zmienia się po fragmentacji. Ten pasywny odczyt optyczny pozwala uniknąć uciążliwych etapów znakowania fluorescencyjnego.
Co godne uwagi, wykorzystując te siły samoorganizacji i integrując sondy CRISPR z mikroskopijnymi przepływami indukowanymi termicznie, pęseta CRONT zwiększa stężenie i współczynniki interakcji, umożliwiając szybkie wykrywanie pojedynczego DNA. Zespół wykazał atomolarną czułość na sekwencję wirusa ospy małpiej – bez jakiejkolwiek amplifikacji celu. Stanowi to aż 10 miliardów-krotną poprawę w porównaniu z konwencjonalnymi testami CRISPR i odpowiada wydajności na poziomie PCR. Taka ultraczuła ocena ilościowa przy użyciu niedrogiego systemu pęsety laserowej mogłaby umożliwić badanie w miejscu opieki zdrowotnej.
Co równie istotne, pęsety CRONT ułatwiają rozpoznawanie polimorfizmów pojedynczych nukleotydów (SNP) – możliwość wcześniej ograniczona do drogich platform sekwencjonowania lub PCR. Otwiera to możliwości optycznego profilowania zmienności genetycznej i mutacji in situ w celu badania różnorodności biologicznej lub mechanizmów chorobowych. Walidacje eksperymentalne wykazały, że CRONT potrafi rozróżnić pojedyncze różnice zasad między wariantami SARS-CoV-2.
Oprócz kwasów nukleinowych badacze zademonstrowali programowalną manipulację białkami, otwierając intrygujące perspektywy badania interakcji białek wywołanych ciepłem. Zauważają także, że platformę można rozszerzyć na różnorodne materiały poprzez funkcjonalizację za pomocą różnych sond.
Choć nadal stanowią dowód koncepcji, łącząc zalety testów CRISPR i manipulacji optotermicznej, pęseta CRONT pokonuje kluczowe bariery hamujące niezależnie obie technologie. Zespół uważa, że oznacza to ważny krok w kierunku bioczujników przyłóżkowych, badań przesiewowych w kierunku chorób, zdalnej manipulacji komórkami i integracji nanofotonika z programowalnymi interakcjami biologicznymi. Planują dalsze zwiększanie wydajności, aby przyspieszyć badania i wykrywanie w zakresie genomiki, epigenetyki i diagnostyki.
Jeśli w miarę rozwoju technologii uda się utrzymać czułość i prostotę, pęsety optotermiczne zasilane CRISPR mogą stać się wszechobecnym narzędziem do analiz laboratoryjnych i klinicznych, wprowadzając zaawansowaną nanotechnologię do biomedycyny w świecie rzeczywistym.
- Dystrybucja treści i PR oparta na SEO. Uzyskaj wzmocnienie już dziś.
- PlatoData.Network Pionowe generatywne AI. Wzmocnij się. Dostęp tutaj.
- PlatoAiStream. Inteligencja Web3. Wiedza wzmocniona. Dostęp tutaj.
- PlatonESG. Węgiel Czysta technologia, Energia, Środowisko, Słoneczny, Gospodarowanie odpadami. Dostęp tutaj.
- Platon Zdrowie. Inteligencja w zakresie biotechnologii i badań klinicznych. Dostęp tutaj.
- Źródło: https://www.nanowerk.com/nanotechnology-news2/newsid=64221.php



