גליובלסטומה (GBM) היא הצורה הקטלנית והאגרסיבית ביותר של סרטן המוח. כמעט כל הגידולים חוזרים על עצמם לאחר הטיפול, כאשר תאים שורדים הופכים לצורות גמישות יותר לאורך זמן כדי להתנגד לטיפולים נוספים. כדי להתמודד עם אתגר זה, מדענים ב- אוניברסיטת לידס עיצבו ננו-פיפטה חדשה עם קנה כפול והשתמשו בה כדי לחקור את המסלולים של תאי GBM חיים בודדים כשהם משתנים בתגובה לטיפול.
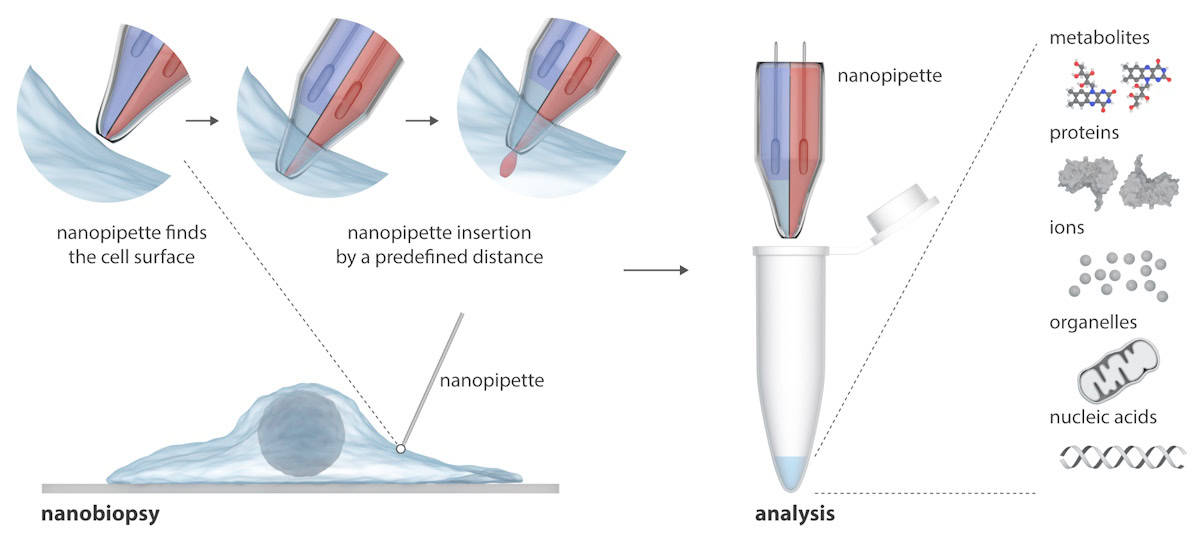
הננו-פיפטה מורכבת משתי מחטים ננוסקופיות שיכולות להזריק בו-זמנית מולקולות אקסוגניות לתא ולחלץ דגימות ציטופלזמה מתא. הננו-פיפטה משולבת במיקרוסקופ מוליכות יונים סורק (SICM) לביצוע ננו-ביופסיות של תאים חיים בתרבית. בניגוד לטכניקות קיימות לחקר תאים בודדים, שבדרך כלל הורסים את התא, הננו-פיפטה יכולה לקחת ביופסיות חוזרות ונשנות של תא חי מבלי להרוג אותו, מה שמאפשר מחקר אורך של התנהגות תא בודד לאורך זמן.
כותב ב התקדמות מדע, מסבירים החוקרים כי SICM פועלת על ידי מדידת זרם היונים בין אלקטרודה המוכנסת בננו-פיפטה מזכוכית לבין אלקטרודת ייחוס הטבולה בתמיסה אלקטרוליטית המכילה את התאים. ננוביופסיה מבוצעת כאשר זרם יונים זורם דרך הננופורה בקצה הננו-פיפטה לאחר הפעלת מתח בין שתי האלקטרודות. בננו-פיפטה הכפולה שלהם, חבית אחת פועלת כמזרק אלקטרוכימי לביצוע עקירות ציטופלזמיות; השני מכיל תמיסת אלקטרוליט מימית המספקת זרם יונים יציב למיקום מדויק ולהזרקת ננו לפני ננו-ביופסיה.
הפלטפורמה האוטומטית למחצה מאפשרת מיצוי של נפחי פמטוליטר של ציטופלזמה והזרקה בו-זמנית לתאים בודדים. הפלטפורמה מספקת מיקום אוטומטי של הננו-פיפטה באמצעות בקרת משוב (זרם היונים יורד כאשר הננו-פיפטה מתקרבת לדגימה), בעוד שזיהוי של חתימות זרם מסוימות מעיד על חדירת ממברנה מוצלחת של תא בודד.
מחקרי אורך
כהוכחה ליכולת הפלטפורמה, החוקרים ערכו ננו-ביופסיה אורכית של תא GBM (וצאצאיו), תוך פרופיל של שינויים בביטוי הגנים במשך 72 שעות. הם ביצעו ננוביופסיה לפני הטיפול, במהלך הטיפול בהקרנות וכימותרפיה ולאחר הטיפול.
"השיטה שלנו חזקה וניתנת לשחזור, מאפשרת חדירת ממברנה והזרקת ננו על פני סוגי תאים שונים עם תכונות מכניות מובהקות", כותבים חוקרים ראשיים. לוסי סטד ו פאולו אקטיס. "שיעור ההצלחה הממוצע של הזרקת ננו הוא 0.89 ± 0.07. לאחר מכן מופק mRNA תוך תאי."
החוקרים חקרו את התגובה של תאי GBM לטיפול הסטנדרטי של 2 Gy של קרינה ו-30 µM של temozolomide. הם עקבו ויזואלית אחר תאים בודדים וצאצאיהם במשך 72 שעות, כאשר 98% נותרו בשדה הראייה של המיקרוסקופ במהלך זמן זה - גורם חשוב בשאיפה לבצע ניתוח אורך.

ביום הראשון, החוקרים ביצעו ביופסיה, הזריקו צבע פלואורסצנטי וצילמו כל תא. ביום השני, מחצית מהתאים קיבלו הקרנה וכימותרפיה, בעוד האחרים שימשו כביקורת. כל התאים צולמו ביום 1 ו-2, ובוצעו ביופסיה והוזרקו שוב ביום 2.
בתאים שעברו ננו-ביופסיות ביום 1, ההישרדות הייתה דומה בין תאים מטופלים ולא מטופלים, ושיעורי חלוקת התאים היו דומים בשתי הקבוצות. לאחר 72 שעות, 63% מתאי הביקורת שלא טופלו (לא ביופסיה) שרדו, לעומת 25% מהתאים שעברו ביופסיה שטופלו. לא היה הבדל בשיעורי התמותה הבאים של תת-סוגי תאים ביום 1, ללא קשר לטיפול. עם זאת, חלק גדול בהרבה של תאים לא מטופלים החליף תת-סוג עם הזמן, או יצר צאצאים עם תת-סוג שונה, מאשר התאים המטופלים.
"זה מצביע על כך שתאים לא מטופלים הם משמעותית יותר פלסטיים במהלך שלושת הימים מאשר תאים מטופלים", כותבים החוקרים. "ציוני הפנוטיפ של התאים של דגימות יום 1 ואורך צמד גילו שתאים מטופלים נוטים לשמור על אותו פנוטיפ במהלך הטיפול, בעוד שתאים לא מטופלים נוטים יותר להחליף מצב שעתוק במשך 72 שעות, מה שמצביע על כך שהטיפול גורם או בוחר ביציבות תעתיק גבוהה בקו התאים המבוסס הזה של GBM."
"זוהי פריצת דרך משמעותית", אומר סטד. "זו הפעם הראשונה שיש לנו טכנולוגיה שבה אנו יכולים למעשה לנטר את השינויים המתרחשים לאחר הטיפול, במקום רק להניח אותם. סוג זה של טכנולוגיה הולך לספק רובד של הבנה שפשוט לא הייתה לנו קודם לכן. ואותה הבנה ותובנה חדשה יובילו לנשק חדש בנשקייה שלנו נגד כל סוגי הסרטן".
ננו-כירורגיה מכנית תוקפת סרטן מוח אגרסיבי
הצוות משוכנע שהיכולת של ננו-גשושיות מגוונות אלה לגשת לסביבה התוך-תאית עם הפרעה מינימלית טומנת בחובה פוטנציאל "לחולל מהפכה באבחון מולקולרי, בטיפולי גנים ותאים".
"העבודה העתידית שלנו תתמקד בהגדלת התפוקה של הטכנולוגיה כך שניתן יהיה לנתח יותר תאים", אומר אקטיס עולם הפיזיקה. "אנו פועלים לשיפור הפרוטוקולים לניתוח ה-RNA המופק מתאי כך שניתן יהיה לאסוף מידע ביולוגי נוסף. אנחנו גם מאוד להוטים לחקור מודלים ביולוגיים מתקדמים יותר של סרטן המוח המבוססים על תאים ואורגנואידים שמקורם במטופל".
- הפצת תוכן ויחסי ציבור מופעל על ידי SEO. קבל הגברה היום.
- PlatoData.Network Vertical Generative Ai. העצים את עצמך. גישה כאן.
- PlatoAiStream. Web3 Intelligence. הידע מוגבר. גישה כאן.
- PlatoESG. פחמן, קלינטק, אנרגיה, סביבה, שמש, ניהול פסולת. גישה כאן.
- PlatoHealth. מודיעין ביוטכנולוגיה וניסויים קליניים. גישה כאן.
- מקור: https://physicsworld.com/a/single-cell-nanobiopsy-explores-how-brain-cancer-cells-adapt-to-resist-treatment/



