L'utilizzo del nuovo modello eSTAR della FDA richiede inoltre un nuovo processo per la gestione del progetto eSTAR per preparare le richieste 510k e De Novo.
Schema di dieci (10) modifiche principali derivanti dal nuovo modello eSTAR della FDA
A partire dal 1 ottobre 2023, tutti 510k ed Proposte di De Novo alla FDA ora richiedono l'utilizzo del nuovo modello FDA eSTAR e il modello deve essere caricato sul file Portale di collaborazione con i clienti della FDA (CCP). Ieri la FDA ha pubblicato una guida aggiornata che spiega i requisiti di invio elettronico 510k, ma ci sono dieci (10) importanti modifiche al processo di invio della Medical Device Academy derivanti dai nuovi modelli eSTAR:
- Non abbiamo più bisogno di un sommario.
- Non utilizziamo più la struttura del volume e del documento.
- Non siamo più tenuti a conformarci al sezionamento o all'impaginazione dell'intero contributo.
- Non ci preoccupiamo più dello screening o della checklist RTA (non esiste).
- Non ci preoccupiamo più di creare un riepilogo esecutivo (è facoltativo).
- Non abbiamo più una sezione per i dispositivi di Classe 3, perché non esistono più dispositivi di Classe 3 510(k).
- Non utilizziamo più il modulo FDA 3514 perché tale contenuto è ora incorporato nell'eSTAR.
- Non creiamo più una Dichiarazione di Conformità, perché eSTAR ne crea una automaticamente.
- Non consigliamo più di creare un riepilogo 510(k), perché eSTAR ne crea uno automaticamente
- Non utilizziamo più FedEx, perché possiamo invece caricare elettronicamente su FDA CCP.
Cosa c'è di diverso nei requisiti 510k?
Nonostante tutti i cambiamenti percepiti nel processo di notifica pre-commercializzazione della FDA (ovvero il processo 510k), i requisiti di formato e contenuto non sono cambiati molto. La modifica recente più significativa apportata al processo 510k è stata l'obbligo di inclusione test di sicurezza informatica.
Cenni sulla gestione dei progetti eSTAR
C'erano 20 sezioni in una presentazione da 510. Il team di consulenti di Medical Device Academy ha creato un modello per i documenti da includere in ciascuna sezione. La gestione del progetto eSTAR è diversa perché non ci sono numeri di sezione a cui fare riferimento. Per mantenere le cose chiare, ti consigliamo di utilizzare una o due parole all'inizio di ciascun nome di file per definire la sezione a cui appartiene. Le parole dovrebbero corrispondere ai segnalibri utilizzati dalla FDA. Tuttavia, dovresti fare attenzione a non rendere i nomi dei file troppo lunghi. Di seguito l'elenco di tutte le sezioni:
- Informazioni amministrative;
- Descrizione del dispositivo;
- Predicati ed equivalenze sostanziali;
- Benefici, rischi e misure di mitigazione;
- Etichettatura;
- Ricondizionamento, sterilità e durata di conservazione;
- Biocompatibilità;
- Software/firmware e sicurezza informatica/interoperabilità
- Software;
- EMC, sicurezza wireless, elettrica, meccanica e termica;
- Test delle prestazioni;
- Gestione della qualità; E
- Documentazione amministrativa.
La sezione Vantaggi, rischi e misure di mitigazione si applica solo alle richieste di classificazione De Novo. La sezione Gestione della qualità comprende sottosezioni relative alle informazioni sul sistema di gestione della qualità, alle informazioni sulla struttura, agli studi post-commercializzazione e ai riferimenti. Tuttavia, solo la sottosezione Riferimenti sarà visibile nella maggior parte degli invii poiché le altre tre sottosezioni fanno parte del progetto pilota eSTAR di Health Canada. Altre sezioni e sottosezioni verranno abbreviate o nascoste a seconda delle selezioni del menu a discesa selezionate in eSTAR. Ad esempio, la sezione relativa alla sicurezza informatica rimarrà nascosta se il tuo dispositivo non dispone di funzionalità wireless o di un'unità di archiviazione rimovibile.
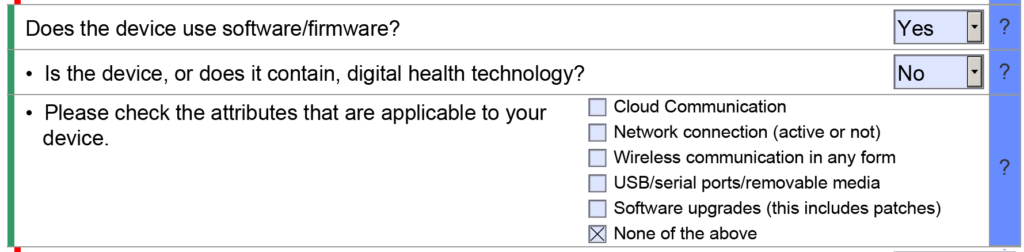
Un sommario non è più richiesto per gli invii di 510
Gli invii da 510 che utilizzavano il formato FDA eCopy richiedevano un sommario e la Medical Device Academy ha utilizzato il sommario come strumento di gestione del progetto. A volte utilizziamo ancora il nostro modello di sommario per comunicare i compiti e gestire il progetto 510k. Anche le sezioni del sommario sarebbero codificate a colori green, blu, gialloe rosso per comunicare lo stato di ogni sezione. La gestione del progetto FDA eSTAR utilizza un processo di codifica a colori simile con barre colorate sul lato del modello per indicare se la sezione è incompleta, completa o facoltativa.

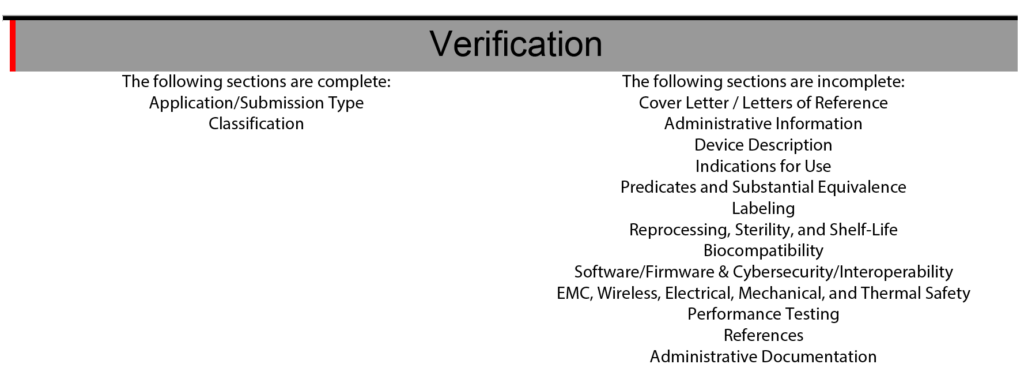
eSTAR dispone anche di una sezione di verifica alla fine del modello per facilitare la gestione del progetto eSTAR. La sezione di verifica elenca ciascuna delle 13 sezioni principali di un FDA eSTAR. Una volta completate le sezioni, il nome della sezione si sposta automaticamente dal lato destro della sezione di verifica al lato sinistro. Durante gli ultimi due anni (2021 – 2023) di implementazione del modello eSTAR, ho lentamente imparato a fare affidamento solo su eSTAR per comunicare lo stato di ciascuna sezione. Per assegnare le responsabilità per ciascuna sezione della presentazione 510k, utilizziamo ancora semplici elenchi del sommario e strumenti di gestione del progetto come Asana. L'utilizzo della sezione di verifica eSTAR per verificare lo stato di ciascuna sezione 510k aumenta anche la competenza del nostro team con eSTAR ogni volta che lo utilizziamo.
Utilizzo di Dropbox per la gestione dei progetti eSTAR
I modelli PreSTAR per una riunione Q-Sub sono lunghi circa la metà (ovvero 15 pagine anziché più di 30 pagine) di un modello eSTAR e l'invio di 510k richiede molti più allegati di un Q-Sub. Pertanto, di solito possiamo inviare via e-mail una bozza rivista del PreSTAR a un membro del team per la revisione, ma non possiamo utilizzare la posta elettronica per condividere un eSTAR quasi completo con un membro del team. Pertanto, Medical Device Academy utilizza dropbox condividere le revisioni di eSTAR tra i membri del team. Alcuni dei nostri clienti utilizzano One Drive o Google Drive per condividere le revisioni. Creiamo anche sottocartelle per ogni tipo di test. Ciò conserva tutti i documenti e i rapporti di prova per una sezione dell'eSTAR in un unico posto. Ad esempio, la documentazione di convalida del software sarà organizzata in una sottocartella della cartella Dropbox per un progetto da 510k.
Quando utilizzavamo FDA eCopies invece del modello FDA eSTAR, abbiamo utilizzato venti sottocartelle etichettate e organizzate in base ai numeri di volume da 1 a 20. Alcune di queste 20 sezioni sono ormai obsolete (ad esempio, Riepilogo della Classe III), mentre altre (ad esempio, Indicazioni per l'uso) sono integrate direttamente nel modello eSTAR. Pertanto, un team potrebbe aver bisogno solo di 8-10 sottocartelle per organizzare i documenti e i rapporti di test per un progetto da 510. Solitamente non alleghiamo questi documenti e rapporti di prova fino alla fine della preparazione della presentazione perché se la FDA rilascia una nuova versione di eSTAR, gli allegati non verranno esportati da una versione precedente di eSTAR alla nuova versione.
Il coordinamento della collaborazione del team è fondamentale per il successo della gestione del progetto eSTAR
In passato, la Medical Device Academy utilizzava sempre una struttura di volumi e documenti per organizzare un eCopy della FDA perché ciò facilitava il lavoro simultaneo di più membri del team sulla stessa richiesta di 510, anche da paesi diversi. Molti clienti utilizzeranno SharePoint o Google Docs per facilitare la collaborazione simultanea da parte di più utenti. Sfortunatamente, l'eSTAR non può essere modificato da due utenti contemporaneamente perché è un modello sicuro che può essere modificato solo in Adobe Acrobat Pro. Pertanto, il team deve comunicare quando il modello eSTAR viene aggiornato e tenere traccia delle revisioni. Per la comunicazione utilizziamo una combinazione di app di messaggistica istantanea (ad esempio Slack o Whatsapp) ed e-mail, mentre le revisioni vengono tracciate aggiungendo le iniziali e la data dell'editor al nome del file (ad esempio, nIVD 4.3 rvp 12-5-2023. PDF).
Importanza delle revisioni tra pari
Ciascuna sezione di FDA eSTAR deve essere completata prima che la presentazione possa essere caricata sul Customer Collaboration Portal (CCP). Se l’eSTAR della FDA è incompleto, il CCP identificherà il file come incompleto. Non sarai in grado di caricare il file. Se si risponde in modo errato alle domande nell'eSTAR, le sezioni che dovrebbero essere completate potrebbero non essere attivate a causa del modo in cui è stata data risposta alle domande. Di seguito sono riportati due esempi di come è possibile rispondere in modo errato alle domande eSTAR.
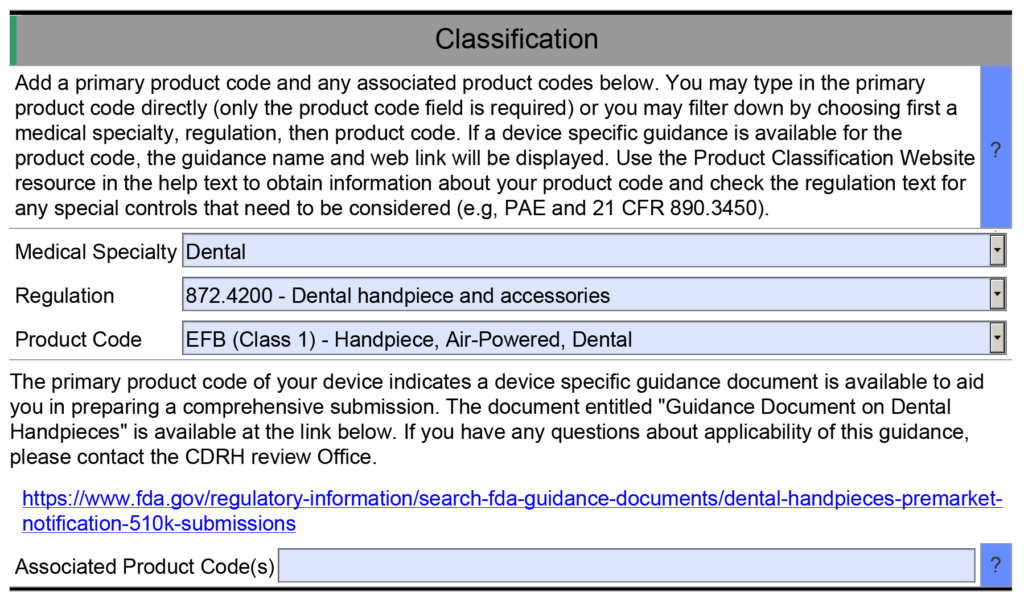
- Esempio 1 – Una delle utili funzionalità delle risorse di FDA eSTAR è che molti campi sono popolati con un menu a discesa di risposte. Un esempio si trova nella sezione Classificazione di eSTAR. Questa sezione richiede al richiedente di identificare la classificazione del dispositivo rispondendo a tre domande: 1) pannello di revisione, 2) regolamento di classificazione e 3) codice prodotto di tre lettere. Ciascuno di questi campi utilizza un menu a discesa per compilare il campo e le opzioni a discesa per le domande due e tre dipendono dalle risposte alla domanda precedente. Tuttavia, se digiti manualmente il codice prodotto nel campo della terza domanda, eSTAR non identificherà alcun documento guida sui controlli speciali applicabili per il tuo dispositivo. A meno che tu non sia già a conoscenza di un documento guida sui controlli speciali applicabile, risponderai alle domande nell'eSTAR sui controlli speciali con "N/A". L'eSTAR identificherà un documento guida sui controlli speciali per il tuo dispositivo solo se selezioni un codice prodotto dal menu a discesa, ma il revisore della FDA sa quali documenti guida sui controlli speciali sono applicabili. Questo è il motivo per cui la FDA esegue uno screening tecnico dell'eSTAR prima che inizi la revisione sostanziale.
- Esempio 2 – Se indichi la durata cumulativa del contatto per un dispositivo che comunica esternamente < 24 ore, il modello eSTAR prevede che tu valuti i seguenti endpoint di biocompatibilità: citotossicità, sensibilizzazione, irritazione, tossicità sistemica e pirogenicità.
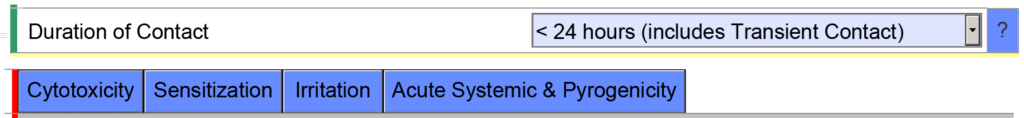
Tuttavia, se indichi che la durata cumulativa del contatto è < 30 giorni, il modello eSTAR verrà popolato con ulteriori endpoint di biocompatibilità. L'eSTAR non sa quale sia la durata cumulativa di utilizzo, ma lo sa il revisore della FDA. Questo è il motivo per cui la FDA esegue uno screening tecnico dell'eSTAR prima che inizi la revisione sostanziale.

Per assicurarti che tutte le sezioni del tuo invio siano complete, è utile che una seconda persona esamini tutte le risposte per assicurarsi che tutto sia stato completato correttamente. Anche i consulenti esperti che preparano 510 invii ogni settimana possono commettere un errore e rispondere erroneamente a una domanda in uno dei campi eSTAR. Pertanto, non dovresti saltare questo controllo di qualità critico.
Formazione aggiuntiva da 510k
Il libro 510k, “Come preparare i tuoi 510k in 100 giorni”, è stato completato nel 2017, ma il libro è disponibile solo come parte del nostro 510k corso serie composta da oltre 58 webinar. Si prega di visitare il pagina del webinar per acquistare singoli webinar.
- Distribuzione di contenuti basati su SEO e PR. Ricevi amplificazione oggi.
- PlatoData.Network Generativo verticale Ai. Potenzia te stesso. Accedi qui.
- PlatoAiStream. Intelligenza Web3. Conoscenza amplificata. Accedi qui.
- PlatoneESG. Carbonio, Tecnologia pulita, Energia, Ambiente, Solare, Gestione dei rifiuti. Accedi qui.
- Platone Salute. Intelligence sulle biotecnologie e sulle sperimentazioni cliniche. Accedi qui.
- Fonte: https://medicaldeviceacademy.com/estar-project-management/



