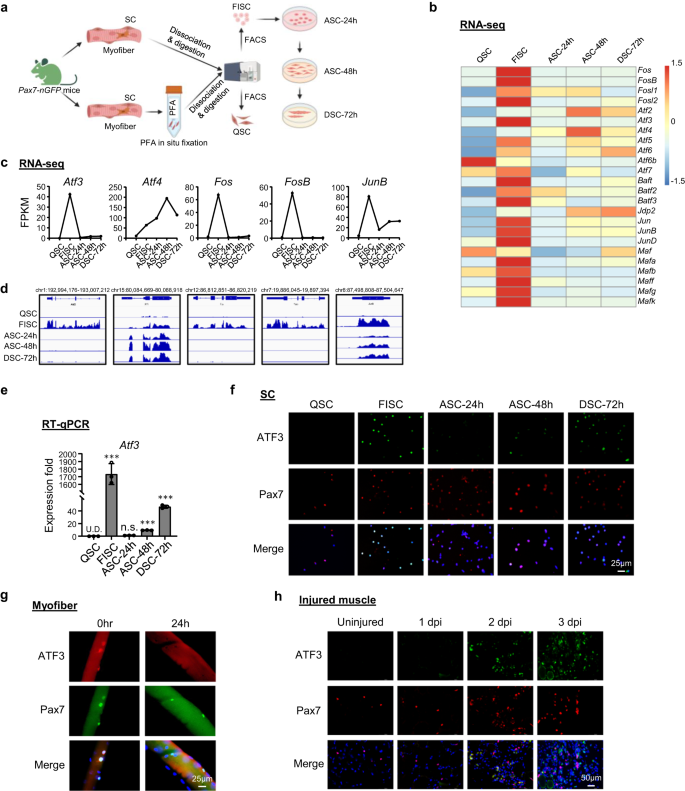
L'ATF3 est rapidement et transitoirement induit lors de l'activation précoce du SC
Pour explorer les événements régulateurs de la transcription régissant la transition de la quiescence à l'activation du SC, nous avons réanalysé nos ensembles de données de profilage transcriptomique publiés précédemment.36 acquis des SC dans la progression de la lignée. En bref, les muscles de Pax7-nGFP souris37 ont été fixés in situ par PFA avant d'être soumis au processus standard de dissociation et d'isolement cellulaire de 3 h et au tri FACS pour obtenir des QSC13, ou sans fixation préalable pour obtenir des CS d'activation précoce (FISC) fraîchement isolés (Fig. 1a et Fig supplémentaire. 1a); Les FISC ont été cultivées in vitro pendant 24, 48 ou 72 h pour obtenir des cellules entièrement activées (ASC-24h), en prolifération (ASC-48h) ou en différenciation (DSC-72h). Conformément aux conclusions d'autres rapports récents38,39,40, les gènes de la famille AP-1 dont Fos, Atf, Juin ainsi que maf les sous-familles ont été considérablement induites dans les FISC par rapport aux QSC (Fig. 1b). Notamment, Atf3 a été fortement induit (42.4 fois) dans les FISC mais a ensuite été rapidement diminué à ACS-24h (Fig. 1c, d); cela a également été confirmé par RT-qPCR (Fig. 1e), indiquant qu'il s'agit d'un gène réactif rapide et transitoire à l'activation précoce induite par l'isolement. De plus, la coloration par immunofluorescence (IF) a démontré l'induction concomitante de la protéine ATF3 dans les FISC et une diminution des ASC (Fig. 1f). Même sur la myofibre unique fraîchement isolée qui est censée préserver la niche quiescente dans une certaine mesure et minimiser l'activation du SC41,42, les SC associés présentaient un niveau d'expression élevé de la protéine ATF3 immédiatement après 2 h d'isolement qui diminuait à 24 h en culture (Fig. 1g), renforçant l'idée que l'ATF3 est rapidement induit dans les SC activés précocement. Pour confirmer davantage l'induction d'ATF3 in vivo, du BaCl2 a été injecté dans les muscles du jambier antérieur (TA) de souris C57BL/6 pour induire des lésions musculaires aiguës. Dans ce modèle de blessure36,43,44, une dégénérescence tissulaire avec d'abondants infiltrats de cellules immunitaires est normalement observée 1 jour après la blessure (dpi); Les SC sont rapidement activés pour se développer sous forme de myoblastes proliférants qui fusionnent ensuite pour former de nouvelles petites myofibres exprimant la chaîne lourde de la myosine embryonnaire (eMyHC) et caractérisées par des noyaux localisés au centre (CLN); ces fibres eMyHC + sont facilement visibles à 5 dpi. À 7 dpi, le muscle est principalement composé de myofibres régénérées plus grandes avec une expression eMyHC régulée à la baisse ; les dommages musculaires et les cellules inflammatoires sont en grande partie éliminés à 14 dpi tandis que les myofibres régénérées continuent de grossir et de mûrir pour atteindre une régénération complète autour de 30 dpi. Comme prévu, la protéine ATF3 n'a pas été détectée sur les muscles TA non blessés par IF mais facilement visible à 1dpi ; certaines colorations n'ont pas fusionné avec les cellules Pax7 +, ce qui est conforme à son induction omniprésente signalée dans plusieurs cellules après une blessure45. À 2dpi, l'expression d'ATF3 dans les cellules Pax7 + était fortement augmentée, parallèlement à l'activation complète des SC à ce stade (Fig. 1h). Plusieurs autres membres de la famille AP-1, Atf4, Fos, FosBet JuinB, partageaient un profil d'expression dynamique similaire (Fig. 1b-d), qui a également été confirmé par RT-qPCR (Fig. 1b) et coloration immunofluorescente (Fig. 1c) résultats. Pris ensemble, nos résultats montrent que l'ATF3 et plusieurs autres membres de la famille AP-1 sont induits rapidement et de manière transitoire lors de l'activation précoce du SC, suggérant leurs rôles potentiels dans la régulation de l'activation précoce du SC.
a Schéma d'isolement des cellules satellites quiescentes (QSC) après fixation in situ, des SC fraîchement isolées (FISC) sans fixation préalable des muscles de la Tg : Pax7-nGFP souris. Les FISC ont ensuite été cultivés et activés pendant 24 (ASC-24h), 48 (ASC-48h) ou 72 h (DSC-72h). Les ARN ont été extraits pour l'analyse RNA-Seq. Créé avec BioRender.com. b Cartes thermiques indiquant les niveaux d'expression génique (Log2 [FPKM]) des TF de la famille AP-1 détectés par l'ARN-Seq. c, d Niveaux d'expression (FPKM) et instantanés génomiques de Atf3, Atf4, Fos, FosB, JuinB Les ARNm de l'ARN-Seq ci-dessus. e Détection RT-qPCR de Atf3 dans les cellules ci-dessus. n = 3 souris par groupe. p = 0.000025, 0.12, 0.0000011 et 0.0000052. f Coloration par immunofluorescence (IF) des protéines ATF3 et Pax7 sur les cellules ci-dessus. Barre d'échelle : 50 μm. g Coloration IF des protéines ATF3 et Pax7 sur des myofibres simples de muscles EDL immédiatement après l'isolement ou cultivées pendant 24 h. Barre d'échelle : 25 μm. h Coloration IF des protéines ATF3 et Pax7 sur des coupes musculaires TA de souris non blessées ou 1, 2 et 3 dpi. Barre d'échelle : 50 μm. Tous les graphiques à barres sont présentés sous forme de moyenne ± SD. Étudiants t test (bilatéral non apparié) a été utilisé pour calculer la signification statistique (e) : *p < 0.05, **p < 0.01, ***p < 0.001. ns aucune signification. Les données source sont fournies sous la forme d'un fichier de données source.
À court terme Atf3 la suppression accélère la régénération musculaire induite par une blessure aiguë
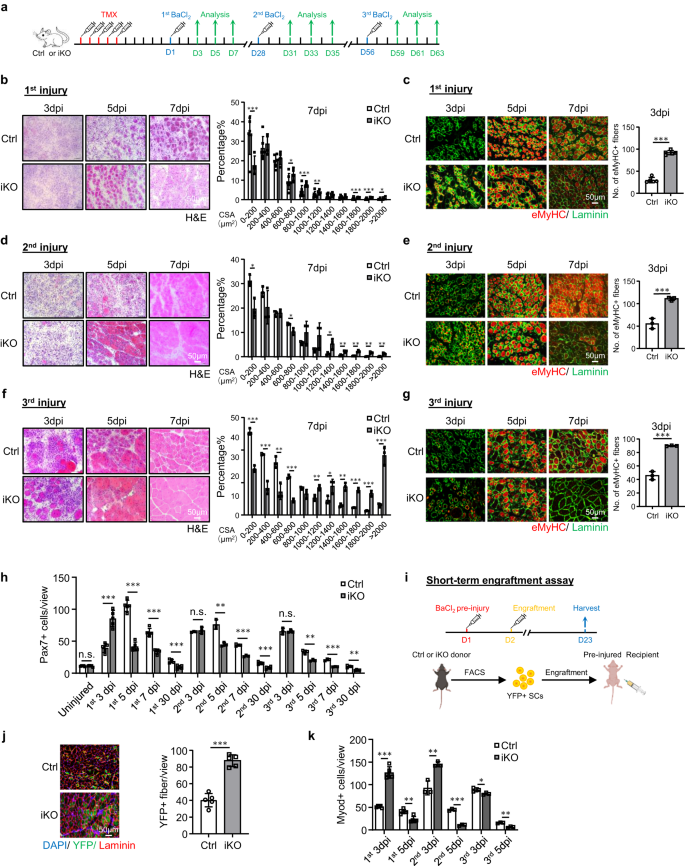
Pour faciliter la dissection de la fonction ATF3 dans les CS, nous avons traversé le Atf3flox allèle46, dans lequel deux sites LoxP ont été insérés sur Atf3 exon2, avec Pax7CreERT2/CreERT2-R26RYFP/YFP souris43 pour générer le contrôle (Ctrl) (Atf3+ / +– Pax7CreERT2/CreERT2-R26RYFP/YFP) et des souris knock-out inductibles de Atf3 (Atf3 iKO) (Atf3 flox/flox– Pax7CreERT2/CreERT2-R26RYFP/YFP) (Fig. 2a). Après 5 jours consécutifs d'injection intrapéritonéale (IP) de Tamoxifène (TMX) (Fig. 2a), la suppression réussie d'ATF3 dans les FISC a été confirmée par WB (Fig. 2b) ou IF (Fig. 2c); son épuisement a été confirmé par la coloration IF des SC sur des myofibres simples (Fig. 2d). Morphologiquement, l'iKO de 2 mois n'a montré aucune différence apparente par rapport aux souris de la même portée Ctrl ; aucun changement dans la taille et le poids du corps n'a été détecté non plus (Fig. 2e).
a Schéma de la conception expérimentale. b Coloration H & E des muscles TA collectés à 3, 5 et 7 jours après la blessure du 1er tour (dpi). Barre d'échelle : 50 μm. Les zones de section transversale (CSA) des fibres nouvellement formées ont été quantifiées à partir des muscles TA à 7 dpi. p = 0.000066, 0.018, 0.00069, 0.0087, 0.00082, 0.00047 et 0.046. c La coloration IF de eMyHC (rouge) et de Laminin (vert) a été réalisée sur les muscles TA ci-dessus. Barre d'échelle : 50 μm. p = 0.00000011. d, e Coloration H&E et eMyHC des muscles TA après la blessure du 2e tour. Barre d'échelle : 50 μm. p = 0.012, 0.019, 0.033, 0.0057, 0.0022, 0.0022 et 0.0093 (d); p = 0.00021 (e). f, g Coloration H&E et eMyHC des muscles TA après la blessure du 3e tour. Barre d'échelle : 50 μm. p = 0.00015, 0.00087, 0.0063, 0.000074, 0.0089, 0.035, 0.0014, 0.00011, 0.00042 et 0.00071 (f); p = 0.000023 (g). h Les SC Pax7+ par vue ont été quantifiés sur les muscles Ctrl et iKO TA sur des blessures ou après les 3 séries de blessures. p = 0.96, 0.00011, 0.0000013, 0.000014, 0.00066, 0.45, 0.0023, 0.00017, 0.00032, 0.95, 0.0022, 0.00019 et 0.0012. i Schéma du test de prise de greffe. Créé avec BioRender.com. j IF coloration de YFP (vert) et Laminin (rouge) sur les muscles TA 21 jours après la prise de greffe. Barre d'échelle : 50 μm. n = 5 souris par groupe. p = 0.0000091. k Quantification des SC Myod + par vue sur les muscles Ctrl et iKO TA après les 3 séries de blessures. p = 0.0000012, 0.0013, 0.0054, 0.000028, 0.041 et 0.0012. n = 5 souris par groupe pendant 3, 5, 7 jours après la 1ère blessure et 30 jours après la 1ère, 2ème et 3ème blessure et test de prise de greffe ; n = 3 souris par groupe pendant 3, 5, 7 jours après les 2e et 3e blessures. Tous les graphiques à barres sont présentés sous forme de moyenne ± SD, Student t test (bilatéral non apparié) a été utilisé pour calculer la signification statistique (b-h, j, k) : *p < 0.05, **p < 0.01, ***p < 0.001. ns aucune signification. Les données source sont fournies sous la forme d'un fichier de données source.
Compte tenu de l'induction rapide d'ATF3 lors de l'activation précoce du SC, nous avons estimé que sa perte pourrait avoir un impact sur la régénération musculaire médiée par le SC. Pour tester cette notion, BaCl2 a été injecté dans les muscles TA de souris Ctrl ou iKO pour induire des lésions musculaires aiguës 5 jours après la suppression de TMX (Fig. 2a). En examinant les muscles TA lésés ci-dessus à 3, 5, 7 et 30 dpi (Fig. 2a), les muscles iKO ont affiché un taux de régénération très accéléré. Par coloration H&E (Fig. 2b), à 5 dpi, des fibres régénérantes avec des CLN étaient déjà présentes dans l'iKO mais pas dans les muscles Ctrl. À 7 dpi, le muscle endommagé était presque réparé avec des fibres homogènes et aucun signe de cellules immunitaires dans l'iKO et la taille des fibres était également significativement plus grande par rapport au Ctrl (la quantification à droite). Ces observations expérimentales ont été étayées par la coloration IF de eMyHC (Fig. 2c); Les fibres eMyHC + ont été facilement observées dans l'iKO même à 3 dpi (91.64 dans iKO contre 29.86 dans Ctrl) mais ont fortement diminué de 7 dpi. De manière constante, le nombre de cellules Pax7 + à 3 dpi était significativement plus élevé dans iKO par rapport à Ctrl mais inférieur à 5 dpi et 7 dpi (Fig. 2h et Fig supplémentaire. 2f). De plus, les muscles TA prélevés sur les souris iKO à 30 dpi avaient un poids musculaire accru par rapport au Ctrl (43.7 contre 48.4 mg) (Fig. 2g) et la taille des fibres musculaires élargie (1137.4 contre 862.8 μm2) (Fig. 2h), reflétant la réparation améliorée.
Étonnamment, la capacité de régénération accrue de Atf3 Les SC iKO ont persisté après un autre tour de BaCl2-blessure aiguë induite administrée un mois plus tard (Fig. 2a). Comme le montre la Fig. 2d, e, la régénération accélérée est restée tout aussi forte en fonction de l'augmentation de la taille des fibres à 7 dpi et du nombre de fibres eMyHC + à 3 dpi après la 2e blessure. À 30 dpi, le muscle iKO a également montré une augmentation du poids musculaire par rapport au Ctrl (61.7 contre 55.8 mg) (Fig. 2i) et taille des fibres musculaires légèrement agrandie (1724.8 contre 1633.8 μm2) (Fig. 2j). Le 3e tour de blessure a ensuite été donné (Fig. 2a) et la réparation accélérée était toujours évidente (Fig. 2f,g), car le nombre de fibres eMyHC+ à 3 dpi était encore plus élevé dans les muscles iKO vs Ctrl (89.9 vs 45.7) (Fig. 2g) et un nombre plus élevé de fibres plus grosses a été observé à 7 dpi (Fig. 2f). Cependant, malgré une légère augmentation du poids du muscle TA dans l'iKO par rapport au Ctrl 30 jours après la 3e blessure (Fig. 2k), il n'y avait pas de différence significative dans la taille moyenne des fibres musculaires (Fig. 2l), suggérant que la régénération accélérée du muscle iKO a finalement disparu après la 3ème blessure.
Le test de greffe a ensuite été effectué pour valider davantage la capacité de régénération améliorée des SC iKO. Comme illustré dans la Fig. 2i, 21 jours après l'injection des SC YFP + des souris Ctrl ou iKO dans les muscles TA pré-blessés des souris nues réceptrices, les muscles TA ont été collectés pour évaluer la capacité de régénération des cellules du donneur en fonction de l'expression de YFP. En effet, nous avons observé un nombre plus élevé de myofibres YFP+ chez les souris réceptrices transplantées avec les SC iKO vs Ctrl (Fig. 2j). Au total, nos résultats démontrent que Atf3 la suppression améliore la régénération musculaire induite par une blessure aiguë.
Atf3 la suppression provoque une activation prématurée du SC et une pseudo-régénération dans le muscle homéostatique
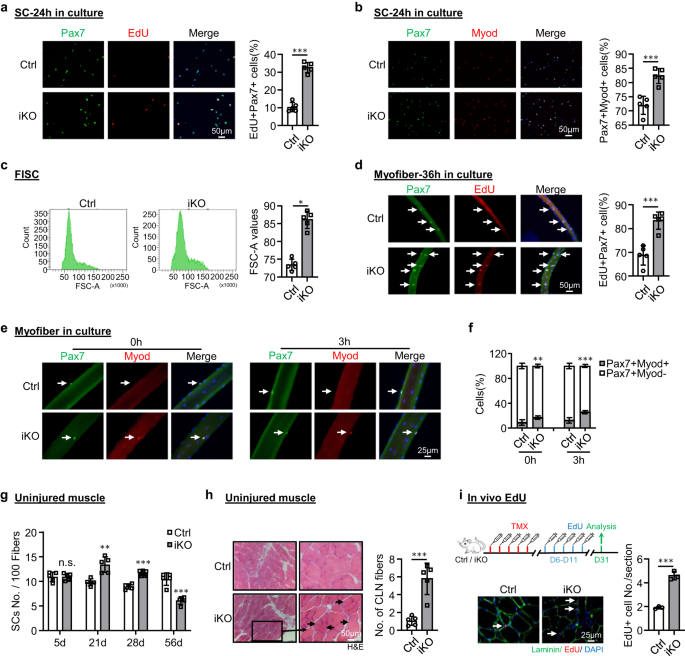
Pour disséquer la cause sous-jacente de l'amélioration de la capacité de régénération lors de la perte d'ATF3, nous avons émis l'hypothèse que les SC iKO subissaient une activation rapide lors de BaCl2 blessure. En effet, lors du traçage de la dynamique des SC MyoD+ au cours des trois cycles de blessure/régénération. un nombre beaucoup plus élevé de cellules MyoD+ a été détecté à 3 dpi (Fig. 2k et Fig supplémentaire. 2m), mais le nombre de cellules a rapidement diminué à 5 dpi. Un tel phénomène existait au cours des deux premières séries de blessures mais a disparu au troisième tour (Fig. 2k et Fig supplémentaire. 2m). Par rapport au Ctrl, l'activation plus rapide des cellules iKO lors d'une blessure aiguë implique une transition plus rapide de la quiescence à l'activation. En effet, les FISC du Atf3Les souris -iKO ont montré une propension remarquablement accrue à l'entrée dans le cycle cellulaire basée sur l'incorporation d'EdU 24 h après la culture (augmentation d'environ 23%) (Fig. 3a). De plus, les cellules Pax7 + MyoD + dans l'iKO ont présenté une augmentation de 10% par rapport au Ctrl 24 h après la culture (Fig. 3b). De plus, les FISC des muscles iKO étaient également légèrement plus grands que ceux de Ctrl (86.1 contre 72.9) (Fig. 3c). De manière constante, les myofibres isolées des muscles iKO avaient une incorporation d'EdU significativement plus élevée (augmentation de 14%) que les Ctrl 36 h après la culture (Fig. 3d), renforçant l'entrée plus rapide dans le cycle cellulaire des SC iKO. Les SC iKO sur des myofibres simples fraîchement isolées ont également produit 1.90 fois et 2.08 fois plus de cellules Pax7 + MyoD + que les SC Ctrl sans culture ou avec 3 h (Fig. 3e, f). Dans l'ensemble, ces résultats indiquent que la perte d'ATF3 entraîne la libération de la quiescence et donc une activation rapide du SC sans lésion aiguë.
a Les SC de souris Ctrl ou iKO ont été cultivées pendant 24 h et traitées avec EdU pendant 6 h avant la coloration pour EdU (rouge) et Pax7 (vert). Barre d'échelle : 50 μm. p = 0.0000014. b Coloration IF de Pax7 (vert) et MyoD (rouge) sur les SC ci-dessus cultivées pendant 24 h. Barre d'échelle : 50 μm. p = 0.00050. c Parcelles FACS représentatives montrant la taille des FISC triés à partir des muscles Ctrl ou iKO. p = 0.050. d Des myofibres fraîchement isolées de souris Ctrl ou iKO ont été cultivées pendant 36 h et traitées avec EdU pendant 6 h avant coloration pour EdU (rouge) et Pax7 (vert). Barre d'échelle : 50 μm. p = 0.00034. e IF coloration de Pax7 (vert) et MyoD (rouge) sur les myofibres ci-dessus immédiatement après isolement ou culture pendant 3 h. Barre d'échelle : 25 μm. f Quantification du pourcentage de CS Myod-Pax7+ et Myod+Pax7+. p = 0.0098 et 0.00035. g Quantification du nombre de SC Pax7+ pour 100 fibres sur les muscles Ctrl ou iKO non lésés 5, 21, 28 et 56 jours après l'injection de TMX. p = 0.96, 0.0018, 0.000049 et 0.00018. h Coloration H&E des muscles non blessés ci-dessus 56 jours après l'injection de TMX. Barre d'échelle : 50 μm. p = 0.00043. i En haut : aperçu schématique du test EdU in vivo effectué sur un muscle Ctrl ou iKO non blessé ; EdU a été injecté par IP 5 jours après TMX. Les muscles ont été prélevés 21 jours plus tard. Coloration IF inférieure d'EdU (rouge) et de la laminine (vert). Barre d'échelle : 25 μm. p = 0.00024. n = 5 souris par groupe (a-h); n = 3 souris par groupe (i). Tous les graphiques à barres sont présentés sous forme de moyenne ± SD, Student t test (bilatéral non apparié) a été utilisé pour calculer la signification statistique (a-d, f-i) : *p < 0.05, **p < 0.01, ***p < 0.001. ns aucune signification. Les données source sont fournies sous la forme d'un fichier de données source.
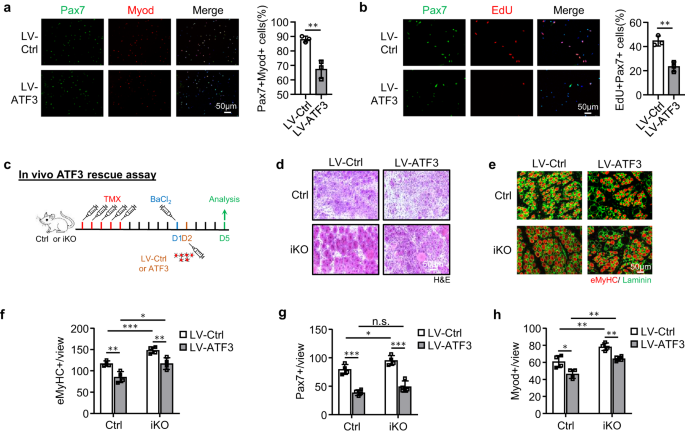
La capacité de régénération améliorée des SC iKO nous a incités à tester davantage si la perte d'ATF3 peut entraîner une activation spontanée et une pseudo-régénération dans les muscles sans blessure. Par rapport au Ctrl, il n'y a pas eu d'augmentation des SC Pax7+ dans les muscles iKO TA à 5 jours post-injection de TMX mais une augmentation significative des cellules Pax7+ dans les muscles iKO TA à 21 (13.4 vs 9.58) et 28 jours (11.7 vs 8.9) (fig. 3g ainsi que S3a), indiquant l'apparition d'une activation et d'une expansion spontanées des SC iKO dans les muscles homéostatiques. Fait intéressant, 56 jours après l'injection de TMX, le nombre de cellules Pax7+ dans les muscles iKO a finalement diminué par rapport au Ctrl (Figs. 3g ainsi que S3a); ceci était accompagné de fibres CLN + facilement visibles (Fig. 3h), indiquant la fusion des myoblastes activés dérivés du SC aux fibres existantes, ce qui est connu sous le nom de pseudo-régénération47. Pour confirmer ces résultats, nous avons effectué cinq doses d'injections d'EdU à 5 jours après l'injection de TMX pour montrer qu'il y avait plus de cellules EdU + sur les sections musculaires de l'iKO que de Ctrl à 21 jours après l'injection d'EdU (Fig. 3i). De même, avec une dose unique d'EdU administrée, les cellules EdU + n'ont été détectées que sur les myofibres iKO isolées ou les muscles TA 12 h plus tard, mais pas sur les Ctrl (Fig. 3b). Au total, ces résultats suggèrent que Atf3 la suppression provoque l'activation précoce des SC dans les muscles homéostatiques, ainsi ATF3 peut fonctionner pour supprimer activement l'activation des SC. Cela a été encore renforcé par la surexpression d'ATF3 dans les FISC par un lentivirus (Fig. 3c); il inhibe significativement l'activation du SC (Fig. 4a, 20.9 % de réduction des cellules Pax7+MyoD+ et Fig. 4b, 21.3 % de réduction des cellules EdU+). De plus, la surexpression d'ATF3 in vivo par injection intramusculaire des particules de lentivirus à 1 dpi (Fig. 4c) a retardé la régénération chez les souris Ctrl et a également atténué la régénération accélérée chez les souris iKO (Figs. 4j–h ainsi que S3d,e).
a Les FISC de souris Ctrl ou iKO ont été infectées par des lentivirus surexprimant ATF3 et colorées pour Pax7 (vert) et Myod (rouge) après 48 h. Barre d'échelle : 50 μm. p = 0.0050. b Le test EdU a été effectué et les cellules EdU + ont été quantifiées. Barre d'échelle : 50 μm. p = 0.0031. c Schéma de surexpression d'ATF3 in vivo. Des lentivirus exprimant ATF3 ont été injectés dans les muscles Ctrl ou iKO TA 1 jour après BaCl2 blessure. Les muscles ont été prélevés 5 jours après l'infection pour analyse. d Coloration H&E des muscles TA ci-dessus. Barre d'échelle : 50 μm. e La coloration IF de eMyHC (rouge) et de Laminin (vert) a été réalisée sur les muscles TA ci-dessus. Barre d'échelle : 50 μm. f Le nombre de fibres eMyHC+ par vue a été quantifié. p = 0.0044, 0.00081, 0.015 et 0.0072. g Le nombre de cellules Pax7 + par vue sur les muscles TA ci-dessus a été quantifié. p = 0.00018, 0.041, 0.098 et 0.00040. h Le nombre de cellules Myod+ par vue sur les muscles TA ci-dessus a été quantifié. p = 0.016, 0.0058, 0.0010 et 0.0019. n = 3 souris par groupe (a, b); n = 4 souris par groupe (d-h). Tous les graphiques à barres sont présentés sous forme de moyenne ± SD. Étudiants t test (bilatéral non apparié) a été utilisé pour calculer la signification statistique (a, b, f-h) : *p < 0.05, **p < 0.01, ***p < 0.001. ns aucune signification. Les données source sont fournies sous la forme d'un fichier de données source.
De plus, nous avons observé une augmentation de 24% des cellules de différenciation MyoD + MyoG + dans les fibres musculaires iKO isolées par rapport au Ctrl après 72 h de culture (Fig. 3f), suggérant que Atf3 la suppression peut accélérer la différenciation de la descendance SC. Cela a été confirmé par coloration pour MyoD et MyoG sur des SC cultivées pendant 72 h ; Une augmentation de 9% des cellules doublement positives a été détectée dans le iKO vs Ctrl (Fig. 3g). Fait intéressant, il y avait également une légère diminution des cellules Pax7 + MyoD− dans les fibres musculaires iKO par rapport au Ctrl (10.13, 8.48% contre XNUMX, XNUMX%) (Fig. 3h), ce qui suggère que la perte d'Atf3 peut également entraîner une altération de l'auto-renouvellement. De manière constante, nous avons également remarqué une diminution progressive du nombre de SC après chaque série de blessures (Fig. 2h et Fig supplémentaire. 2f).
À long terme Atf3 la carence épuise le pool de SC et altère la régénération musculaire
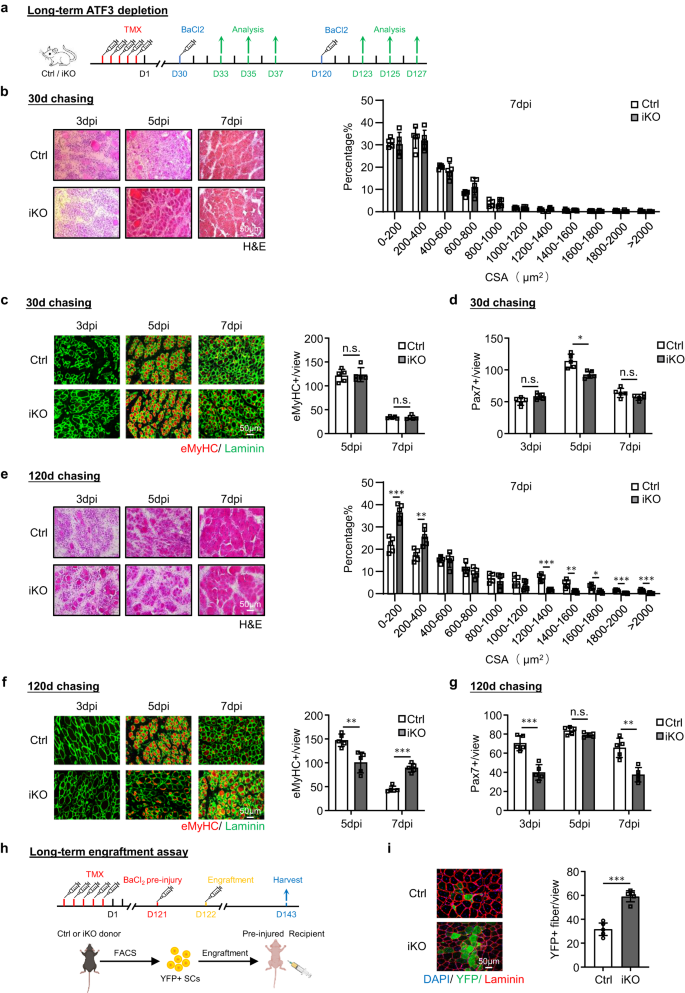
Ensuite, pour tester si à long terme Atf3 une carence provoque un épuisement du SC et altère la régénération musculaire, nous avons induit des lésions musculaires par le BaCl2 administration 30 jours ou 120 jours après la suppression Atf3 des CS et a examiné les muscles TA lésés à 3, 5 et 7 dpi (Fig. 5a). Trente jours après la suppression, la régénération musculaire (basée sur la taille des fibres musculaires et le nombre de fibres eMyHC+) n'a montré aucun changement significatif par rapport aux souris Ctrl (Fig. 5b, c). Le nombre de Pax7+ SC était également comparable à 3 et 7 dpi et seulement légèrement inférieur dans l'iKO à 5 dpi (Fig. 5d et Fig supplémentaire. 4a). En revanche, 120 jours après la suppression, la régénération musculaire était manifestement compromise chez les souris iKO par rapport aux souris Ctrl. Une augmentation significative des fibres plus petites a été observée à 7 dpi (Fig. 5e); le nombre de fibres eMyHC+ était beaucoup plus faible à 5 dpi mais plus élevé à 7 dpi (Fig. 5f); le nombre de SC Pax7 + a également été significativement réduit à 3 et 7 dpi (Fig. 5g et Fig supplémentaire. 4b). Ces résultats démontrent que le long terme Atf3 carence est préjudiciable à la régénération en rétrécissant le pool de SC. Fait intéressant, lorsque le même nombre de cellules YFP + isolées des souris Ctrl ou iKO 4 mois après l'injection de TMX ont été utilisées dans le test de prise de greffe (Fig. 5h), un nombre plus élevé de myofibres YFP+ a été observé chez les souris nude receveuses transplantées avec les cellules iKO (59.28 contre 31.72, Fig. 5i), suggérant que la capacité de régénération accrue des cellules iKO persiste après une perte à long terme d'ATF3 et que la régénération musculaire altérée provient en effet du pool cellulaire réduit.
a Aperçu schématique de la conception expérimentale pour tester l'effet de long terme Atf3 suppression sur le processus de régénération musculaire. 30 ou 120 jours après l'injection de TMX avant BaCl2 injection. b Gauche : coloration H&E des muscles TA collectés à 3, 5 et 7 dpi après la période de chasse de 30 jours. Barre d'échelle : 50 μm. n = 5 souris par groupe. À droite : les CSA de fibres nouvellement formées ont été quantifiées à partir du muscle TA coloré ci-dessus à 7 dpi et la distribution est indiquée. n = 5 souris par groupe. c Gauche : la coloration IF de eMyHC (rouge) et de Laminin (vert) a été réalisée sur les muscles TA ci-dessus. Barre d'échelle : 50 μm. Droite : Quantification du nombre de fibres eMyHC+ par vue à 5 et 7 dpi. n = 5 souris par groupe. p = 0.83 et 0.98. d Quantification du nombre de SC Pax7+ par vue. n = 5 souris par groupe. p = 0.054, 0.0047 et 0.11. e-g Les dosages/quantifications ci-dessus ont été effectués sur les muscles Ctrl ou iKO collectés à 3, 5 et 7 dpi après la période de chasse de 120 jours. Barre d'échelle : 50 μm. n = 5 souris par groupe. p = 0.00020, 0.0047, 0.000068, 0.0024, 0.013, 0.00019 et 0.00057 (e); p = 0.0034 et 0.000018 (f); p = 0.00031, 0.063 et 0.0010 (g). h Schéma du test de prise de greffe. 120 jours après l'injection de TMX, des FISC de souris donneuses (Ctrl/iKO) ont été injectées à des souris nude receveuses pré-blessées. Les muscles TA ont été prélevés 21 jours après la prise de greffe pour analyse. Créé avec BioRender.com. i Gauche : coloration IF de YFP (vert) et de la laminine (rouge) sur les muscles TA ci-dessus. Barre d'échelle : 50 μm. À droite : le nombre de fibres YFP+ par vue a été quantifié. n = 5 souris par groupe. p = 0.000047. Tous les graphiques à barres sont présentés sous forme de moyenne ± SD. Étudiants t test (bilatéral non apparié) a été utilisé pour calculer la signification statistique (b-g, i) : *p < 0.05, **p < 0.01, ***p < 0.001. ns aucune signification. Les données source sont fournies sous la forme d'un fichier de données source.
Pour mieux établir l'importance de Atf3 dans l'établissement et la maintenance de SC, nous avons supprimé avec succès Atf3 chez les progéniteurs myogéniques Pax7+ en croisant Atf3flox allèle avec un non-inductible Pax7Cre-R26RVFR souche de souris transgénique48, dans laquelle la recombinase Cre est exprimée dans les cellules progénitrices Pax7 + dès E9.5 (Fig. 5a – c). Fait intéressant, les muscles cKO ont présenté une augmentation de 84 % des SC Pax7 + par rapport au Ctrl environ 1 mois après la naissance lorsque le pool de SC a été établi49, mais diminution de 79% chez les souris adultes âgées de deux mois (Fig. 5e), indiquant que l'ATF3 est nécessaire pour le maintien du SC à l'âge adulte mais dispensable pour l'établissement du SC. Une diminution du poids du muscle TA a été détectée dans la cKO à 1 mois (29.42 mg contre 34.88 mg, Fig. 5f) mais pas de différence significative dans le poids corporel (12.66 mg contre 12.42 mg, Fig. 5d) et la taille des fibres (861.96 μm2 contre 848.71 μm2, Fig. Supplémentaire 5g), il est donc difficile de conclure si l'hypertrophie musculaire se produit chez les jeunes souris cKO. Comme prévu, lorsque les SC adultes ont été isolés et cultivés, les cellules cKO ont affiché une propension beaucoup plus élevée à l'activation évaluée à la fois par la coloration Pax7 + Myod + (Fig. 5h, augmentation de 23.8 % de cKO par rapport à Ctrl) et du test EdU (Fig. 5i, augmentation de 99.9 %). De même, la capacité de régénération après une blessure aiguë était manifestement compromise dans les muscles cKO (Fig. 5j–l). Par conséquent, la perte d'ATF3 induit une activation précoce du SC et conduit à la réduction éventuelle du pool de SC.
Atf3 la suppression améliore l'activation du SC pendant les exercices volontaires et d'endurance
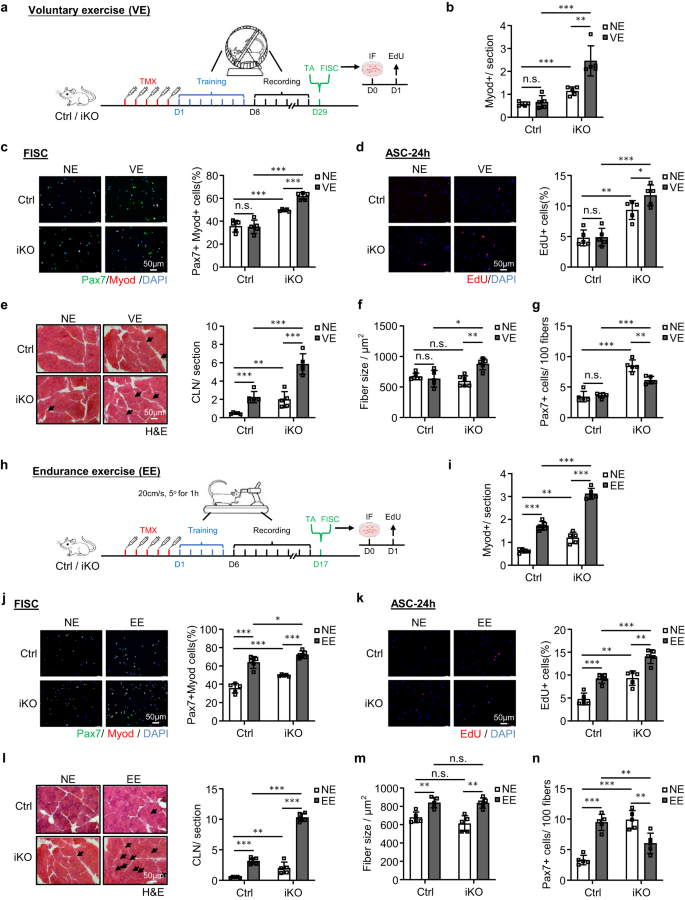
L'exercice volontaire (VE) à court terme et non intense ne provoque pas l'activation du SC, mais l'exercice d'endurance (EE) active les SC50,51,52,53,54. Pour prouver davantage la fonction d'ATF3 dans la prévention de l'activation du SC, nous avons cherché à déterminer si l'appauvrissement en ATF3 influence l'activation du SC induite par le VE. Immédiatement après cinq doses d'injection de TMX, les souris Ctrl et iKO ont été soumises à un régime de course de roue volontaire établi ; les souris ont eu accès à des roues tournantes libres ; une routine VE stable a été atteinte dans les 7 jours suivant l'entraînement et s'est poursuivie pendant 21 jours supplémentaires VE (Fig. 6a). La distance de course quotidienne a été enregistrée et aucune différence significative n'a été détectée entre les souris Ctrl (14.38 km) et iKO (13.78 km) (Fig. 6a, b).
a Schéma de la conception expérimentale pour VE. b Quantification des cellules Myod+ sur les muscles TA ci-dessus. p = 0.54, 0.00024, 0.00049 et 0.0024. c Coloration IF de Pax7 (vert) et MyoD (rouge) sur des SC isolées des souris ci-dessus et cultivées pendant 24 h triées. Barre d'échelle : 50 μm. p = 0.91, 0.00035, 0.000018 et 0.000032. d EdU (rouge) a été coloré sur des SC triés à partir des souris ci-dessus et cultivés pendant 24 h. Barre d'échelle : 50 μm. p = 0.90, 0.0010, 0.00013 et 0.046. e Coloration H&E des muscles TA ci-dessus. Barre d'échelle : 50 μm. p = 0.00043, 0.0073, 0.00021 et 0.00047. f Taille des fibres des muscles TA ci-dessus (e). p = 0.54, 0.19, 0.012 et 0.0017. g Quantification des SC Pax7 + sur les muscles TA ci-dessus. p = 0.66, 0.000023, 0.000052 et 0.0017. h Schéma du plan d'expérience (EE). i Quantification des cellules Myod+ sur les muscles TA prélevées sur les souris Ctrl et iKO ci-dessus avec ou sans EE. p = 0.0000026, 0.0010, 0.0000073 et 0.0000015. j Coloration IF de Pax7 (vert) et MyoD (rouge) sur des SC triées à partir des souris ci-dessus et cultivées pendant 24 h. Barre d'échelle : 50 μm. p = 0.000062, 0.00035, 0.035 et 0.0000018. k EdU (rouge) a été coloré sur des SC isolés des souris ci-dessus et cultivés pendant 24 h. Barre d'échelle : 50 μm. p = 0.00031, 0.0010, 0.00034 et 0.0012. l Coloration H&E des muscles TA ci-dessus. Barre d'échelle : 50 μm. p = 0.0000039, 0.0073, 0.000000071 et 0.00000026. m Taille des fibres des muscles TA ci-dessus (l). p = 0.0022, 0.19, 0.91 et 0.0012. n Quantification des SC Pax7 + par sur les muscles TA ci-dessus. p = 0.000018, 0.000024, 0.0067 et 0.0049. n = 5 souris par groupe (b-g, i-n). Tous les graphiques à barres sont présentés sous forme de moyenne ± SD. Étudiants t test (bilatéral non apparié) a été utilisé pour calculer la signification statistique (b-g, i-n) : *p < 0.05, **p < 0.01, ***p < 0.001. ns aucune signification. Les données source sont fournies sous la forme d'un fichier de données source.
Comme prévu, les expressions des membres de la famille AP-1 ont été induites par le VE dans les SC Ctrl (Fig. 6c). Également conforme aux rapports précédents54, le VE n'a pas induit d'activation de SC chez les souris Ctrl car aucune cellule MyoD + n'a été détectée sur les sections musculaires avant et après le VE (Fig. 6b et Fig supplémentaire. 6d); systématiquement, la coloration Pax7 + MyoD + des FISC (Fig. 6c) ou coloration EdU des ASC cultivées pendant 24 h (Fig. 6d) n'a pas révélé d'augmentation du taux d'activation avant et après l'EV. En revanche, les cellules iKO ont été facilement activées par le VE (Fig. 6b-d et Fig supplémentaire. 6d). De manière constante, dans les muscles iKO, nous avons également détecté un nombre significativement accru de fibres CLN (augmentation de 136 %) (Fig. 6e) et une hypertrophie évidente (taille des fibres augmentée de 43.3 %) après l'EV (Fig. 6f). Dans les muscles Ctrl, le nombre de CLN a été augmenté après l'EV mais pas suffisamment pour provoquer une croissance hypertrophique (Fig. 6e, f). Les résultats ci-dessus renforcent ainsi l'idée que la perte d'ATF3 induit une activation rapide des SC par le VE. En conséquence, le pool de SC était réduit (diminution de 38.2 % des FISC Pax7+) à la fin du régime VE (Fig. 6g et Fig supplémentaire. 6e).
Étant donné que l'EE est connue pour provoquer l'activation du SC et l'hypertrophie musculaire50,51,52,53, nous avons ensuite examiné si le Atf3 carence affecte l'activation SC induite par l'EE. À cette fin, les souris Ctrl et iKO ont été soumises à un régime de course sur tapis roulant55,56 dans lequel le tapis roulant était incliné à 5° et à une vitesse de 20 cm/s pendant 60 min. Après cinq doses d'injection de TMX, les souris ont été entraînées pendant une période d'adaptation de 5 jours, puis suivies d'un entraînement d'endurance de 10 jours (+EE) ou, comme condition de contrôle, sans aucun entraînement (NE) (Fig. 6h). Comme prévu, les expressions des membres de la famille AP-1 ont été rapidement induites par l'EE dans les SC (Fig. 6c). De plus, l'EE a provoqué une activation SC évidente dans les muscles Ctrl, mais l'activation était beaucoup plus forte dans les muscles iKO (Fig. 6i–k et Fig supplémentaire. 6f). De manière constante, les fibres CLN ont été induites dans les muscles Ctrl et iKO après l'EE ; et une augmentation plus élevée des fibres CLN a été observée dans l'iKO par rapport aux muscles Ctrl (Fig. 6l). De plus, les muscles Ctrl et iKO ont montré une croissance hypertrophique après l'EE mais aucune différence n'a été détectée (Fig. 6m). À la fin du régime EE, le nombre de FISC Pax7+ a été significativement augmenté dans le Ctrl mais diminué dans le iKO (Fig. 6n et Fig supplémentaire. 6g), indiquant l'épuisement rapide du pool iKO SC. Dans l'ensemble, ces résultats indiquent que la perte d'ATF3 provoque l'activation de SC par VE et améliore également l'activation de SC par EE.
ATF3 régule H2B expression génique et structuration des nucléosomes
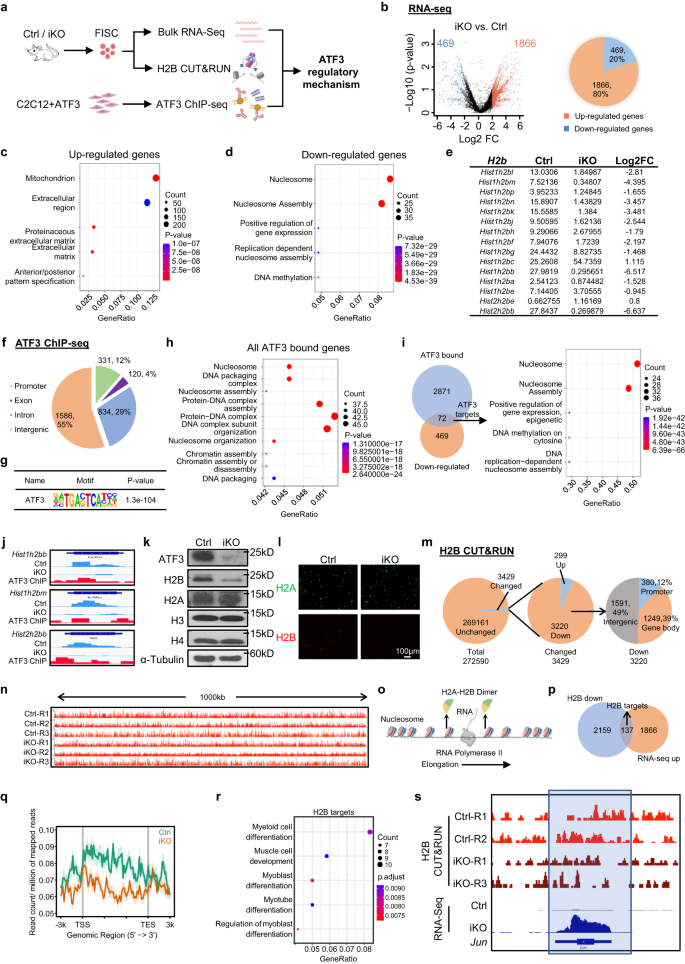
Au total, les résultats ci-dessus suggèrent un rôle essentiel de l'induction d'ATF3 dans la prévention de l'activation précoce du SC, pour éclairer le mécanisme moléculaire sous-jacent, nous avons profilé la sortie transcriptionnelle d'ATF3 en effectuant un ARN-Seq dans les FISC collectés à partir des muscles Ctrl et iKO (Fig. 7a). Un total de 1866 transcriptions (points rouges) (79.9 %) étaient régulées à la hausse dans l'iKO par rapport à la Ctrl, tandis que 469 (points bleus) (20.1 %) étaient régulées à la baisse (Fig. 7b, Fig. Supplémentaire 7a et données supplémentaires 1), suggérant que la perte d'ATF3 induit une activation transcriptionnelle globale. L'analyse GO a révélé que les gènes régulés positivement étaient enrichis pour la "mitochondrie", la "matrice extracellulaire", etc. (Fig. 7c et données supplémentaires 1). Il convient de noter que l'activité mitochondriale élevée et l'expression de la matrice extracellulaire ont déjà été décrites dans le GAlerte cellules10, suggérant que ATF3 fonctionne pour réprimer l'expression de ces gènes activateurs, empêchant ainsi l'activation prématurée de SC. Les gènes régulés à la baisse ont été enrichis de manière intéressante pour le "nucléosome" et "l'assemblage de nucléosome", etc. (Fig. 7d et données supplémentaires 1). Notamment, les gènes codant pour les protéines Histone étaient fortement représentés parmi les gènes régulés à la baisse (Fig. 7e), qui a également été confirmé par RT-qPCR (diminution de 19 à 46 %) (Fig. 7b). Les gènes codant pour les histones sont généralement organisés en grappes multigéniques et la protéine H2B est codée par 2 grappes de gènes avec 15 sur Chr13 formant un Hist1h2b cluster et 2 sur Chr3 formant un Hist2h2b cluster (Fig. 7c). Fait remarquable, 13 des 17 H2b les gènes ont été régulés à la baisse dans les SC iKO (Fig. 7e). De plus, nous avons également effectué RNA-Seq sur des FISC isolés des Ctrl et Atf3-cKO et des résultats similaires ont été obtenus (Fig. 7j–g et données supplémentaires 3). Ces résultats démontrent que la perte d'ATF3 diminue H2b l'expression du gène.
a Schéma de la conception expérimentale. Créé avec BioRender.com. b Les DEG ont été identifiés à partir de l'ARN-seq Ctrl vs iKO ci-dessus. c, d Analyse GO des gènes régulés à la hausse et à la baisse ci-dessus. e FPKM et Log2FC de H2b gènes dans iKO vs Ctrl. f Distribution génomique de 2871 pics de liaison ATF3. g Enrichissement des motifs ATF3 canoniques dans les régions de liaison ci-dessus. h Analyse GO pour tous les gènes ci-dessus avec liaison ATF3. i Gauche : diagrammes de Venn montrant le chevauchement (72 gènes) entre la cible ChIP-Seq identifiée ci-dessus (2871) et les gènes régulés à la baisse (469). À droite : l'analyse GO des 72 gènes ci-dessus a révélé un enrichissement extrême des termes liés aux histones. j Instantanés génomiques de 3 des éléments identifiés ci-dessus H2b gènes avec liaison ATF3 dans leurs TSS (pistes ChIP-Seq) et régulés à la baisse par suppression ATF3 (pistes RNA-Seq). k Les protéines ATF3, H2A, H2B, H3 et H4 ont été mesurées par western blot en FISC de souris Ctrl et iKO. L'α-tubuline a été utilisée comme contrôle de charge. l IF coloration de H2A (vert) et H2B (rouge) sur les FISC ci-dessus. Barre d'échelle : 100 μm ; n = 3 souris par groupe. m Graphiques circulaires montrant le nombre de bacs avec H2B changé (3429, 299 en haut et 3220 en bas) et inchangé (269161) (gauche et milieu), et la distribution génomique des signaux H2B régulés à la baisse (droite). n Instantanés génomiques d'une piste IGV (Integrative Genomics Viewer) de région de 1000 kb du signal H2B dans Ctrl vs. iKO sur Chr4. o Schéma du processus d'élongation de l'ARN polymérase II lors de la transcription de l'ADN. Créé avec BioRender.com. p Diagrammes de Venn montrant le chevauchement (137 gènes) entre les régions ci-dessus avec des signaux H2B CUT&RUN régulés à la baisse (2159) et les gènes régulés à la hausse (1866) de l'ARN-Seq ci-dessus (A). q Métaparcelles montrant des signaux H2B CUT&RUN moyens de 3 kb en amont et en aval du TSS. r Analyse GO des 252 gènes ci-dessus de (P). s Instantanés génomiques de juin gène montrant un signal H2B CUT&RUN régulé à la baisse et un signal RNA-Seq régulé à la hausse dans iKO vs. Ctrl. Les régions avec réduction du signal H2B dans iKO vs Ctrl sont mises en évidence dans un cadre bleu. Les données source sont fournies sous la forme d'un fichier de données source.
Ensuite, nous avons effectué ChIP-Seq sur les myoblastes C2C12 avec une surexpression exogène d'ATF3 comme système de substitution pour définir des cibles de liaison directe d'ATF3 (Fig. 7a et Fig supplémentaire. 7h). Un total de 2871 pics de liaison ont été identifiés dans 869 gènes avec 60%, 28% et 9% situés respectivement dans les régions intergéniques, les introns et les promoteurs (Fig. 7f et données supplémentaires 2). Ces pics ont été enrichis pour le motif de liaison ATF3 connu, TGACTCA (Fig. 7g), attestant de la bonne qualité des données. L'analyse GO de ces gènes liés à ATF3 a indiqué un enrichissement remarquable pour les termes liés au nucléosome (Fig. 7h et données supplémentaires 2). En intégrant les résultats RNA-Seq et ChIP-Seq, 72 gènes régulés à la baisse contenaient des sites de liaison ATF3 et encore une fois, ils étaient enrichis pour les termes GO liés aux nucléosomes et beaucoup étaient des gènes d'histone (Fig. 7i et données supplémentaires 2). Notamment, 8 des 13 régulés à la baisse H2b Les gènes avaient des sites de liaison ATF3 dans leurs promoteurs (Fig. 7i,j, Fig. Supplémentaire 7i et données supplémentaires 2). Pendant ce temps, 112 gènes régulés positivement possédaient la liaison ATF3 et étaient enrichis pour les termes GO liés à la mitochondrie (Fig. 7j et données supplémentaires 2). Le Western blot (fig. 7k) et la coloration IF (Fig. 7l) les résultats ont confirmé une réduction substantielle ou une quasi-perte de la protéine H2B dans les FISC iKO tandis que d'autres protéines histones telles que H3, H4 et H2A sont restées inchangées. Ces résultats démontrent que H2b sont de véritables cibles transcriptionnelles d'ATF3.
La diminution globale des histones entraîne une diminution de la quantité de nucléosomes, une augmentation de l'espacement des nucléosomes et modifie l'occupation des nucléosomes, affectant ainsi la transcription57,58,59, pour déterminer si la perte de H2B dans les SC iKO modifie le positionnement et l'occupation des nucléosomes, test CUT&RUN60,61 a été réalisée pour cartographier la localisation génomique de H2B dans les cellules Ctrl et iKO (Fig. 7a). Un total de 272590 bacs ont été définis à l'échelle du génome à partir des trois réplicats (Données supplémentaires 4). De manière inattendue, les signaux moyens H2B CUT&RUN étaient en grande partie inchangés dans le iKO contre Ctrl avec seulement 3429 bacs (1.4%) montrant des changements (Fig. 7 m, n). Néanmoins, 3220 des bacs modifiés ont en effet montré une diminution de l'enrichissement en H2B dans diverses régions génomiques, y compris le promoteur (12%), le corps du gène (39%) et les régions intergéniques (49%) (Fig. 7m). Étant donné que le nucléosome est partiellement dissimulé par l'élimination d'un dimère H2A-H2B pour faciliter la transcription Pol II61 (Figue. 7o), nous avons émis l'hypothèse que la perte locale de H2B pourrait faciliter la déstabilisation des nucléosomes pour favoriser la transcription des gènes associés. En effet, en croisant les données RNA-Seq, 137 gènes régulés positivement ont montré une diminution des signaux H2B sur leurs promoteurs ou corps de gènes (Fig. 7h, q et données supplémentaires 4). Ces gènes cibles H2B ont été enrichis pour les termes GO liés à la différenciation musculaire et ont également inclus Identifiant3, IGF-1 ainsi que juin, etc. (fig. 7r, s), ce qui était cohérent avec l'état d'activation des SC iKO11,62,63. Pris ensemble, ces résultats démontrent que la diminution du niveau de H2B pourrait médier l'activation précoce du SC suite à la perte d'ATF3.
H2B médie la fonction ATF3 dans l'activation du SC et la régénération musculaire
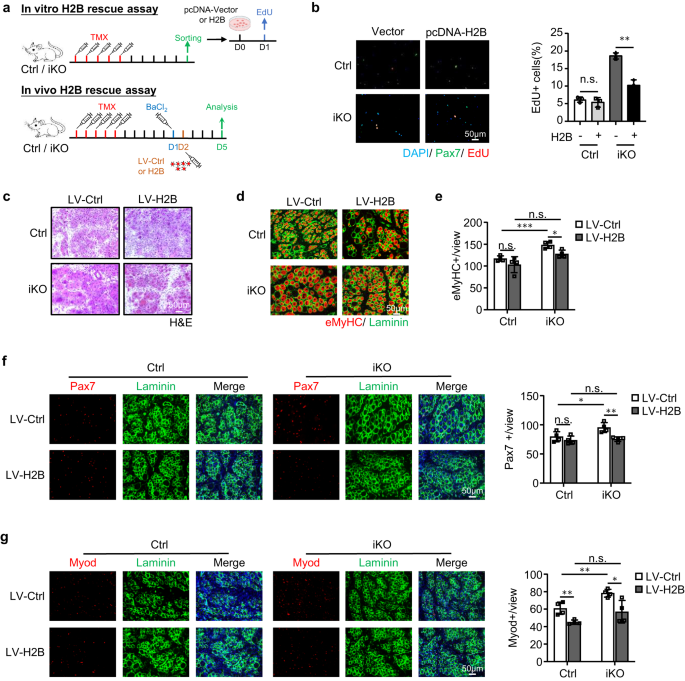
Pour solidifier le lien fonctionnel entre ATF3 et H2B dans l'activation de SC et la régénération musculaire, nous avons constaté que la surexpression de H2B en transfectant un plasmide pcDNA-H2B dans des FISC réprimait en effet l'activation accélérée des cellules Atf3 iKO mais aucun impact sur les cellules Ctrl (Fig. 8a, b). Et in vivo, nous avons également surexprimé H2B (Fig. 7k) par injection intramusculaire de particules lentivirales à 1dpi (Fig. 8a). Comme le montre la Fig. 8c–g, cela a également restauré la régénération induite par les lésions aiguës chez les souris Atf3-iKO : un nombre significativement plus faible de fibres eMyHC+ a été observé à 5 dpi (Fig. 8d, e), qui s'accompagnait d'un nombre réduit de cellules Pax7+ (Fig. 8f) et les cellules MyoD+ (Fig. 8g). Au total, ces résultats valident que la perte de H2B médie l'activation précoce du SC et la régénération musculaire améliorée observée lors de la perte d'ATF3.
a En haut : Schéma de surexpression de H2B in vitro. Les FISC de souris Ctrl ou iKO ont été transfectées avec un plasmide témoin (Ctrl) ou pCDNA-H2B et un test EdU a été effectué pour évaluer l'activation de SC. En bas : Schéma de surexpression de H2B in vivo via le virus lenti. Un lentivirus exprimant H2B a été injecté dans les muscles Ctrl ou iKO TA 1 jour après BaCl2 blessure et les muscles ont été prélevés 5 jours après l'infection pour analyse. b Gauche : les cellules transfectées ci-dessus ont été cultivées pendant 24 h avant d'être traitées avec EdU pendant 6 h ; Les cellules positives EdU ont été colorées et quantifiées. Barre d'échelle : 50 μm ; n = 3 souris par groupe. p = 0.44 et 0.0013. c Coloration H&E des muscles TA ci-dessus collectés à 5 dpi après infection. Barre d'échelle : 50 μm. n = 4 souris par groupe. d La coloration IF de eMyHC (rouge) et de Laminin (vert) a été réalisée sur les muscles TA ci-dessus. Barre d'échelle : 50 μm. e Le nombre de fibres eMyHC+ par vue a été quantifié. n = 4 souris par groupe. De gauche à droite, p = 0.20, 0.00081, 0.052 et 0.012. f Gauche : la coloration IF de Pax7 (rouge) et de laminine (vert) a été réalisée sur les muscles TA ci-dessus. Barre d'échelle : 50 μm. À droite : le nombre de cellules Pax7+ par vue a été quantifié. n = 4 souris par groupe. De gauche à droite, p = 0.33, 0.041, 0.67 et 0.0052. g Gauche : la coloration IF de Myod (rouge) et de la laminine (vert) a été réalisée sur les muscles TA ci-dessus. Barre d'échelle : 50 μm. À droite : le nombre de cellules Myod+ par vue a été quantifié. n = 4 souris par groupe. De gauche à droite, p = 0.0053, 0.0058, 0.12 et 0.020. Tous les graphiques à barres sont présentés sous forme de moyenne ± SD. Étudiants t test (bilatéral non apparié) a été utilisé pour calculer la signification statistique (b, e-g) : *p < 0.05, **p < 0.01, ***p < 0.001. ns aucune signification. Les données source sont fournies sous la forme d'un fichier de données source.
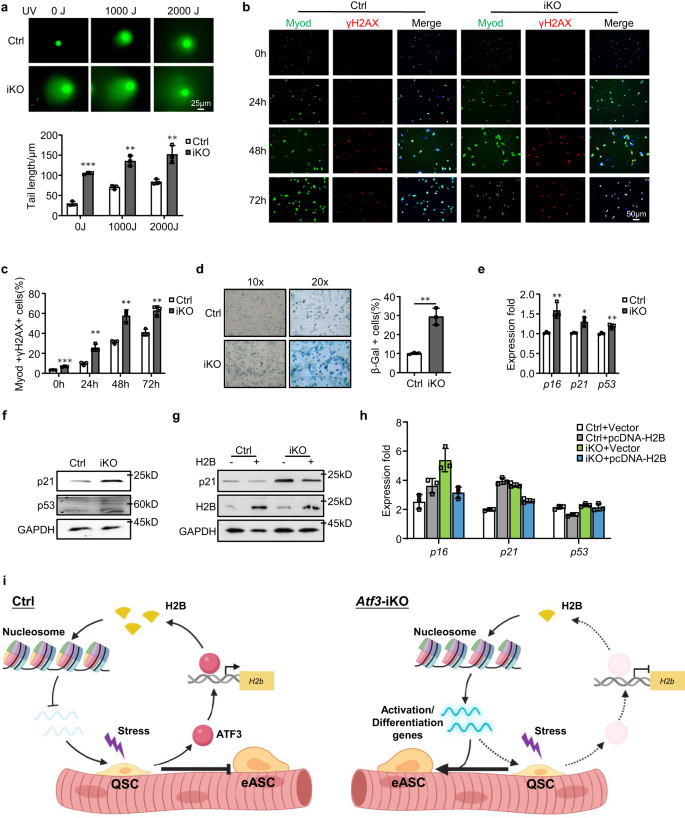
La perte de H2B augmente les dommages à l'ADN et la sénescence chez Atf3 SC iKO
Pour élucider davantage la conséquence de la perte de H2B dans les SC, nous avons examiné l'instabilité du génome et la sénescence cellulaire en considérant que les protéines histones sont importantes pour l'intégrité de la chromatine et la stabilité du génome.57,59. Les FISC des muscles iKO ou Ctrl ont été traités avec différentes doses (0, 1000 ou 2000J) de lumière UV et un test de comète a été effectué. En effet, une augmentation substantielle de la longueur de la queue de la comète a été observée sous les trois doses dans l'iKO par rapport à la Ctrl (Fig. 9a), suggérant que la diminution de H2B provoque une instabilité génomique. Cela a été confirmé par un pourcentage beaucoup plus élevé de cellules γH2AX + dans les cellules iKO cultivées par rapport au Ctrl (Fig. 9b, c). Pour examiner si l'instabilité génomique conduit à la sénescence cellulaire, les cellules ont été cultivées dans un milieu de croissance pendant 9 jours et une coloration β-Gal a été réalisée ; une augmentation de 19 % des cellules β-Gal+ a été détectée dans l'iKO par rapport à la Ctrl (Fig. 9d). Constamment, une importante régulation à la hausse de p16, p21et p53 ARNm (Fig. 9e) et un niveau plus élevé de protéines p21 et p53 ont également été détectés dans l'iKO (Fig. 9f). Dans l'ensemble, les résultats ci-dessus démontrent que la perte de H2B entraîne une instabilité accrue du génome et une sénescence cellulaire dans le Atf3 cellules iKO. Comme on pouvait s'y attendre, la surexpression de H2B dans les cellules iKO a réduit l'accumulation de dommages à l'ADN et inhibé la sénescence cellulaire, comme en témoigne la diminution de la protéine p21 (Fig. 9g), Ainsi que p16, p21 ainsi que p53 ARNm (Fig. 9h). Ces résultats indiquent que la diminution de l'expression de H2B entraîne une sénescence réplicative des SC.
a Le test des comètes a été effectué sur des SC Ctrl ou iKO après un traitement UV de 0, 1000 ou 2000J. Barre d'échelle : 25 μm. n = 3 souris par groupe. p = 0.000029, 0.0012 et 0.0071. b La coloration IF de γH2AX (rouge) et Myod (vert) a été réalisée sur des SC de souris Ctrl ou iKO après culture pendant 0, 24, 48 ou 72 h. Barre d'échelle : 50 μm. c Quantification des pourcentages de cellules Myod+/γH2AX+ ; n = 3 souris par groupe. p = 0.00014, 0.0024, 0.0021 et 0.0031. d La coloration β-Gal (bleue) a été réalisée sur des SC de souris Ctrl ou iKO après culture pendant 9 jours. n = 3 souris par groupe. p = 0.0017. e Expression des gènes marqueurs de sénescence sélectionnés comprenant p16, p21 ainsi que p53 dans les SC de Ctrl et iKO a été quantifié par RT-qPCR. p = 0.0078, 0.011 et 0.0061. f Les niveaux de protéines p21 et p53 ont été détectés par Western blot dans des SC de souris Ctrl et iKO. GAPDH a été utilisé comme contrôle de chargement. g, h Les SC des souris Ctrl et iKO ont été transfectées avec un plasmide de contrôle vectoriel ou surexprimant H2B. 96 h après la transfection, l'expression des gènes indiqués a été détectée par Western blot et RT – qPCR. GAPDH a été utilisé comme contrôle de chargement. i Modèle schématique illustrant le rôle fonctionnel de l'ATF3 dans la prévention de l'activation précoce du SC. Dans le muscle homéostatique, l'induction rapide d'ATF3 lors d'un stress mineur favorise H2b expression pour maintenir le bon positionnement des nucléosomes et supprimer l'expression des gènes d'activation, empêchant ainsi l'activation précoce des SC. Lors de la perte d'ATF3, une carence en H2B se produit, ce qui entraîne une altération du positionnement des nucléosomes et une régulation à la hausse des gènes d'activation, provoquant la rupture des SC et l'entrée en phase d'activation précoce. Créé avec BioRender.com. Tous les graphiques à barres sont présentés sous forme de moyenne ± SD. Étudiants t test (bilatéral non apparié) a été utilisé pour calculer la signification statistique (a, c-e) : *p < 0.05, **p < 0.01, ***p < 0.001. ns aucune signification. Les données source sont fournies sous la forme d'un fichier de données source.
Dépistage d'autres membres fonctionnels de la famille AP-1 dans les CS et régénération
Après la caractérisation holistique ci-dessus de la fonction et du mécanisme de l'ATF3 dans les SC, nous avons cherché à élargir l'étude en demandant si d'autres TF de la famille AP-1 tels que l'ATF4, le FOS, le FOSB et le JUNB jouent également des rôles fonctionnels dans les SC compte tenu de leur similarité. dynamique d'induction rapide et transitoire lors de l'activation précoce du SC (Figs. 1b-d ainsi que S1c). Pour tester l'idée, nous avons effectué un criblage fonctionnel à l'aide de notre logiciel récemment développé. Pax7Cas9/Plateforme d'édition du génome in vivo médiée par AAV-sgRNA64, qui est basé sur une souris knock-in Cas9 Cre-dépendante et la livraison d'ARNsg médiée par AAV. En bref, une paire d'ARNsg ciblant chaque TF a été sélectionnée et emballée dans des particules virales AAV9 ; 4 × 1011 génomes viraux (vg)/souris d'AAV9-sgRNA a été injecté par voie intramusculaire (IM) dans les muscles TA de Pax7Cas9 souris à l'âge postnatal (P) de 10 jours (P10). Pour le groupe témoin (Ctrl), la même dose de virus AAV9 contenant le squelette du vecteur pAAV9-sgRNA sans aucune insertion de sgRNA a été injectée. Les souris ont ensuite été sacrifiées pour isolement SC et analyse après huit semaines (Fig. S8a). L'efficacité de l'édition d'ADN réussie a été confirmée pour les quatre TF (Fig. 8b–e); systématiquement, l'inactivation (KD) de chaque protéine à divers degrés (52.4% à 83.6%) a été détectée par WB (Fig. 7b–e) ou IF (Fig. 8f) malgré des niveaux d'ARNm inchangés (Fig. 8g).
Pour examiner l'effet de l'AP-1 TF KD ci-dessus sur l'activation de SC, les FISC de chaque mutant ont été cultivés pour un test EdU in vitro (Fig. 8a). Semblable à Atf3 KO, le Fos-Les cellules KD ont montré une activation SC accélérée tandis que les juinB-KD a affiché une activation émoussée ; le Atf4 or FosB-KD, en revanche, n'a eu aucun impact (Fig. 8h). Lors de la mesure des cellules Pax7 + sur les muscles non blessés d'environ 2 mois, il est intéressant de noter que des nombres réduits ont été observés sur le Atf4, Fos or JuinB-KD (Fig. 8i), suggérant une perte du pool de SC. Depuis le Atf4 or JuinB-KD n'a pas conduit à une activation précoce du SC, la perte du nombre de SC peut être causée par d'autres raisons étant donné que la suppression s'est produite très tôt dans la phase postnatale64L’ FosB-KD n'a eu aucun impact sur le pool Pax7+ SC.
Pour étudier plus avant l'impact sur la capacité de régénération musculaire, BaCl2 a été injecté 7 semaines après l'injection d'AAV (Fig. 8a) et la régénération a été évaluée par H&E (Fig. 8j), eMyHC (Fig. 8k), Pax7 (Fig. 8l) et MyoD (Fig. 8m) coloration à 5 dpi. Une régénération altérée a été révélée dans le Atf4 ainsi que Fos-KD vraisemblablement en raison de l'épuisement des SC après sa suppression à long terme ; La régénération dans le juinB-KD a également été compromis probablement en raison d'un pool de SC réduit ; systématiquement, aucun impact sur la régénération n'a été observé dans FosB-KD. Au total, nos résultats indiquent que ces membres de la famille AP-1 peuvent jouer diverses fonctions dans l'activation du SC et la régénération musculaire.
- Contenu propulsé par le référencement et distribution de relations publiques. Soyez amplifié aujourd'hui.
- PlatoData.Network Ai générative verticale. Autonomisez-vous. Accéder ici.
- PlatoAiStream. Intelligence Web3. Connaissance Amplifiée. Accéder ici.
- PlatonESG. Automobile / VE, Carbone, Technologie propre, Énergie, Environnement, Solaire, La gestion des déchets. Accéder ici.
- PlatoHealth. Veille biotechnologique et essais cliniques. Accéder ici.
- GraphiquePrime. Élevez votre jeu de trading avec ChartPrime. Accéder ici.
- Décalages de bloc. Modernisation de la propriété des compensations environnementales. Accéder ici.
- La source: https://www.nature.com/articles/s41467-023-40465-w