Monsieur le rédacteur,
Les caractéristiques biologiques uniques des chauves-souris, notamment la longévité, les propriétés antivirales, l’hibernation et l’écholocation, ont retenu l’attention de la communauté scientifique. Pour améliorer l'utilisation des chauves-souris dans l'expérimentation biologique, les chercheurs ont entrepris des efforts pour générer des cellules souches pluripotentes induites (iPSC) à partir de fibroblastes de chauves-souris.1,2. Cependant, il reste incertain si les iPSC sans transgène peuvent se différencier in vivo, ce qui indique un degré élevé de qualité des cellules souches et élargit considérablement leur potentiel pour diverses applications.
Pour générer des iPSC sans transgène, des fibroblastes embryonnaires de chauve-souris (BEF) de Myotis Lucifugus ont été transfectés avec un ensemble de 8 facteurs de reprogrammation (OCT4, SOX2, cMYC, KLF4, NANOG, LIN28, NR5A2Et un miR302/367 cluster) dans le milieu 3i/LIF contenant des inhibiteurs de petites molécules (PD0325901, CHIR99021 et A8301) (Fig. 1a, b). Suite à une sélection positive (néomycine) et négative (thymidine kinase) des CSPi, des cellules monoclonales ont été sélectionnées pour la détection de facteurs exogènes. Nous avons utilisé 20 ensembles de paires d'amorces pour amplifier la séquence du plasmide3. Les résultats ont montré que deux clones iPSC sans transgène ont été obtenus (Fig. 1c).
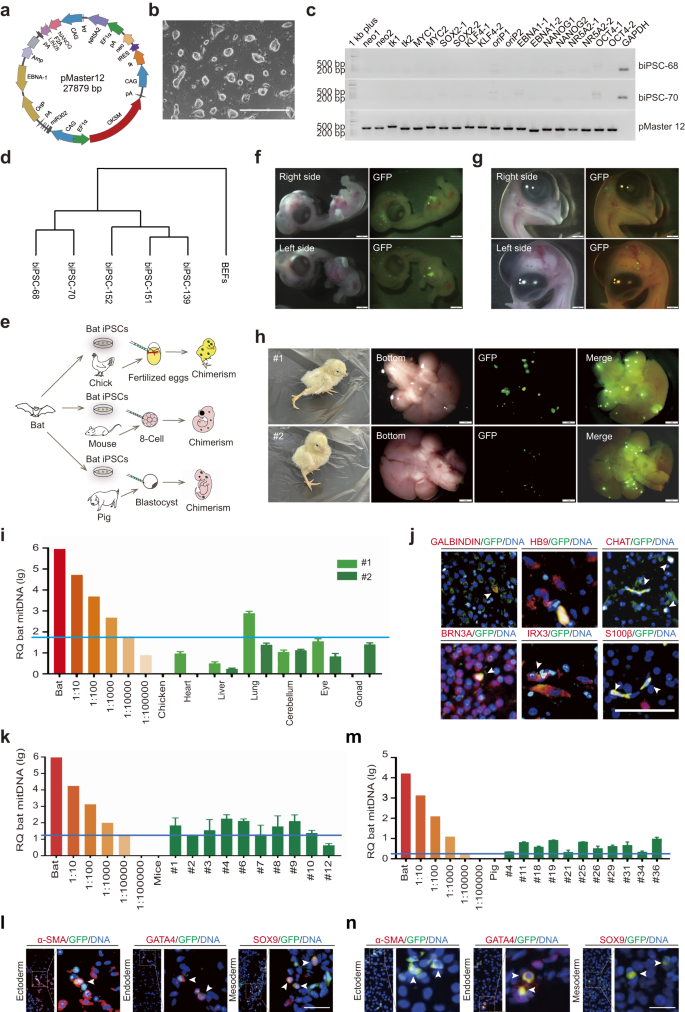
a Diagramme schématique du vecteur inductible, pMaster12, codant pour 8 facteurs de reprogrammation avec des gènes de sélection positifs/négatifs. b Image des biPSC ; barre d'échelle, 1000 µm. c L'analyse PCR a confirmé l'absence de séquences du vecteur pMaster12 dans biPSC-68 et biPSC-70. GAPDH a été utilisé comme gène de référence interne et l'ADN pMaster12 purifié a servi de contrôle positif. d Regroupement de dendrogrammes de profils d'expression génique : BEF, transgènes et biPSC sans transgène. e Modèle illustratif : les biPSC sans transgène génèrent des chimères interspécifiques (souris, porc, poussin) in vivo. f Images représentatives d’embryons chimériques de chauve-souris/poussin D6.5 avec fluorescence GFP dans la tête/poitrine. Barres d'échelle, 1 mm. g Images représentatives d’embryons chimériques de chauve-souris/poussin D9.5 présentant une fluorescence GFP dans la tête. Barres d'échelle, 1 mm. h Images représentatives de chimères interspécifiques de naissance vivante de chauve-souris/poussin 3 jours après la naissance, montrant la fluorescence de la GFP dans la tête. Barres d'échelle, 1 mm. i Analyse PCR génomique quantitative de l'ADNmt de chauve-souris chez des poussins néonatals chimériques (#1 et #2). Des dilutions de cellules de chauve-souris et de poussin ont été utilisées pour l'analyse. La ligne bleue représente le niveau de détection de l’ADNmt de chauve-souris (1 cellule de chauve-souris pour 10,000 XNUMX cellules de poulet). j Images représentatives de coloration IF de la tête de la chimère chauve-souris/poussin #2, montrant une coloration positive pour les marqueurs neuronaux (GALBINDIN, HB9, CHAT, BRN3A, IRX3, S100β). Les flèches blanches indiquent les cellules positives pour la GFP et les marqueurs neuronaux. Barres d'échelle, 50 μm. k Analyse PCR génomique quantitative de l'ADNmt de chauve-souris dans les tissus d'embryons de souris chimériques E8.5 à l'aide de dilutions de cellules de chauve-souris et de souris. La ligne bleue représente le niveau de détection de l’ADNmt de chauve-souris (1 cellule de chauve-souris pour 10,000 XNUMX cellules de souris). l Images représentatives de coloration IF montrant l’intégration de biPSC exprimant la GFP dans les couches germinales de souris. Les flèches blanches indiquent les cellules positives pour la GFP et les marqueurs de lignée (α-SMA, GATA4, SOX9). Barre d'échelle, 50 µm. m Analyse PCR génomique quantitative de l'ADNmt de chauve-souris dans des embryons de porc chimériques E25 à l'aide de dilutions de cellules de chauve-souris et de porc. La ligne bleue représente le niveau de détection de l’ADNmt de chauve-souris (1 cellule de chauve-souris pour 10,000 XNUMX cellules porcines). n Images représentatives de coloration IF montrant l’intégration de biPSC exprimant la GFP dans les couches germinales de porc. Les flèches blanches indiquent les cellules doublement positives pour la GFP et les marqueurs de lignée (α-SMA, GATA4, SOX9). Barre d'échelle, 50 µm.
Nos iPSC de chauve-souris (biPSC) exprimaient des marqueurs de pluripotence à la fois au niveau de l'ARN et des protéines (Fig. S1a,b). Pour confirmer la pluripotence, nous avons transfecté les biPSC avec hOCT4-GFP et les cellules présentaient une expression brillante de la GFP (Fig. S1c), indiquant le maintien de la pluripotence dans les biPSC. Les biPSC présentaient une coloration positive à la phosphatase alcaline (AP) et maintenaient un caryotype normal (42 + XY) après 37 passages (Fig. S1d,e). Ils pourraient être cultivés sur Matrigel dans des conditions sans nourriture (Fig. S2a-c). In vitro, les biPSC pourraient former des corps embryonnaires puis se différencier en trois couches germinales embryonnaires (Fig. S3a,b). L'analyse du séquençage de l'ARN a révélé un regroupement distinct de l'expression des gènes entre les biPSC et les BEF (Fig. 1d), avec une expression élevée de gènes de pluripotence dans les biPSC (Fig. S3c). Ces résultats suggèrent que les biPSC sont exemptes de transgènes et pluripotentes.
Pour évaluer le chimérisme et la capacité de développement des biPSC, nous avons étiqueté les biPSC avec GFP/tdTomato (Fig. S4a–d) pour le suivi des cellules. Les embryons de poulet ont été sélectionnés comme plate-forme pour les études de chimérisme cellulaire hétérologue en raison de leur facilité de manipulation. Nous avons injecté 5 × 105 Les biPSC marquées au GFP dans les vaisseaux sanguins des embryons de poulet fécondés 52 h après l'éclosion (Fig. 1e). Au jour 6.5 (J6.5), une fluorescence verte significative a été observée dans la tête et la poitrine des embryons de poulet chimériques (Fig. 1f), confirmé par coloration GFP sur des coupes en paraffine (Fig. S5a). La co-coloration de sections d'embryons de poulet chimériques avec des marqueurs de GFP et de couche germinale a confirmé l'intégration de biPSC différenciées dans les trois couches germinales (Fig. S5b). À J9.5, la fluorescence verte était limitée à la tête des poussins chimériques (Fig. 1g).
Deux poussins chimériques vivants ont été obtenus après incubation et une fluorescence significative de la GFP a été observée dans leur cerveau (Fig. 1h). Pour déterminer les proportions chimériques dans d'autres organes, nous avons effectué une analyse de l'ADN mitochondrial (ADNmt). Nos résultats ont indiqué un degré variable de chimérisme dans différents tissus, allant de 1/100,000 1 à 1000/1 10,000. Nous avons détecté l'intégration de cellules vertes dans les gonades des poussins chimériques, un poussin ne présentant aucun chimérisme et l'autre présentant un chimérisme inférieur à XNUMX/XNUMX XNUMX (Fig. 1i). De plus, la coloration par immunofluorescence (IF) des coupes cérébrales en paraffine (#2) a démontré la différenciation des biPSC en différents types de cellules neuronales (Fig. 1j). Ces résultats suggèrent que les biPSC peuvent se différencier en cellules neuronales fonctionnelles dans le modèle chimérique du poussin.
Pour examiner le potentiel de formation de chimères des biPSC dans deux modèles de mammifères différents, la souris et le porc, nous avons d'abord introduit 10 biPSC marquées par la GFP dans des embryons de souris au stade cellulaire 8 à 16. Parmi eux, 98.09 % des embryons injectés présentaient une fluorescence GFP significative, avec une moyenne de 17.78 ± 0.95 biPSC par blastocyste (Fig. S6a-c). Les biPSC intégrées dans la masse cellulaire interne (ICM) des blastocystes chimériques, avec une moyenne de 2.93 ± 0.37 cellules par ICM (Fig. S6d,e). Nous avons également évalué l'intégration des biPSC dans le trophectoderme de souris, révélant leur contribution à la fois à l'ICM et au trophectoderme (Fig. S7a). Notamment, les biPSC individuelles présentaient une prolifération robuste au sein des embryons de souris, avec 31.25 % des embryons chimériques présentant une prolifération unicellulaire (Fig. S7b et table S1). De plus, la co-injection de biPSC marquées par tdTomato et de cellules souches embryonnaires de souris (mesC) marquées par GFP a entraîné un chevauchement spatial des signaux de fluorescence rouge et vert (Fig. S7c), suggérant un potentiel de développement partagé entre les biPSC et les mESC au sein du microenvironnement embryonnaire.
Ensuite, nous avons évalué le potentiel chimérique des biPSC dans des embryons de souris post-implantatoires (Fig. 1e). Nous avons implanté 553 blastocystes chimériques dérivés de biPSC marquées par la GFP dans 33 souris porteuses. Des grossesses réussies ont eu lieu et des embryons chimériques ont été collectés au jour embryonnaire 8.5 (E8.5). Le chimérisme a été confirmé par PCR génomique avec des amorces spécifiques aux chauves-souris (Fig. S8a), et l'analyse de l'ADNmt a révélé des proportions élevées de chimérisme chez 8 fœtus sur 10, dont 3 dépassaient 1/1000 (Fig. 1k). Le test IF à E10.5 a montré une expression significative de la GFP dans des échantillons chimériques (Fig. S8b), avec la co-expression de GFP et de marqueurs de lignée indiquant la différenciation des biPSC dans les trois couches germinales dans les embryons de souris chimériques (Fig. 1l). Nos résultats démontrent le potentiel chimérique remarquable des biPSC dans les premiers embryons de souris, bien que ce potentiel puisse diminuer à mesure que le développement de la souris progresse, et nous ne parvenons donc pas à obtenir des chimères interspécifiques néonatales.
Nous avons ensuite exploré le potentiel chimérique des biPSC chez les embryons porcins. Des biPSC marquées par la GFP ont été injectées dans des embryons parthénogéniques porcins E5. Parmi les embryons injectés, 92.79 % présentaient une fluorescence GFP, avec une moyenne de 14.14 ± 1.14 biPSC par blastocyste (Fig. S9a-c). La coloration IF a démontré la contribution des biPSC à l'ICM, avec une moyenne de 3.78 ± 0.31 biPSC par ICM (Fig. S9d,e). Ces résultats mettent en évidence la viabilité et la capacité d’intégration des biPSC dans l’ICM des premiers embryons de porc.
Nous avons également évalué le potentiel chimérique des biPSC dans des embryons porcins post-implantatoires. Nous avons transplanté 610 blastocystes chimériques fécondés in vitro dans 4 truies porteuses. Les 4 mères porteuses sont tombées enceintes, ce qui a donné un total de 39 embryons collectés entre E25 et E27. Le génotypage de l'ADNmt a confirmé 11 embryons comme chimères, avec un chimérisme des biPSC dépassant 1/10,000 XNUMX (Fig. 1m). La coloration IF avec l'anticorps GFP sur des sections de ces embryons chimériques a en outre confirmé la présence de cellules de chauve-souris (Fig. S10). La coloration IF des marqueurs de lignée a démontré la différenciation des biPSC dans les trois couches germinales embryonnaires au sein des embryons de porc chimères (Fig. 1n). Ces résultats suggèrent que les biPSC présentent une efficacité chimérique plus élevée dans les premiers embryons de porc et possèdent la capacité de se différencier en trois couches germinales in vivo.
Dans cette étude, nous avons observé une intégration réussie des biPSC dans des embryons préimplantatoires de souris et de porc. Cependant, le chimérisme observé dans les embryons post-implantatoires était limité, ce qui peut être influencé par des facteurs tels que la distance évolutive, la période de gestation et la compétition cellulaire. Des études antérieures ont montré que les CSE de rat et les iPSC de souris étaient incapables de contribuer aux embryons de porc et que la contribution des CSP humaines aux embryons post-implantatoires de porc était très limitée.4. Cette limitation peut être attribuée à la distance évolutive entre les espèces5. La divergence évolutive entre les chauves-souris et les souris, estimée s'être produite il y a environ 94 et 81 millions d'années (http://www.timetree.org/), respectivement, peuvent affecter de manière significative l’efficacité du xénochimérisme.
Dans cette étude, le taux de chimérisme le plus élevé et la génération réussie de poussins chimériques vivants ont été observés lorsque des biPSC ont été injectées dans des embryons de poulet. Les poussins chimériques ont présenté une différenciation des biPSC en cellules fonctionnelles du système nerveux, fournissant des informations précieuses sur le développement et la différenciation des biPSC chez les hôtes hétérologues. L'embryon de poulet est un modèle expérimental bien établi pour les xénogreffes, offrant un système pratique pour étudier le développement et la différenciation embryonnaires.6. L'embryon de poulet constitue un système d'évaluation efficace du potentiel de développement in vivo des xénocellules, car des études antérieures ont démontré la pluripotence des CSP humaines dans les embryons de poulet.7. L'efficacité accrue de la chimère chauve-souris/poussin peut être due au nombre initial de cellules injectées plus élevé et au système immunitaire non complètement développé chez les embryons de poulet.8, ce qui a entraîné une réduction du rejet de cellules exogènes. Un chimérisme gonadique limité était dû à l'injection à un stade de développement plus avancé (HH14 – HH15) par rapport à celui au stade du blastocyste. Tester différentes étapes, sites et méthodes d'injection dans des études futures pourrait améliorer les résultats du chimérisme.
Dans l’ensemble, nous avons généré des biPSC sans transgène par électroporation de plasmides épisomaux. Ces biPSC présentaient un potentiel chimérique chez trois animaux modèles. Les iPSC sans transgène sont de meilleure qualité, car elles ne présentent pas de biais de différenciation de lignée cellulaire et évitent le risque de formation de tumeurs et de mort chez les descendants chimériques.9,10,11. Ils peuvent également se différencier en un large spectre de types cellulaires ou organoïdes12 dans des conditions appropriées. Nos biPSC ont le potentiel de se différencier en organoïdes pertinents in vitro, permettant des enquêtes mécanistes sur la longévité des chauves-souris, la défense antivirale et l'écholocation.
- Contenu propulsé par le référencement et distribution de relations publiques. Soyez amplifié aujourd'hui.
- PlatoData.Network Ai générative verticale. Autonomisez-vous. Accéder ici.
- PlatoAiStream. Intelligence Web3. Connaissance Amplifiée. Accéder ici.
- PlatonESG. Automobile / VE, Carbone, Technologie propre, Énergie, Environnement, Solaire, La gestion des déchets. Accéder ici.
- PlatoHealth. Veille biotechnologique et essais cliniques. Accéder ici.
- GraphiquePrime. Élevez votre jeu de trading avec ChartPrime. Accéder ici.
- Décalages de bloc. Modernisation de la propriété des compensations environnementales. Accéder ici.
- La source: https://www.nature.com/articles/s41421-023-00587-3