Le dernier mammouth laineux parcourait la vaste toundra arctique il y a 4,000 XNUMX ans. Leurs gènes perdurent encore aujourd’hui chez un animal majestueux : l’éléphant d’Asie.
Avec 99.6 % de similarité dans leur constitution génétique, les éléphants d’Asie sont le point de départ idéal pour un plan audacieux visant à ramener le mammouth – ou quelque chose qui s’en rapproche – de l’extinction. Le projet, lancé par une société de biotechnologie Colossal en 2021, a fait sourciller pour son objectif lunaire.
Le playbook global semble simple.
La première étape consiste à séquencer et comparer les génomes du mammouth et de l’éléphant. Ensuite, les scientifiques identifieront les gènes à l’origine des caractéristiques physiques (poils longs, dépôts graisseux) qui permettaient aux mammouths de prospérer à des températures glaciales, puis les inséreront dans des cellules d’éléphants grâce à l’édition génétique. Enfin, l’équipe transférera le noyau – qui abrite l’ADN – des cellules modifiées dans un œuf d’éléphant et implantera l’embryon dans un substitut.
Le problème? Les éléphants d'Asie sont en voie de disparition et leurs cellules, notamment leurs œufs, sont difficiles à trouver.
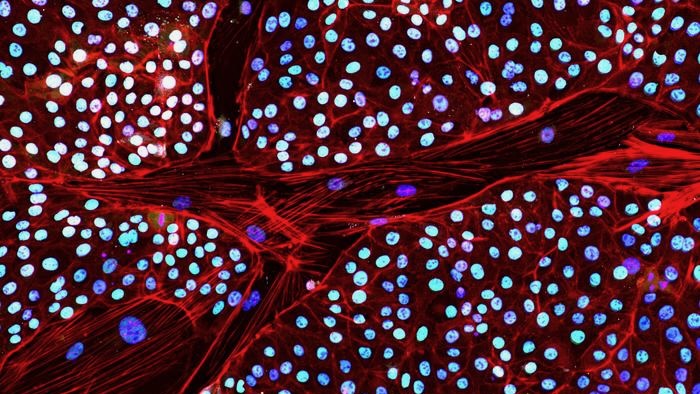
La semaine dernière, l'entreprise a signalé une solution de contournement majeure. Pour la première fois, ils ont transformé des cellules de peau d’éléphant en cellules souches, chacune ayant le potentiel de devenir n’importe quelle cellule ou tissu du corps.
Cette avancée facilite la validation des résultats de l’édition génétique en laboratoire avant de s’engager dans une éventuelle grossesse, qui dure jusqu’à 22 mois pour les éléphants. Les scientifiques pourraient, par exemple, inciter les cellules souches d’éléphant à devenir des cellules ciliées et tester les modifications génétiques qui confèrent au mammouth son pelage épais et chaud emblématique.
Ces cellules souches pluripotentes induites, ou iPSC, ont été particulièrement difficiles à fabriquer à partir de cellules d'éléphant. Les animaux « sont une espèce très spéciale et nous commençons tout juste à effleurer la surface de leur biologie fondamentale », a affirmé Valérie Plante. Le Dr Eriona Hysolli, qui dirige les biosciences chez Colossal, dans un communiqué de presse.
Parce que cette approche ne nécessite qu’un échantillon de peau d’éléphant d’Asie, elle contribue grandement à protéger les espèces menacées. La technologie pourrait également soutenir la conservation des éléphants vivants en proposant des programmes de reproduction avec des œufs artificiels fabriqués à partir de cellules cutanées.
« Les éléphants pourraient recevoir le prix « le plus difficile à reprogrammer » » a affirmé Valérie Plante. Dr George Church, généticien de Harvard et cofondateur de Colossal, « mais apprendre comment le faire de toute façon aidera de nombreuses autres études, en particulier sur les espèces menacées. »
Retourner l'horloge
Il y a près de vingt ans, le biologiste japonais Shinya Yamanaka a révolutionné la biologie en restaurant les cellules matures à un état semblable à celui des cellules souches.
Démontrée pour la première fois chez la souris, la technique lauréate du prix Nobel ne nécessite que quatre protéines, appelées ensemble facteurs Yamanaka. Les cellules reprogrammées, souvent dérivées de cellules de la peau, peuvent se développer en une gamme de tissus grâce à un guidage chimique supplémentaire.
Les cellules souches pluripotentes induites (CSPi), comme on les appelle, ont transformé la biologie. Ils sont essentiels au processus de construction des organoïdes cérébraux (des boules miniatures de neurones qui scintillent d'activité) et peuvent être amenés à former des ovules ou des modèles d'embryons précoces. embryons humains.
La technologie est bien établie pour les souris et les humains. Ce n’est pas le cas des éléphants. "Dans le passé, une multitude de tentatives visant à générer des iPSC d'éléphants n'ont pas abouti", a déclaré Hysolli.
La plupart des cellules d’éléphants sont mortes lorsqu’elles ont été traitées avec la recette standard. D’autres se sont transformées en cellules sénescentes « zombies » – vivantes mais incapables de remplir leurs fonctions biologiques habituelles – ou ont peu changé par rapport à leur identité d’origine.
Des recherches plus approfondies ont permis de découvrir le coupable : une protéine appelée TP53. Connue pour sa capacité à combattre le cancer, cette protéine est souvent surnommée le gardien génétique. Lorsque le gène TP53 est activé, la protéine pousse les cellules précancéreuses à s'autodétruire sans nuire à leurs voisines.
Malheureusement, TP53 entrave également la reprogrammation iPSC. Certains des facteurs Yamanaka imitent les premiers stades de croissance du cancer, ce qui pourrait provoquer l’autodestruction des cellules modifiées. Les éléphants possèdent 29 copies du gène « protecteur ». Ensemble, ils pourraient facilement écraser les cellules présentant un ADN muté, y compris celles dont les gènes ont été modifiés.
"Nous savions que la p53 allait être un gros problème", a déclaré Church dit le .
Pour contourner le gardien, l’équipe a conçu un cocktail chimique pour inhiber la production de TP53. Avec une dose ultérieure de facteurs de reprogrammation, ils ont pu fabriquer les premières CSPi d'éléphant à partir de cellules cutanées.
Une série de tests a montré que les cellules transformées semblaient et se comportaient comme prévu. Ils possédaient des gènes et des marqueurs protéiques souvent observés dans les cellules souches. Lorsqu’on les laisse se développer davantage en un groupe de cellules, elles forment une structure à trois couches essentielle au développement précoce de l’embryon.
«Nous attendions ces choses désespérément», déclare Church dit Nature. L'équipe a publié ses résultats, qui n'ont pas encore été évalués par des pairs, sur le serveur de prépublication bioRxiv.
Longue route à venir
Le manuel actuel de l'entreprise pour ramener le mammouth repose sur les technologies de clonage, et non sur les iPSC.
Mais les cellules sont précieuses en tant que substituts aux ovules ou même aux embryons d’éléphants, permettant aux scientifiques de poursuivre leurs travaux sans nuire aux animaux en voie de disparition.
Ils pourraient, par exemple, transformer les nouvelles cellules souches en ovules ou en spermatozoïdes – un exploit jusqu’à présent. atteint uniquement chez la souris-pour une édition génétique plus poussée. Une autre idée est de les transformer directement en structures embryonnaires équipées de gènes de mammouth.
L'entreprise envisage également de développer utérus artificiels pour aider à nourrir les embryons modifiés et potentiellement les mener à terme. En 2017, un utérus artificiel a donné naissance à un agneau en bonne santé, et les utérus artificiels sont désormais disponibles. Vers des essais sur l'homme. Ces systèmes réduiraient le besoin de substituts d’éléphants et éviteraient de mettre en danger leurs cycles de reproduction naturels.
Comme l’étude est une prépublication, ses résultats n’ont pas encore été vérifiés par d’autres experts dans le domaine. De nombreuses questions demeurent. Par exemple, les cellules reprogrammées conservent-elles leur statut de cellules souches ? Peuvent-ils être transformés en plusieurs types de tissus à la demande ?
Faire revivre le mammouth est le but ultime de Colossal. Mais le Dr Vincent Lynch de l'Université de Buffalo, qui tente depuis longtemps de fabriquer des CSPi à partir d'éléphants, pense que les résultats auraient pu une portée plus large.
Les éléphants sont remarquablement résistants au cancer. Personne ne sait pourquoi. Étant donné que les CSPi de l'étude sont dépourvues du TP53, un gène protecteur contre le cancer, elles pourraient aider les scientifiques à identifier le code génétique qui permet aux éléphants de combattre les tumeurs et potentiellement inspirer de nouveaux traitements pour nous également.
Ensuite, l’équipe espère recréer des caractéristiques de mammouth, telles que les cheveux longs et les dépôts graisseux, dans des modèles cellulaires et animaux fabriqués à partir de cellules d’éléphant génétiquement modifiées. Si tout se passe bien, ils emploieront une technique comme celle utilisée pour cloner la brebis Dolly pour donner naissance aux premiers veaux.
La question de savoir si ces animaux peuvent être appelés mammouths reste encore un sujet de débat. Leur génome ne correspondra pas exactement à celui des espèces disparues. De plus, la biologie et le comportement des animaux dépendent fortement des interactions avec l’environnement. Notre climat a radicalement changé depuis la disparition des mammouths, il y a 4,000 XNUMX ans. La toundra arctique, leur ancienne demeure, fond rapidement. Les animaux ressuscités peuvent-ils s'adapter à un environnement pour lequel ils n'étaient pas adaptés ?
Les animaux apprennent aussi les uns des autres. Sans un mammouth vivant pour montrer à un veau comment être un mammouth dans son habitat naturel, il pourrait adopter un ensemble de comportements complètement différents.
Colossal a un plan général pour s’attaquer à ces questions difficiles. En attendant, les travaux permettront au projet d'avancer sans mettre les éléphants en danger, selon Église.
"C'est une étape capitale" a affirmé Valérie Plante. Ben Lamm, cofondateur et PDG de Colossal. « Chaque étape nous rapproche de nos objectifs à long terme consistant à ramener cette espèce emblématique. »
Crédit image: Biosciences colossales
- Contenu propulsé par le référencement et distribution de relations publiques. Soyez amplifié aujourd'hui.
- PlatoData.Network Ai générative verticale. Autonomisez-vous. Accéder ici.
- PlatoAiStream. Intelligence Web3. Connaissance Amplifiée. Accéder ici.
- PlatonESG. Carbone, Technologie propre, Énergie, Environnement, Solaire, La gestion des déchets. Accéder ici.
- PlatoHealth. Veille biotechnologique et essais cliniques. Accéder ici.
- La source: https://singularityhub.com/2024/03/12/colossal-creates-elephant-stem-cells-for-the-first-time-in-quest-to-revive-the-woolly-mammoth/



