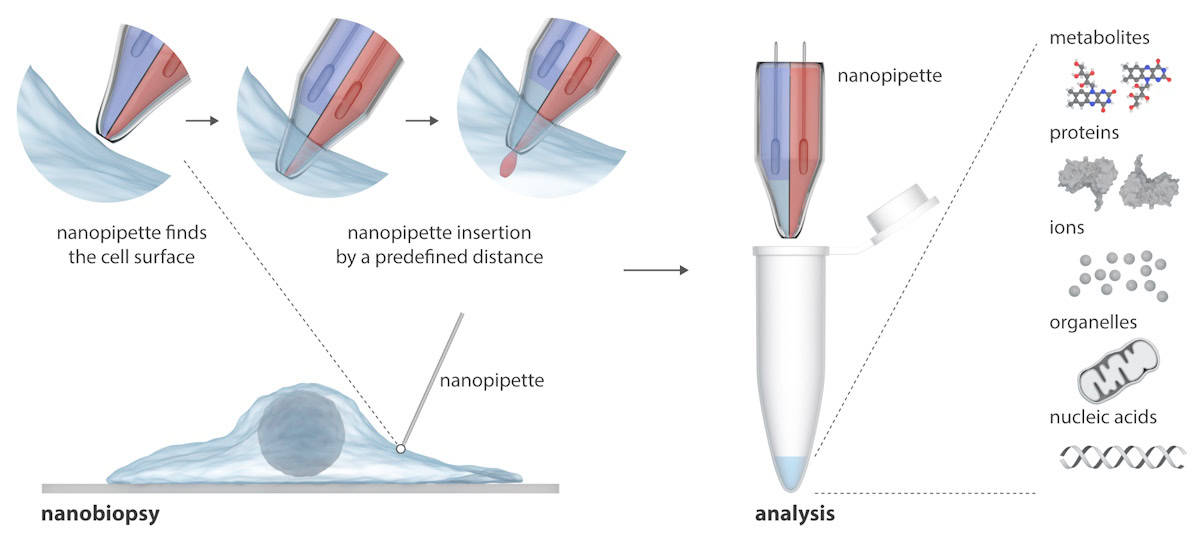
گلیوبلاستوما (GBM) کشنده ترین و تهاجمی ترین شکل سرطان مغز است. تقریباً همه تومورها پس از درمان عود میکنند، زیرا سلولهای زندهمانده در طول زمان به اشکال انعطافپذیرتر تبدیل میشوند تا در برابر درمانهای بیشتر مقاومت کنند. برای مقابله با این چالش، دانشمندان در دانشگاه لیدز یک نانوپیپت جدید دو بشکه ای طراحی کرده اند و از آن برای بررسی مسیر تک تک سلول های زنده GBM هنگام تغییر در پاسخ به درمان استفاده کرده اند.
نانوپیپت از دو سوزن نانوسکوپی تشکیل شده است که می تواند همزمان مولکول های اگزوژن را به داخل سلول تزریق کرده و نمونه های سیتوپلاسم را از آن استخراج کند. این نانوپیپت در یک میکروسکوپ رسانایی یونی روبشی (SICM) برای انجام نانوبیوپسی سلولهای زنده در فرهنگ ادغام میشود. برخلاف تکنیکهای موجود برای مطالعه سلولهای منفرد، که معمولاً سلول را تخریب میکنند، نانوپیپت میتواند نمونهبرداریهای مکرر از یک سلول زنده را بدون کشتن آن انجام دهد و مطالعات طولی رفتار یک سلول را در طول زمان ممکن میسازد.
نوشتن در با پیشرفتهای علمیمحققان توضیح میدهند که SICM با اندازهگیری جریان یونی بین یک الکترود وارد شده در یک نانوپیپت شیشهای و یک الکترود مرجع غوطهور در محلول الکترولیتی حاوی سلولها کار میکند. نانوبیوپسی زمانی انجام می شود که پس از اعمال ولتاژ بین دو الکترود، جریان یونی از طریق نانوحفره در نوک نانوپیپت جریان یابد. در نانوپیپت دو بشکه ای آنها، یک بشکه به عنوان یک سرنگ الکتروشیمیایی برای انجام استخراج سیتوپلاسمی عمل می کند. دومی حاوی یک محلول الکترولیت آبی است که جریان یونی پایداری را برای تعیین موقعیت دقیق و تزریق نانو قبل از نانوبیوپسی فراهم می کند.
پلت فرم نیمه خودکار استخراج حجم فمتولیتر سیتوپلاسم و تزریق همزمان به سلول های منفرد را امکان پذیر می کند. این پلتفرم موقعیتیابی خودکار نانوپیپت را با استفاده از کنترل بازخورد فراهم میکند (جریان یونی با نزدیک شدن نانوپیپت به نمونه کاهش مییابد)، در حالی که تشخیص نشانههای جریان خاص نشاندهنده نفوذ موفقیتآمیز غشای یک سلول است.
مطالعات طولی
به عنوان اثبات مفهوم توانایی این پلتفرم، محققان نانوبیوپسی طولی سلول GBM (و فرزندان آن) را انجام دادند و تغییرات بیان ژن را طی 72 ساعت مشخص کرد. آنها قبل از درمان، در طول درمان با رادیوتراپی و شیمی درمانی و پس از درمان، نانوبیوپسی را انجام دادند.
محققین اصلی می نویسند: "روش ما قوی و قابل تکرار است و اجازه نفوذ به غشاء و تزریق نانو در انواع سلول های مختلف با خواص مکانیکی متمایز را می دهد." لوسی استید و پائولو اکتیس. میانگین میزان موفقیت تزریق نانو 0.89 ± 0.07 است. سپس mRNA داخل سلولی استخراج می شود.
محققان پاسخ سلول های GBM را به تیمار استاندارد 2 گری پرتو و 30 میکرومولار تموزولومید بررسی کردند. آنها به صورت بصری سلولهای منفرد و فرزندان آنها را در طول 72 ساعت ردیابی کردند، با 98٪ باقی مانده در میدان دید میکروسکوپ در طول این بازه زمانی - عامل مهمی برای انجام تجزیه و تحلیل طولی.

در روز اول، محققان بیوپسی کردند، رنگ فلورسنت تزریق کردند و از هر سلول تصویربرداری کردند. در روز دوم، نیمی از سلولها تحت پرتودرمانی و شیمیدرمانی قرار گرفتند، در حالی که بقیه سلولها به عنوان گروه کنترل عمل کردند. تمام سلول ها در روز 1 و 2 تصویربرداری شدند و بیوپسی شدند و دوباره در روز 2 تزریق شدند.
در سلول هایی که تحت نانوبیوپسی روز 1 قرار گرفتند، بقا بین سلول های تیمار شده و درمان نشده مشابه بود و نرخ تقسیم سلولی در دو گروه قابل مقایسه بود. پس از 72 ساعت، 63 درصد از سلول های کنترل درمان نشده (بیوپسی نشده) زنده ماندند، در مقایسه با 25 درصد از سلول های تحت درمان، بیوپسی. تفاوتی در میزان مرگ و میر بعدی زیرگروه های سلولی در روز اول، صرف نظر از درمان وجود نداشت. با این حال، نسبت بسیار بیشتری از سلولهای درماننشده در طول زمان، زیرگروه خود را تغییر دادند، یا نتاج با زیرگروه متفاوتی نسبت به سلولهای تیمار شده تولید کردند.
محققان می نویسند: «این نشان می دهد که سلول های درمان نشده در طول دوره زمانی سه روزه به طور قابل توجهی پلاستیک تر از سلول های درمان شده هستند. نمرات فنوتیپ سلولی در روز اول و نمونههای طولی جفت نشان داد که سلولهای تیمار شده تمایل دارند فنوتیپ یکسانی را در طول درمان حفظ کنند، در حالی که سلولهای درماننشده بیشتر احتمال دارد حالت رونویسی را در طی 1 ساعت تغییر دهند، که نشان میدهد که درمان باعث ایجاد ثبات رونویسی بالا یا انتخاب میشود. در این خط تلفن ثابت GBM.
استید می گوید: «این یک پیشرفت مهم است. «این اولین بار است که ما فناوریای داریم که در آن میتوانیم تغییراتی را که پس از درمان اتفاق میافتد، به جای فرض کردن آنها، رصد کنیم. این نوع فناوری لایهای از درک را ارائه میکند که قبلاً هرگز نداشتیم. و این درک و بینش جدید منجر به سلاح های جدیدی در اسلحه خانه ما در برابر انواع سرطان خواهد شد.
نانو جراحی مکانیکی به سرطان تهاجمی مغز حمله می کند
این تیم متقاعد شده است که توانایی این نانوکاوشگرهای همه کاره برای دسترسی به محیط درون سلولی با حداقل اختلال، پتانسیل «انقلابی کردن تشخیص مولکولی، درمانهای ژنی و سلولی» را دارد.
Actis می گوید: "کار آینده ما بر افزایش توان عملیاتی فناوری متمرکز خواهد بود تا سلول های بیشتری را بتوان آنالیز کرد." دنیای فیزیک. ما در حال کار برای بهبود پروتکلهای تجزیه و تحلیل RNA استخراجشده از سلولها هستیم تا بتوان اطلاعات بیولوژیکی بیشتری را جمعآوری کرد. ما همچنین بسیار مشتاقیم که مدلهای بیولوژیکی پیشرفتهتر سرطان مغز را بر اساس سلولها و ارگانوئیدهای مشتق از بیمار مطالعه کنیم.»
- محتوای مبتنی بر SEO و توزیع روابط عمومی. امروز تقویت شوید.
- PlatoData.Network Vertical Generative Ai. به خودت قدرت بده دسترسی به اینجا.
- PlatoAiStream. هوش وب 3 دانش تقویت شده دسترسی به اینجا.
- PlatoESG. کربن ، CleanTech، انرژی، محیط، خورشیدی، مدیریت پسماند دسترسی به اینجا.
- PlatoHealth. هوش بیوتکنولوژی و آزمایشات بالینی. دسترسی به اینجا.
- منبع: https://physicsworld.com/a/single-cell-nanobiopsy-explores-how-brain-cancer-cells-adapt-to-resist-treatment/



