ویراستار عزیز،
ویژگیهای بیولوژیکی منحصربهفرد خفاشها، از جمله طول عمر، خواص ضد ویروسی، خواب زمستانی و پژواک، توجه قابل توجهی را از سوی جامعه علمی به خود جلب کرده است. برای افزایش استفاده از خفاش ها در آزمایش های بیولوژیکی، محققان تلاش هایی را برای تولید سلول های بنیادی پرتوان القایی (iPSCs) از فیبروبلاست خفاش انجام داده اند.1,2. با این حال، هنوز مشخص نیست که آیا iPSC های بدون تراریخته می توانند در داخل بدن تمایز پیدا کنند یا خیر، که نشان دهنده درجه بالایی از کیفیت سلول های بنیادی است و پتانسیل آنها را برای کاربردهای مختلف بسیار افزایش می دهد.
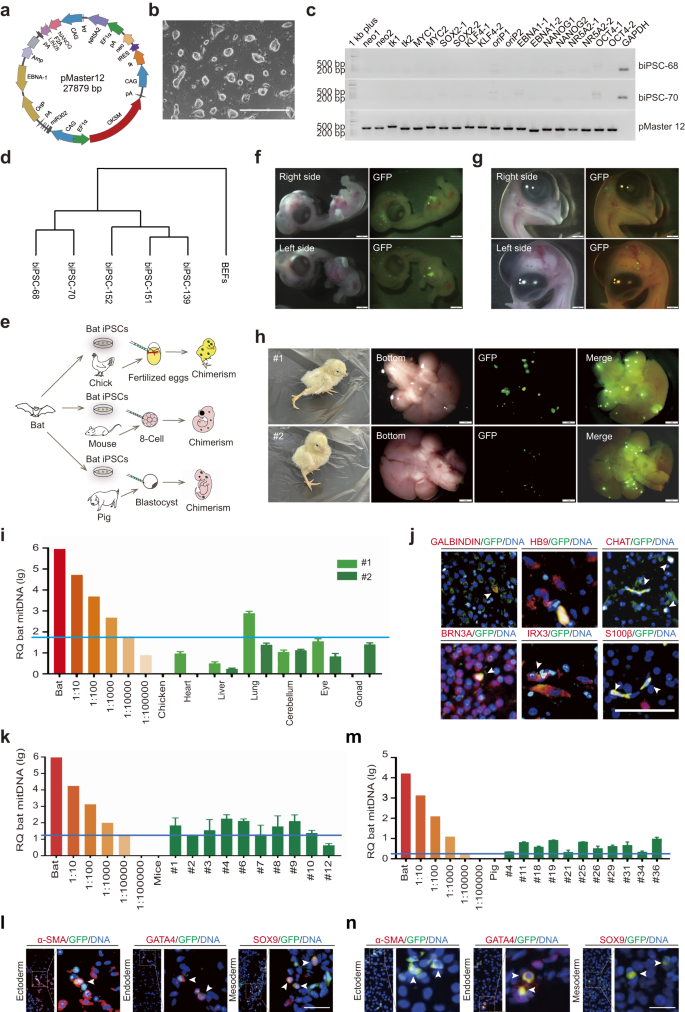
برای تولید iPSC های عاری از ژن، فیبروبلاست های جنینی خفاش (BEF) از میوتیس لوفیگوس با مجموعه ای از 8 فاکتور برنامه ریزی مجدد ترانسفکت شدند (OCT4, SOX2, cMYC, KLF4, NANOG, LIN28, NR5A2و miR302/367 خوشه) در محیط 3i/LIF حاوی بازدارنده های مولکولی کوچک (PD0325901، CHIR99021 و A8301) (شکل. 1a، b). پس از انتخاب مثبت (نئومایسین) و منفی (تیمیدین کیناز) iPSCها، سلولهای مونوکلونال برای تشخیص عوامل برونزا انتخاب شدند. ما از 20 مجموعه از جفت آغازگر برای تقویت توالی پلاسمید استفاده کردیم.3. نتایج نشان داد که دو کلون iPSC بدون ترانس ژن به دست آمد (شکل XNUMX). 1c).
a نمودار شماتیک وکتور القایی، pMaster12، رمزگذاری 8 فاکتور برنامه ریزی مجدد با ژن های انتخاب مثبت/منفی. b تصویر biPSCs; نوار مقیاس، 1000 میکرومتر. c تجزیه و تحلیل PCR عدم وجود توالی وکتور pMaster12 را در biPSC-68 و biPSC-70 تأیید کرد. GAPDH به عنوان ژن مرجع داخلی استفاده شد و DNA خالص pMaster12 به عنوان کنترل مثبت استفاده شد. d خوشهبندی دندروگرام پروفایلهای بیان ژن: BEFs، ترانس ژن و biPSCهای عاری از ژن. e مدل گویا: biPSCهای بدون تراریخته، واهی های بین گونه ای (موش، خوک، جوجه) را در داخل بدن تولید می کنند. f تصاویری از جنین های کایمریک خفاش/جوجه D6.5 با فلورسانس GFP در سر/سینه. میله های مقیاس، 1 میلی متر. g تصاویری از جنین های کایمریک خفاش/جوجه D9.5 که فلورسانس GFP را در سر نشان می دهد. میله های مقیاس، 1 میلی متر. h تصاویری از واهیهای بین گونهای تولد زنده خفاش/جوجه در 3 روز پس از تولد، که فلورسانس GFP را در سر نشان میدهد. میله های مقیاس، 1 میلی متر. i تجزیه و تحلیل کمی PCR ژنومی mtDNA خفاش در جوجه های نوزاد کایمریک (#1 و #2). رقت سلول خفاش-جوجه برای تجزیه و تحلیل استفاده شد. خط آبی نشان دهنده سطح تشخیص mtDNA خفاش است (1 سلول خفاش در هر 10,000 سلول جوجه). j تصاویر رنگآمیزی IF از سر کایمرا شماره 2 خفاش/جوجه، نشاندهنده رنگآمیزی مثبت برای نشانگرهای عصبی (GALBINDIN، HB9، CHAT، BRN3A، IRX3، S100β). فلشهای سفید سلولها را برای نشانگرهای GFP و عصبی مثبت نشان میدهند. میله های مقیاس، 50 میکرومتر. k تجزیه و تحلیل کمی PCR ژنومی mtDNA خفاش در بافت جنین موش کایمریک E8.5 با استفاده از رقت سلولی خفاش-موش. خط آبی نشان دهنده سطح تشخیص mtDNA خفاش است (1 سلول خفاش در هر 10,000 سلول موش). l تصاویر رنگ آمیزی IF که ادغام biPSCهای بیان کننده GFP را در لایه های جوانه موش نشان می دهد. فلشهای سفید سلولها را برای نشانگرهای GFP و دودمان مثبت نشان میدهند (α-SMA، GATA4، SOX9). نوار مقیاس، 50 میکرومتر. m تجزیه و تحلیل کمی PCR ژنومی mtDNA خفاش در جنین خوک کایمریک E25 با استفاده از رقت سلولی خفاش- خوک. خط آبی نشان دهنده سطح تشخیص mtDNA خفاش است (1 سلول خفاش در هر 10,000 سلول خوک). n تصاویر رنگآمیزی IF که ادغام biPSCهای بیانکننده GFP را در لایههای جوانه خوک نشان میدهد. فلشهای سفید نشانگر دو برابر مثبت بودن سلولها برای نشانگرهای GFP و دودمان (α-SMA، GATA4، SOX9) است. نوار مقیاس، 50 میکرومتر.
iPSCهای خفاش ما (biPSCs) نشانگرهای پرتوانی را هم در سطح RNA و هم در سطح پروتئین بیان میکنند (شکل تکمیلی. S1a، b). برای تایید پرتوانی، biPSCها را با h ترانسفکت کردیمOCT4-GFP و سلول ها بیان GFP روشن را نشان دادند (شکل تکمیلی. S1c) که نشان دهنده حفظ پرتوانی در biPSCها است. biPSCها رنگ آمیزی آلکالین فسفاتاز (AP) مثبت را نشان دادند و کاریوتیپ طبیعی (42 + XY) را پس از 37 پاساژ حفظ کردند (شکل تکمیلی. S1d، e). آنها را می توان روی ماتریژل در شرایط بدون فیدر کشت کرد (شکل تکمیلی XNUMX). S2a–c). در شرایط آزمایشگاهی، biPSCها می توانند اجسام جنینی تشکیل دهند و سپس به سه لایه جوانه جنینی تمایز پیدا کنند (شکل تکمیلی. S3a، b). تجزیه و تحلیل توالی یابی RNA، خوشه بندی مشخصی از بیان ژن را بین biPSCs و BEFs نشان داد (شکل XNUMX). 1d، با بیان بالای ژن های پرتوانی در biPSCها (شکل تکمیلی. S3c). این نتایج نشان می دهد که biPSCها عاری از ژن و پرتوان هستند.
برای ارزیابی کایمریسم و ظرفیت رشد biPSCها، ما biPSCها را با GFP/tdTomato برچسب گذاری کردیم (شکل تکمیلی. S4a–d) برای ردیابی سلول. جنین جوجه به دلیل سهولت دستکاری به عنوان بستری برای مطالعات کایمریزم سلولی هترولوگ انتخاب شد. ما 5×10 تزریق کردیم5 biPSC های نشاندار شده با GFP در رگ های خونی جنین جوجه بارور شده 52 ساعت پس از جوجه ریزی (شکل XNUMX). 1e). در روز 6.5 (D6.5)، فلورسانس سبز قابل توجهی در سر و قفسه سینه جنین جوجه کایمریک مشاهده شد (شکل. 1fبا رنگ آمیزی GFP بر روی مقاطع پارافین تایید شده است (شکل تکمیلی S5a). رنگ آمیزی همزمان مقاطع جنین جوجه کایمریک با نشانگرهای GFP و لایه جوانه ادغام biPSCهای تمایز یافته را در هر سه لایه جوانه تایید کرد (شکل تکمیلی XNUMX). S5b). تا D9.5، فلورسانس سبز به سر جوجههای کایمریک محدود شد (شکل XNUMX). 1g).
دو جوجه کایمریک زنده پس از انکوباسیون به دست آمد و فلورسانس GFP قابل توجهی در مغز آنها مشاهده شد (شکل XNUMX). 1h). برای تعیین نسبت های کایمریک در سایر اندام ها، تجزیه و تحلیل DNA میتوکندری (mtDNA) را انجام دادیم. نتایج ما درجه متفاوتی از کایمریزم را در بافتهای مختلف نشان داد که از 1/100,000 تا 1/1000 متغیر است. ما ادغام سلولهای سبز را در غدد جنسی جوجههای کایمریک تشخیص دادیم، با یکی از جوجهها هیچ کایمریستی و دیگری کمتر از 1/10,000 کایمریسم را نشان داد (شکل XNUMX). 1i). علاوه بر این، رنگآمیزی ایمونوفلورسانس (IF) برای بخشهای پارافین مغز (#2) تمایز biPSCs را به انواع مختلف سلولهای عصبی نشان داد (شکل XNUMX). 1j). این یافته ها نشان می دهد که biPSCها می توانند به سلول های عصبی عملکردی در مدل جوجه کایمریک تمایز پیدا کنند.
برای بررسی پتانسیل تشکیل کایمرا biPSCها در دو مدل پستانداران مختلف، موش و خوک، ابتدا 10 biPSC نشاندار شده با GFP را در مرحله 8 تا 16 سلولی به رویان موش معرفی کردیم. در میان آنها، 98.09 درصد از جنین های تزریق شده، فلورسانس GFP قابل توجهی را با میانگین 17.78 ± 0.95 biPSC در هر بلاستوسیست نشان دادند (شکل تکمیلی. S6a–c). biPSC ها در توده سلولی داخلی (ICM) بلاستوسیست های کایمریک، با میانگین 2.93 ± 0.37 سلول در هر ICM ادغام شده اند (شکل تکمیلی. S6d، e). ما همچنین ادغام biPSCها را در تروفکتودرم موش ارزیابی کردیم و سهم آنها را در ICM و تروفکتودرم آشکار کردیم (شکل تکمیلی. S7a). به طور قابلتوجه، تکثیر تک سلولی تک سلولی در جنینهای موش، با 31.25 درصد از جنینهای کایمریک، تک سلولی تک سلولی را نشان میدهند (شکل تکمیلی. S7b و جدول S1). علاوه بر این، تزریق همزمان biPSC های نشاندار شده با گوجه فرنگی و سلول های بنیادی جنینی موش نشاندار شده با GFP (mESCs) منجر به همپوشانی فضایی سیگنال های فلورسانس قرمز و سبز شد (شکل تکمیلی. S7c، پتانسیل توسعه مشترک بین biPSCها و mESCها را در ریزمحیط جنینی پیشنهاد می کند.
در مرحله بعد، پتانسیل کایمریک biPSCها را در جنینهای موش پس از لانهگزینی ارزیابی کردیم (شکل XNUMX). 1e). ما 553 بلاستوسیست کایمریک مشتق شده از biPSC های نشاندار شده با GFP را در 33 موش جانشین کاشتیم. حاملگیهای موفقیتآمیز اتفاق افتاد و جنینهای کایمریک در روز 8.5 جنینی (E8.5) جمعآوری شدند. کایمریسم با استفاده از PCR ژنومی با پرایمرهای اختصاصی خفاش تایید شد (شکل تکمیلی. S8aو تجزیه و تحلیل mtDNA نسبت های بالایی از کایمریسم را در 8 جنین از هر 10 جنین نشان داد که 3 مورد بیش از 1/1000 بود (شکل XNUMX). 1k). سنجش IF در E10.5 بیان GFP قابل توجهی را در نمونه های کایمریک نشان داد (شکل تکمیلی. S8b، با بیان مشترک GFP و نشانگرهای دودمان که نشان دهنده تمایز biPSCها به هر سه لایه زاینده در جنین های موش کایمریک است (شکل XNUMX). 1l). یافتههای ما پتانسیل کایمریک قابلتوجه biPSCs را در جنینهای اولیه موش نشان میدهد، اگرچه این پتانسیل ممکن است با پیشرفت رشد موش کاهش یابد، و بنابراین ما به وایمرهای بینگونهای نوزاد دست یابیم.
سپس پتانسیل کایمریک biPSCها را در جنین خوک بررسی کردیم. biPSC های نشاندار شده با GFP به جنین های بکرزای خوک E5 تزریق شدند. در بین جنین های تزریق شده، 92.79٪ فلورسانس GFP را با میانگین 14.14 ± 1.14 biPSC در هر بلاستوسیست نشان دادند (شکل تکمیلی. S9a–c). رنگآمیزی IF سهم biPSCها را در ICM با میانگین 3.78 ± 0.31 biPSC در هر ICM نشان داد (شکل تکمیلی. S9d، e). این نتایج زنده بودن و قابلیت ادغام biPSCها در ICM جنین های اولیه خوک را برجسته می کند.
ما همچنین پتانسیل کایمریک biPSCها را در جنین خوک پس از لانه گزینی ارزیابی کردیم. ما 610 بلاستوسیست کایمریک بارور شده در شرایط آزمایشگاهی را به 4 خروس جانشین پیوند زدیم. هر 4 جانشین باردار شدند و در مجموع 39 جنین بین E25-E27 جمع آوری شد. ژنوتیپ MtDNA 11 جنین را به عنوان کایمرا تایید کرد، با کایمریسم biPSCs بیش از 1/10,000 (شکل XNUMX). 1m). رنگآمیزی IF با آنتیبادی GFP بر روی بخشهایی از این جنینهای کایمریک، حضور سلولهای خفاش را بیشتر تأیید کرد (شکل تکمیلی. S10). رنگ آمیزی IF نشانگرهای دودمان، تمایز biPSCها را به هر سه لایه جوانه جنینی در جنین های خوک کایمریک نشان داد (شکل XNUMX). 1n). این یافتهها نشان میدهد که biPSCها کارایی کایمریک بالاتری را در جنینهای خوک اولیه نشان میدهند و توانایی تمایز به هر سه لایه جوانه جنینی را در داخل بدن دارند.
در این مطالعه، ما ادغام موفقیتآمیز biPSCها را در جنینهای موش و خوک قبل از لانهگزینی مشاهده کردیم. با این حال، کایمریسم مشاهده شده در جنین های پس از لانه گزینی محدود بود، که ممکن است تحت تأثیر عواملی مانند فاصله تکاملی، دوره بارداری و رقابت سلولی باشد. مطالعات قبلی نشان داده است که ESCهای موش صحرایی و iPSCهای موش قادر به کمک به جنین خوک نبودند و سهم PSCهای انسانی در جنین های پس از لانه گزینی خوک بسیار محدود بود.4. این محدودیت ممکن است به فاصله تکاملی بین گونه ها نسبت داده شود5. واگرایی تکاملی بین خفاش ها و موش ها، تخمین زده می شود که تقریباً 94 و 81 میلیون سال پیش رخ داده است.http://www.timetree.org/به ترتیب، ممکن است به طور قابل توجهی بر کارایی xenochimerism تأثیر بگذارد.
در این مطالعه، بالاترین نسبت کایمریسم و نسل موفق جوجههای کایمریک زنده هنگام تزریق biPSCها به جنین جوجه مشاهده شد. جوجههای کایمریک تمایز biPSCها را به سلولهای عملکردی در سیستم عصبی نشان دادند و بینشهای ارزشمندی را در مورد توسعه و تمایز biPSCها در میزبانهای هترولوگ ارائه کردند. جنین جوجه یک مدل تجربی تثبیت شده برای پیوند زنوگرافت است که یک سیستم مناسب برای مطالعه رشد و تمایز جنین ارائه می دهد.6. جنین جوجه یک سیستم ارزیابی موثر برای پتانسیل رشد سلول های خارجی در داخل بدن فراهم می کند، زیرا مطالعات قبلی پرتوانی PSC های انسانی را در جنین جوجه نشان داده اند.7. افزایش کارایی کایمرا خفاش/جوجه ممکن است به دلیل تعداد سلولهای تزریق شده اولیه و عدم توسعه کامل سیستم ایمنی در جنینهای جوجه باشد.8که منجر به کاهش رد سلول های اگزوژن شد. کایمریزم گناد محدود به دلیل تزریق در مرحله رشد پیشرفته تر (HH14-HH15) در مقایسه با مرحله بلاستوسیست بود. آزمایش مراحل مختلف تزریق، محلها و روشهای مختلف در مطالعات آینده ممکن است نتیجه کایمریسم را بهبود بخشد.
به طور کلی، ما biPSCهای عاری از ژن را با الکتروپوراسیون پلاسمیدهای اپیزومی تولید کردیم. این biPSCها پتانسیل کایمریک را در سه حیوان مدل نشان دادند. iPSC های بدون تراریخته کیفیت بالاتری دارند، زیرا سوگیری تمایز دودمان سلولی ندارند و از خطر تشکیل تومور و مرگ در فرزندان کایمریک جلوگیری می کنند.9,10,11. آنها همچنین می توانند به طیف گسترده ای از انواع سلول ها یا ارگانوئیدها متمایز شوند12 تحت شرایط مناسب biPSCهای ما این پتانسیل را دارند که در شرایط آزمایشگاهی به ارگانوئیدهای مربوطه متمایز شوند و تحقیقات مکانیکی در مورد طول عمر خفاش، دفاع ضد ویروسی و پژواکیابی را امکانپذیر میسازند.
- محتوای مبتنی بر SEO و توزیع روابط عمومی. امروز تقویت شوید.
- PlatoData.Network Vertical Generative Ai. به خودت قدرت بده دسترسی به اینجا.
- PlatoAiStream. هوش وب 3 دانش تقویت شده دسترسی به اینجا.
- PlatoESG. خودرو / خودروهای الکتریکی، کربن ، CleanTech، انرژی، محیط، خورشیدی، مدیریت پسماند دسترسی به اینجا.
- PlatoHealth. هوش بیوتکنولوژی و آزمایشات بالینی. دسترسی به اینجا.
- ChartPrime. بازی معاملاتی خود را با ChartPrime ارتقا دهید. دسترسی به اینجا.
- BlockOffsets. نوسازی مالکیت افست زیست محیطی. دسترسی به اینجا.
- منبع: https://www.nature.com/articles/s41421-023-00587-3